二甲双胍联合抗阻运动对糖尿病大鼠下丘脑TGF-β1-Smad2/3的影响①
2021-05-17江秉泽余思慧张蕴南纪梦迪李佳欣韦娟
江秉泽 余思慧 张蕴南 纪梦迪 李佳欣 韦娟
(南京体育学院运动健康学院 江苏南京 210014)
糖尿病作为慢性非传染性疾病具有高发病率、高致死率、高致残率的特点,其中2型糖尿病(Diabetic Mellitus,DM)占据糖尿病患者的多数。机体脏器的胰岛素抵抗是产生2型糖尿病的重要原因[1],下丘脑是神经内分泌的调控中心,可以通过直接和间接调控维持血糖的稳定,维持内环境的稳态。下丘脑的腹内侧核和腹外侧核与摄食饮水有着重要的联系,糖尿病患者常出现多饮、多食、多尿、体重减轻的“三多一少”现象[2]。张晓明对糖尿病大鼠下丘脑切片染色,发现糖尿病大鼠下丘脑线粒体嵴消失,神经元之间突出结构蜕变,提示高糖环境下丘脑纤维化损伤严重[3]。
转化生长因子-β(transforming growth factor-β,TGF-β)是一组与细胞生长分化相关的细胞因子,在机体受伤组织和愈合伤口、细胞分化能力高的组织较为常见。TGF-β在细胞中广泛存在,但基本无生物学活性。TGF-β1与其受体结合后,下游蛋白Smad2/3发生磷酸化,与Smad4结合形成异源复合体,转位进入细胞核调控机体生长修复、组织纤维化等[4]。
二甲双胍和运动作为常见改善糖尿病血糖干预措施,能有效提高外周血糖利用率,提高细胞外胰岛素受体敏感性[5-6]。但关于药物联合抗阻运动对糖尿病大鼠下丘脑损伤的研究较少,该研究利用糖尿病大鼠模型,检测抗阻运动和二甲双胍干预对下丘脑TGF-β1、Smad2/3蛋白表达影响。
1 材料和方法
1.1 主要材料
1.1.1 主要试剂
TGF-β1、Smad2/3抗体(Proteintech Group,Rosemont),血糖仪(德国罗氏诊断有限公司)、高速离心冷冻机(美国BEKMAN COULTER)。

图1 抗阻训练运动负荷图

图2 血糖变化趋势图
1.1.2 实验动物
SD雄性大鼠,体重(145±15)g,购自浙江省实验技术中心。大鼠饲养环境,昼夜自然节律变化,温度(20±3)℃,相对湿度55%~75%,大鼠自由摄食饮水。
1.2 方法
1.2.1 分组与造模
50只SD雄性大鼠为期1周适应性饲养后,随即抽取10只为正常对照组。以普通饲料喂养,自由进食饮水,自由活动,无运动干预。其余40只随机分成4组,糖尿病组、药物组、抗阻运动组、药物联合抗阻运动组进行糖尿病建模。高脂饲料喂养4周后,SD雄性大鼠停止饮食,不禁止饮水,以35mg/kg体重腹腔注射1%SZT注射液。对照组大鼠一次性注射同剂量的柠檬酸缓冲液(pH=4.4)。
正常组(NC组)自由活动,正常饲料喂养,每日7.5ml/kg的双蒸水灌胃1次;糖尿病组(D组)自由活动,高糖高脂饲料喂养,每日7.5ml/kg的双蒸水灌胃1次;药物组(M组)自由活动,高糖高脂饲料喂养,300mg/(kg·d)的份量与7.5ml/kg双蒸水制成二甲双胍悬浊液进行灌胃1次;抗阻训练组(P组)抗阻训练,6周×6次/周;2组/d;3次/组,次间休息1min,组间休息2min。运动负荷如图1所示。
1.2.2 指标的测定
大鼠饲养5周后测定血糖水平,腹腔注射1%的链脲佐菌素和柠檬酸红冲液72h后再测定空腹血糖值,血糖值≥16.7mmol/L认为造模成功,造模1周后进行空腹血糖的复测,以确保糖尿病模型的成功。造模成功后实施分组干预方案,每2周为周期进行空腹血糖检测直至实验结束。
干预结束后,所有大鼠禁食禁水48h,10%水合氯醛腹腔注射麻醉,解剖取血后,将大鼠颅骨沿正中剪开,暴露全脑,在冰盘上迅速剥离下丘脑,将下丘脑组织放入2cm的含有编号冻存管中放入液氮中保存,后移至-80℃冰箱保存备用。从上述大鼠中提取下丘脑组织存于-80℃冰箱,每个样本取0.1g大鼠下丘脑组织,使用碧云天RIPA裂解液提取蛋白、根据Thermo Scientific的BCA蛋白定量试剂盒定量蛋白。调节蛋白浓度为5μg/μl,经5×loading buffer稀释后,蛋白浓度为4μg/μl,上样量为15μl,聚丙烯凝胶电泳分离蛋白后,转移到PVDF膜。快速封闭液封闭15min,一抗过夜,次日TBST洗膜3次,5min/次。二抗孵育,结束后TBST洗膜3次,5min/次。洗净后,ECL化学发光液孵育3min,使用数码凝胶成像分析系统显影,Image lab分析条带灰度值。
1.2.3 数据统计
所有数据均用JMP 14.0统计软件进行统计,各数据用均值±标准差()的形式表现,组间比较应用t检验,多组之间比较采用双因素方差分析进行统计,以P<0.05作为差异显著性的界值。
2 结果
2.1 血糖
如图2所示,造模前各组内无明显差异。2周后M组与D组比较,血糖水平显著下降(P<0.05),P组血糖有所下降,但无统计学意义(P>0.05),MP组血糖显著降低(P<0.01),M组和MP组无明显差异(P>0.05)。4周后,M组与D组对比,血糖水平显著下降(P<0.05),MP组较D组血糖显著下降(P<0.01),MP组较M组,降血糖效果降低(P≤0.05),P组血糖水平下降,无统计学差异(P>0.05)。6周后,M组血糖水平对比D组有所下降,P组血糖下降(P<0.05)。MP能够显著降低糖尿病血糖(P<0.01),但降血糖水平低于单纯药物干预(P<0.05),P组和MP组血糖值无明显差异(P>0.05)。纵向比较,随着药物干预时间的延长,降血糖效果无显著性差异(P>0.05),随着运动干预时间的延长,降血糖效果无明显差异(P>0.05),随着联合干预的时间的延长,第6周降血糖水平较第4周下降较为明显(P<0.05)。
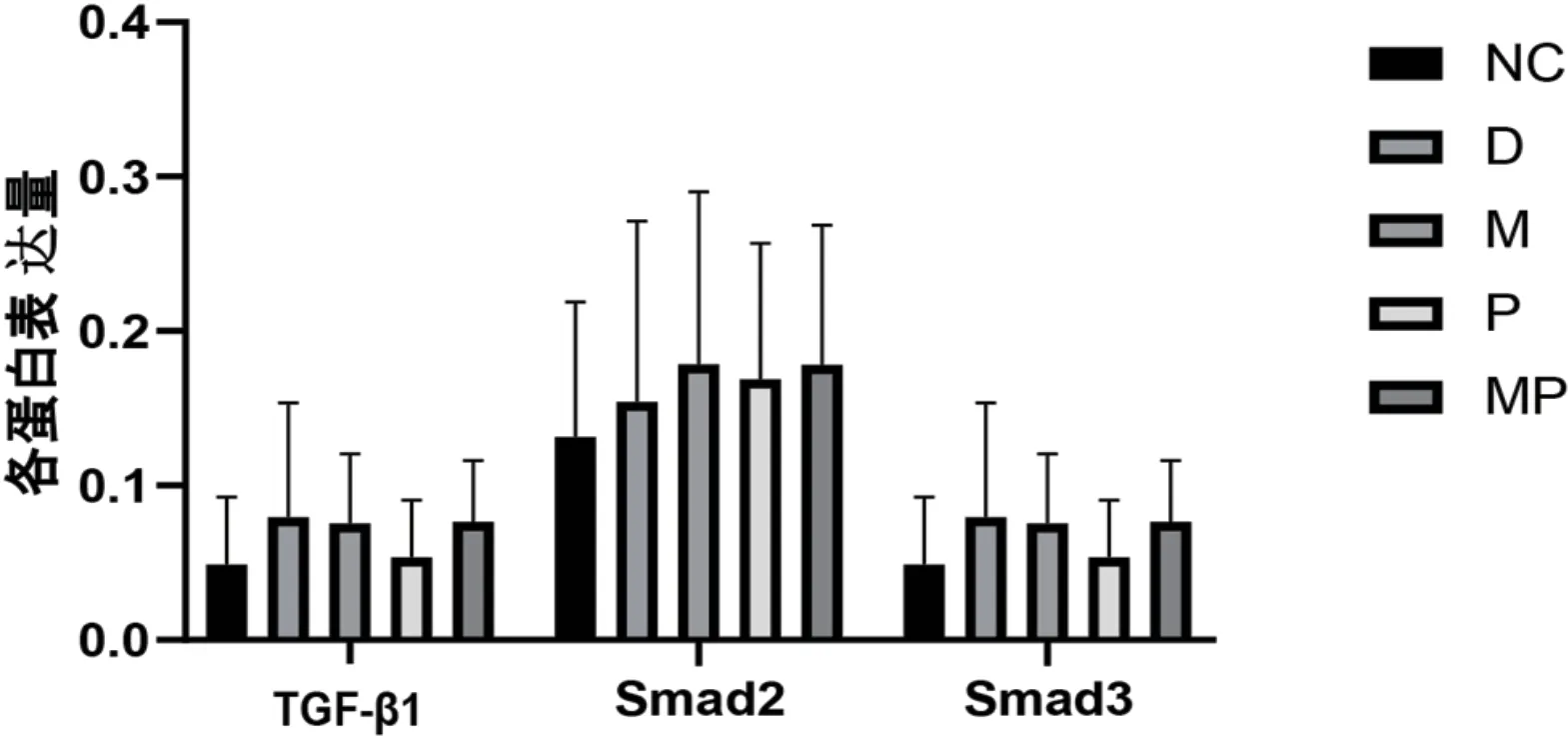
图3 Western-blot检测各组大鼠TGF-β1-Smad2/3蛋白表达
2.2 Western-blot结果
如图3、图4所示,结果显示糖尿病组大鼠下丘脑TGF-β1高于正常组,但无统计学差异(P>0.05),药物组和抗阻组TGF-β1略低于糖尿病组,但仍高于正常组,且均无统计学差异(P>0.05),药物联合抗阻运动组TGF-β1表达量略低于糖尿病组,但高于抗阻组,无统计学差异(P>0.05)。Smad2糖尿病组表达量较正常组升高,抗阻组和药物组均有一定的升高,抗阻联合药物组升高趋势最为明显,但无统计学差异(P>0.05),Smad3各组之间无明显差异(P>0.05)。
3 讨论
抗阻训练作为常用的训练方式,可以多方面训练躯体的肌肉群,增加肌肉对血糖的摄取利用,增加胰岛素受体的数量和敏感性[7],起到降低血糖的作用。二甲双胍作为一种常用的临床药物,通过AMPK途径激活PKC,调控下游蛋白发生磷酸化,抑制肝脏糖异生和促进外周组织对血糖的摄取利用。该研究发现,运动训练和二甲双胍单独干预均可以使糖尿病大鼠血糖水平下降[8-9],这与以往研究一致。该研究发现,二甲双胍药物干预2周后,M组血糖水平明显低于D组;抗阻训练干预后,在6周训练前血糖水平无明显的改变,提示抗阻运动对糖尿病大鼠的血糖降低效果与持续训练的周期有着密切的联系,至少要持续6周的负重抗阻训练才能起到降血糖的作用。与预期相反,抗阻运动和二甲双胍联合运动对糖尿病大鼠血糖的调控效果相似,随着运动周期的延长,甚至有所下降,提示运动和二甲双胍对血糖降低可能存在一定的拮抗作用。沈文清认为[10],这种抑制作用可能是运动干预抑制了二甲双胍药物动力学活性,同时二甲双胍抑制了线粒体呼吸链复合体Ⅰ活性,且运动本身会加强肝糖原释放,补充运动过程中血糖的消耗,血糖上升,这种运动血糖上升的机制与二甲双胍降血糖的作用相悖,所以降低了二甲双胍的降血糖效果。此外,二甲双胍可以通过对三羧酸循环中关键酶的调节,降低线粒体ROS水平[11],但运动过程中,能量消耗增加,线粒体氧化磷酸化水平增加,ROS产生增多[12]。与上述结论相反,黄安华[13]发现1年抗阻运动结合二甲双胍服用,可以有效地改善胰岛素抵抗指数,对血糖水平也有着明显的改善作用。沈文清[14]发现急性运动结合二甲双胍干预较单独干预能够更加显著地改善2型糖尿病小鼠血糖稳态和肝脏糖异生情况。对于这种不同的现象,可能与二甲双胍服用的剂量、药物服用与运动的间隔时间、运动的方式、运动剂量密切相关。把握运动强度和药物服用的时间,逆转两者叠加的抵消作用是药物治疗和运动治疗结合的关键之处。
TGF-β1是Smad2/3的上游蛋白,与器官的纤维化有着密切的联系。在高糖环境下,各器官脏器都出现了纤维化的现象,器官的形态和功能都受到了严重的影响。张晓明[3]对糖尿病大鼠的肝脏、肾脏和下丘脑等组织进行了染色切片,发现上述器官的纤维化水平对照正常大鼠明显加剧。与以往实验结果相反,此实验通过Westernblot的方式对蛋白表达量进行检测发现,D组大鼠下丘脑TGF-β1、Smad2/3表达水平与C组均无明显差异。此外,分别将P组、M组和MP组与D组进行比较,发现各组之间的TGF-β1和Smad2/3蛋白表达量无明显差异。施若黎[15]研究发现,大鼠高脂饲料喂养后,15mg/kg剂量2次腹腔注射2%SZT注射液建模,染色切片发现下丘脑纤维化程度严重,糖尿病大鼠TSP-1、TGF-β1表达量上调。实验大鼠以35mg/kg腹腔注射1%SZT注射液建模,D组和C组TGF-β1、Smad2/3蛋白尚未发现差异,提示糖尿病器官损伤可能和建模STZ注射剂量相关。修贤杰[16]认为小剂量的STZ多次注射联合高糖高脂饮食是较佳的糖尿病大鼠建模方式,较好地模拟了糖尿病代谢特征和进展过程,而一次性大剂量注射可能会引起胰岛细胞的过度损伤,糖尿病大鼠成模率下降,死亡率提高。同批次大鼠的心肌的TGF-β1表达量进行检测[17],发现D组和P组发生显著性提高,与D组相比,M组、P组MP组的蛋白表达量却明显下降。由此推测,高糖环境对于同一个体的不同器官的毒害进程存在时间顺序,《中国糖尿病指南》依照糖尿病肾病进展,将糖尿病分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四期,随着糖尿病进程逐渐加剧,推测糖尿病下丘脑损伤也存在时间进程的差异,由于实验条件的限制,未对该批糖尿病大鼠下丘脑染色切片,观察下丘脑损伤程度。尚不能认为此实验6周高糖环境对下丘脑造成损伤。

图4 TGF-β1、smad2/3条带图
