乳酸菌发酵降低牛乳蛋白致敏性的研究进展
2021-05-15王宏鑫马鸣阳刘衍辰朱雪梅牟光庆姜淑娟吴晓萌
王宏鑫,马鸣阳,刘衍辰,朱雪梅,牟光庆,姜淑娟,吴晓萌,钱 方
(大连工业大学食品学院 辽宁大连116034)
乳制品中含有人体必需的氨基酸和丰富的钙、磷,是人类不可缺少的营养制品,尤其对于婴幼儿来说,牛乳是除母乳之外的重要营养物质。乳制品是引起过敏的食物之一,乳蛋白是主要过敏原。乳制品过敏是指人摄入过敏原成分后,导致组织或器官的损伤,从而引起的一系列临床症状的免疫反应,可分为IgE 介导和非IgE 介导两大类。牛乳过敏存在着巨大的危险性,牛奶蛋白过敏会导致儿童出现异常反应,影响某些器官包括皮肤、胃、肠道、呼吸系统等,会造成荨麻疹、哮喘、鼻炎和过敏性休克等严重反应。流行病学的研究结果显示,乳蛋白过敏在婴幼儿中最为普遍,发生率约为2%~6%[1],随着人类基因遗传的提高,大约有20%的婴儿在1 岁时食用乳制品后会发生乳蛋白过敏现象[2],因此研究解决乳制品过敏问题尤为重要。现阶段,降敏方法包括热加工、高压、物理加工(如高压微射流、辐射等)、糖基化反应,这些处理方式虽能部分降低乳蛋白的过敏原性,但都存在不可避免的缺陷,如破坏现有过敏表位并产生新的表位、蛋白变性,影响营养价值。比较而言,蛋白酶水解乳蛋白的降敏效果较好,可以突破其它降敏方法的局限性,然而会产生苦味肽,影响口感和风味[3]。乳酸菌发酵技术既可以有效降敏,又可以保证营养成分。乳制品是传统的乳品加工储存方法,发酵乳制品具有口感好,易吸收,调节免疫和安全可靠的优势,可能是降低乳蛋白致敏性的有效方式。本文系统阐述发酵对乳蛋白过敏研究现状,为降低乳蛋白过敏性和低致敏乳蛋白产品的开发提供参考。
1 过敏反应原理
人体摄入乳制品后引起身体不适的原因有2种:乳过敏反应或乳糖不耐受症。这2 种病理反应有本质区别,乳糖不耐受症与人体的基因有关,乳糖酶的缺乏导致机体不能利用乳糖,从而导致不良反应的产生[4]。乳过敏反应可分为IgE 介导和非IgE 介导两大类。牛乳过敏反应则是由免疫球蛋白(IgE) 介导的I 型超敏反应,也称速发型变态反应,它是一种免疫性疾病,包括致敏和效应2 个阶段[5]。致敏阶段和过敏阶段过敏原被摄入后,机体免疫系统产生过敏原特异性IgE 抗体,IgE 抗体与肥大细胞膜、嗜碱性粒细胞膜表面的特定受体结合,使机体处于致敏状态。随后再次摄入同一过敏原后,过敏原与IgE 发生桥联,诱导细胞脱颗粒,释放组胺、白三烯、激肽和嗜酸性粒细胞趋化因子等一系列炎症介质而触发食物过敏症。这些介质引起过敏反应,表现为身体各部位的不同发病症状,如荨麻疹、哮喘、鼻炎和过敏性休克等[6]。由于婴儿的先天性器官发育不成熟免疫系统不发达,在摄入乳制品后,消化系统不能完全消化,免疫系统会发生变态反应,从而导致婴儿过敏现象的发生。非IgE 介导的食物过敏临床表现为胃肠道功能紊乱,包括食物蛋白刺激的结肠炎,过敏性胃肠炎、乳糜泻等。在这类过敏反应中,由于Th2 细胞因子的释放,调节T 细胞细胞因子的缺乏,从而导致食物过敏[7]。
2 过敏反应表位
食物过敏属于免疫学中的一种变态反应,其反应的物质基础之一就是抗原表位,因此,食物的过敏原性与抗原表位关系密切。表位(原决定因素)是免疫分子(主要是蛋白质)的一部分,它可以与抗体互补的位点结合。蛋白结构中的表位决定了蛋白的抗原性或者过敏原性[2]。根据过敏原表位与细胞结合的方式,可分为B 细胞表位和T 细胞表位,根据表位结构的不同可分为连续性过敏原表位(线性表位)和不连续性过敏原表位(构象型表位)[8]。连续表位或线性表位是由蛋白质的一级结构中连续氨基酸残基序列组成,不连续的表位或构象表位由不连续的氨基酸残基序列构成,由于蛋白质本身的二级或三级结构折叠、聚集在一起[9],其中一种蛋白质结构中几个点上可能包含不同的或相似的抗原表位,而只有少数具有免疫性易被免疫系统识别[10],抗原表位的结构及组成抗原表位氨基酸的理化性质决定了它的抗原特异性[9]。过敏原被IgE 抗体识别并与之结合,引起特异性个体反应,即过敏原性。而抗原与IgG 抗体结合产生抗原性[11],许多牛乳蛋白能产生免疫反应,它们或是抗原或是过敏原,或者两者都是。
3 乳制品的过敏原及其分子特征
每100 mL 牛奶中含有约3 g 蛋白质,其中蛋白质至少含有25 种类型,所有这些蛋白质都可能作为抗原。牛奶蛋白在pH 4.6 和20 ℃下溶解后被分离成两大类,其中沉淀的蛋白质组为酪蛋白,包括αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白,第2 种蛋白质组称为乳清蛋白,包括β-乳球蛋白[β-LG]、α-乳清蛋白[α-LA]、牛乳铁蛋白、牛血清白蛋白[BSA]和牛免疫球蛋白。目前,能够引起婴幼儿主要的过敏现象的蛋白是酪蛋白(α-酪蛋白[α-CN]、β-酪蛋白[β-CN])、β-乳球蛋白(β-LG)、α-乳清蛋白(α-LA)。表1中介绍了主要蛋白的基本信息。
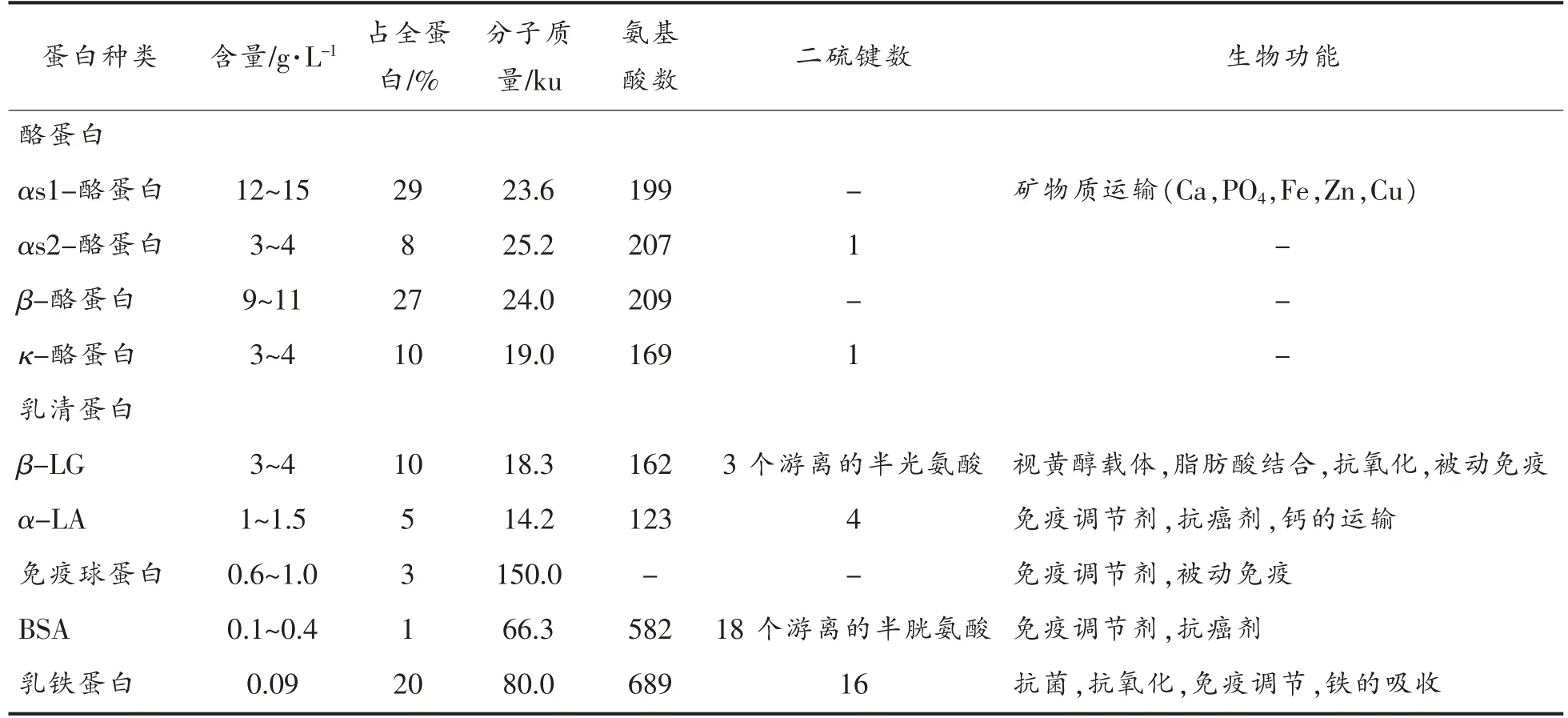
表1 生牛乳蛋白主要成分及功能特征[12]Table 1 Main components and functional characteristics of milk proteins[12]
3.1 酪蛋白
酪蛋白(Casein)是哺乳动物包括母牛、羊和人奶中的主要蛋白质,约占牛奶总蛋白的80%,又称干酪素、酪朊、乳酪素。α-酪蛋白是哺乳动物的主要蛋白,人乳常以β-酪蛋白为主要酪蛋白形式。酪蛋白不仅是婴幼儿氨基酸的重要来源,也是钙和磷的来源,然而酪蛋白在胃中形成凝乳消化较慢。酪蛋白为非结晶、非吸潮性物质,常温下在水中可溶解0.8%~1.2%,微溶于25 ℃的水和有机溶剂,溶于稀碱和浓酸中,能吸收水分,浸入水中迅速膨胀,而分子不结合,酪蛋白由位于同一染色体上的不同基因编码,被细分为不同的家族α-酪蛋白(α-CN)(αs1-酪蛋白、αs2-酪蛋白)、β-酪蛋白(β-CN)和κ-酪蛋白,其中的主要过敏原是α-酪蛋白、β-酪蛋白。
3.1.1 αs1-酪蛋白 αs1-酪蛋白是牛乳蛋白中的主要成分,它是一种高度磷酸化蛋白,多数情况下每个αs1-酪蛋白上有8 个磷酸基团存在,还有少数的含有9 个磷酸基团。它的氨基酸序列已经确定或者通过其它哺乳动物的DNA 序列推断出。所有的αs1-酪蛋白都有复杂的磷酸化作用位点,其中第100~110 位氨基酸残基处是一个主要的磷酸化位点,磷酸化作用发生在苏氨酸和丝氨酸残基上,其氨基酸序列如图1所示[13-14]。当天冬氨酸或谷氨酸位于这一序列的第3 个位置时,这个位点是最主要的磷酸化位点。磷酸化的丝氨酸和苏氨酸也可以成为其它丝氨酸磷酸化作用的决定因素,这些磷酸化位点又叫做次磷酸化位点,这些结构的典型特征是6~8 个丝氨酸后连接2 个谷氨酸。牛奶中的αs1-酪蛋白存在2 个磷酸化形式,这2 种磷酸化形式中每个αs1-酪蛋白分别存在8个和9 个磷酸基团。Cong 等[15]获得了αs1-酪蛋白的3 个IgG 结合表位(AA21~35,AA56~70,AA161~175) 和4 个IgE 结合表位,分别为(AA126~140,AA6~20,AA171~185,AA11~25)。Ruiter 等[16]研究得到αs1-酪蛋白与T 细胞结合的表 位 (AA43~66,AA73~96,AA91~114,AA127~180)。

图1 αs1-酪蛋白B 异构体的氨基酸序列[17]Fig.1 Amino acid sequence of αs1-casein B isomer[17]
3.1.2 αs2-酪蛋白 αs2-酪蛋白是α-酪蛋白的重要组成成分。α-酪蛋白是由αs1-酪蛋白和αs2-酪蛋白以4∶1 的比例组成。与αs1-酪蛋白一样,αs2-酪蛋白也是高度磷酸化的肽类。牛奶中含有4 种磷酸化亚型,每个αs2-酪蛋白分别含有10,11,12,13 个磷酸化基团。αs2-酪蛋白约占总酪蛋白的10%,在所有酪蛋白中亲水性最强,其结构中有3 簇带负电的磷酸丝氨酸-谷氨酸残基,位于8~12、56~63 和129~133 氨基酸区段,仅有C 序列的160~207 位和90~120 位2 个区域相对疏水。在αs2-酪蛋白表位研究中,Busse 等[18]定位到4 个主要IgE 结合表位 (AA83~100,AA143~158,AA15~172,AA165~188),其中(AA143~158)有1 个磷酸化位点,可以增强致敏性。
3.1.3 β-酪蛋白 β-酪蛋白由226 个氨基酸残基组成,β-酪蛋白含有大量的谷氨酰胺,在N-末端附近形成了主要的磷酸化作用位点,β-酪蛋白磷酸化位点的数量和磷酸化水平比α-酪蛋白少。虽然人乳中有大量β-酪蛋白,且与牛乳有较高的β-酪蛋白的相似序列,且β-酪蛋白诱导较强的IgE反应,在牛乳β-酪蛋白中,一个完全磷酸化形式包含5 个磷酸基团,而在其它物种的β-酪蛋白含有大量的磷酸化作用形式,如人、山羊等。在β-酪蛋白中脯氨酰基(Proly-)有相当高的频率,因亚氨基酸形成肽键后,不能参与氢键的形成,加上其α-碳原子位于五元环上,两侧的键难于旋转,不易形成α-螺旋,故脯氨酸是倾向于瓦解α-螺旋的。刘法辉[19]定位出β-酪蛋白的4 个构象表位,如图2所示,其中有构象表位AA135~139 和构象表位AA183~187。
3.2 β-乳球蛋白
如图3所示,β-乳球蛋白(β-lactoglobulin,β-LG)是属于糖酵解酶家族的一种单聚球状钙化金属蛋白,已被确认为牛奶中的主要过敏原。其一级结构为123 个氨基酸,分子质量为142 ku,有3个遗传变异体。该蛋白是β-半乳糖基转移酶系统的调节组分,负责乳糖合成酶复合物的合成。它还与脂膜(硬脂酸和棕榈酸)相互作用,并与钴、镁和锌等金属结合。它有4 个二硫键和1 个高亲和力的钙结合位点,以稳定其二级结构。牛乳β-乳球蛋白由反刍动物乳腺上皮细胞合成,其含量约占乳清蛋白总量的一半左右。82%的牛乳过敏人群对β-LG 过敏[20],其属于Lipocalin 家族[21],在N-端有不易被破坏的相似序列,像家族其它蛋白质一样在第19 位是色氨酸。天然单体β-LG 的二级结构由1 个α-螺旋、1 个β-转角和8 个β-反平行片层组成[22],中心处是疏水腔。LG 属于水溶性球状蛋白[23],共含有162 个氨基酸,等电点是5.3,有5 个半胱氨酸残基并形成2 个二硫键。其中第66和160 位形成位于蛋白表面的1 个二硫键[24];第106 和119 形成包埋于分子内部的1 个二硫键;第121 位半胱氨酸残基不形成二硫键,处于游离状态。β-LG 分子天然状态主要以二聚体形式存在,共有11 个遗传变异体[20],最主要是亚型A 和B[25],亚型A 和B 差异较小仅仅在64 位(缬氨酸ValA-丙氨酸AlaB)和118 位(天门冬氨酸AspA-甘氨酸GlyB)的氨基酸有差异[26]。自然状态下,β-乳球蛋白免疫反应区域的主要过敏原表41~60、102~124 与149~162 位,可被90%~100%过敏患者的血清识别:在肽链1~8 位、25~40 位、92~100位的表位可被50%~65%过敏患者的血清IgE 识别[27]。Selo 等[28]进一步研究确定了β 乳球蛋白的人血清IgE 表位为肽链1~8、25~40、41~60、102~124与149~162 位,同时这些表位也被致敏的大鼠所识别。

图2 β-酪蛋白氨基酸序列表位[19]Fig.2 β-casein amino acid sequence epitope[19]
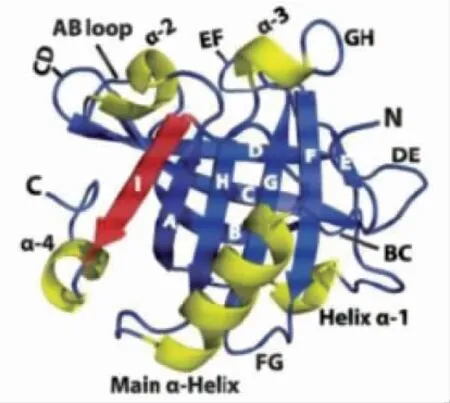
图3 β-乳球蛋白的单体的飘带图(α-螺旋、β 折叠和连接环被标识出来)[29]Fig.3 A ribbon diagram of a monomer of βlactoglobulin (an α-helix,a β-sheet,and a linker are identified)[29]
3.3 α-乳清蛋白
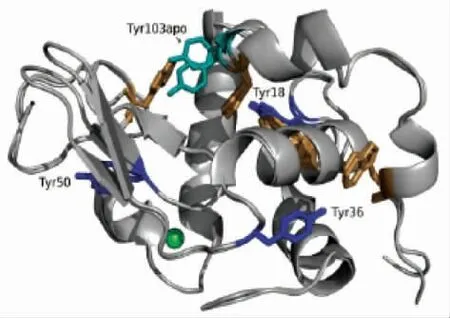
图4 牛乳α-乳白蛋白的晶体结构[30]Fig.4 Crystal structure of cow's milk α-lactalbumin[30]
如图4所示,α-乳清蛋白 (α-lactalbumin,α-LA)是属于脂质运载蛋白超家族的视黄醇结合蛋白,也是牛奶中的主要过敏原。它与胆固醇、维生素D2、饱和或不饱和脂肪酸、Cu2+和Fe2+离子、疏水配体(如视黄醇)结合,具有抗氧化活性。它是具有2 个主要亚型的36 ku 二聚体,其在残基64 和118 上仅有2 点突变而不同。每个亚基由162 个氨基酸组成,其具有1 个游离半胱氨酸和2 个二硫键,该二硫键负责分子的二聚作用。由氨基酸的组成比例可以看出,母乳与牛乳的α-乳球蛋白存在极大的相似性,大约为72%的相似序列,因此牛乳中的乳球蛋白可以作为重要营养成分供婴儿食用。α-乳球蛋白是一种单体,以钙结合形式存在的球状蛋白,因为对钙的亲和性大,所以影响其二级结构的稳定性[31]。对α-乳球蛋白的过敏原性研究表明,α-LA 的4 个不同线性IgE 结合肽段和IgG结合区域相重合[32],该蛋白在脂质蛋白超家族中具有共同特征的三级结构,在75 ℃以上的热处理过程中,不同线性IgE 结合肽段和IgG 结合区域中硫酸氢基-二硫键相互作用。β-LG 具有对酸水解的相对耐受性,以及蛋白酶活性。这些特征能够在消化后保持一定的结构完整性,使其通过肠粘膜吸收,并进一步向免疫感受态细胞呈递,在80%的人群中估计与该蛋白相关的食物过敏。在研究线性表位的过程中,Meulenbroek 等[33]在研究α-乳白蛋白T 细胞表位的线性表征时,得出了(AA19~36,AA25~42,AA31~48,AA43~60)4 个肽段,其中作为T 细胞与IgE 拥有相同的(AA19~26)结合表位。Jarvinen 等[34]研究4个结合表位(AA1~16,AA13~26,AA47~58,AA93~102) 和 3个IgG(AA7~18,AA51~61,AA89~108)的结合表位,其中共有的结合表位是AA7~18 和AA51~58。
4 常用检测乳制品过敏原手段
4.1 酶联免疫分析技术
酶联免疫分析技术(ELISA)的原理是将抗原或抗体吸附于固相载体上,加入待检测样品和酶结合物反应后,再利用酶催化其底物呈色的反应,来检测抗体或抗原的方法。通常ELISA 测定方法包括间接法、双抗体夹心法和抗原竞争法。
4.2 生物传感器
生物传感器被认为是新出现的过敏原检测工具,因为它们是快速、可重复和高度敏感的方法,具有很大的自动化潜力。简而言之,生物传感器是基于直接识别受体(抗体或探针)与目标分子(蛋白质或DNA)之间的生物相互作用,通过传感器产生可测量的信号。
4.3 圆二色光谱
圆二色光谱(CD)能够用来检测蛋白质的二级结构包括α-螺旋、β-折叠以及无规卷曲,广泛应用于观察过敏原蛋白二级结构的折叠情况[14]。此外,用于检测蛋白质的三级结构的方法有荧光光谱和核磁共振2 种方法,是用于蛋白质的高级结构检测方法[16]。
4.4 氨基酸分析
氨基酸分析(Amino acid analysis)是用酶解的方法将肽链打开,形成单一的氨基酸残基,用于鉴定纯化的蛋白质,检测基本的初级结构[35]。虽然氨基酸分析的功能和检测效果具有极强的优势,但缺点是硬件配置复杂,用途狭窄,灵活性差,分析检测时间长,破坏氨基酸的固有结构,费用高昂,不适合作为常规使用技术。
4.5 聚合酶链反应
聚合酶链反应(PCR)是特异性DNA 片段扩增的一种检测方法,有实时荧光定量PCR 和普通PCR 两种方法。普通PCR 主要用于模板DNA 的定性检测,扩增后需电泳验证结果,缺点是容易发生污染,导致检测结果假阳。实时荧光定量PCR技术,用于目的DNA 的定量检测,优点是检测过程自动化程度高,无需电泳验证就可得到理想的试验结果,使用探针提高了扩增特异性及灵敏性。
5 乳酸菌发酵乳制品致敏性的研究
乳酸菌不仅是发酵乳品中的主要微生物,且在新鲜人乳、牛乳、羊乳中天然存在,被报道具有多种功能。目前,已有大量报道乳酸菌发酵乳制品具有预防和缓解过敏症状的作用,乳酸菌发酵过程中微生物产生蛋白酶,水解牛乳蛋白,破坏抗原表位而降低食品致敏性[36]。乳品经发酵后,乳蛋白的消化率提高而进一步降敏[37-38],是同热加工等常见加工等效甚至更有效的降敏手段。
表2列出不同乳杆菌发酵对乳制品过敏原影响的研究。Kalliomäki 等[47]、Nakae 等[48]和Strachan等[49]对新生婴儿乳蛋白过敏现象的研究发现,证实特应性皮炎AD 呈现双歧杆菌SDSL 杆菌菌数的变化,结果显示,肠道菌群的变化随着宿主变应性疾病和疾病的活动性变化而变化,呈现正相关趋势,并且受疾病程度和过程的影响。Wroblewska等[50]研究发现干酪乳杆菌发酵乳蛋白可显著降低乳清蛋白的免疫反应性和致敏性。模拟发酵乳在消化过程的第3 阶段进一步降低了过敏原的免疫反应性,证实了环丙烷-脂肪-酰基磷脂合成酶和羧化胺连接酶与人 IgE 抗体发生反应。Jedrychowski[51]用复合菌株(噬温乳酸菌、嗜热乳酸菌)发酵牛乳,测定乳清蛋白抗原性,其中β-LG和α-LA 的抗原降低率在90%以上。Wroblewska等[50]研究中用乳酸菌发酵的乳制品,乳清蛋白中β-LG 和α-LA 致敏性均降低,这一结果与Jedrychowski[51]的研究成果保持一致。Kleber 等[52]分别用乳酸菌发酵脱脂乳和甜乳清24 h 左右,发现发酵对降低β-乳球蛋白的抗原性有协同效果。Ehn 等[53]采用瑞士乳杆菌发酵脱脂乳,发现β-LG含量降低。
Wroblewska 等[50]研究表明乳酸菌发酵后的乳清蛋白、酪蛋白的免疫反应能力明显下降,而模拟消化后的乳清蛋白、酪蛋白的免疫反应性甚至更高。虽然α-酪蛋白免疫反应性降低了21%,但这种蛋白仍然是最具反应性的,这是由于抗酶特异性血清IgE 的浓度高于抗α-LA 和抗β-LG,由于患者对酪蛋白和乳清蛋白敏感。
乳酸菌的种类、发酵和贮藏条件也可以解释过敏原性的变化。陈帅等[54]用干酪乳酸菌WPC09发酵乳制品,其β-LG 下降了70%左右。李艾梨等[55]采用小鼠实验说明乳酸菌能有效降低β-LG 含量,从而降低过敏症状。李海红[56]研究了5 种乳杆菌(植物乳杆菌LpYZU09、干酪乳杆菌LcYZU02、鼠李糖乳杆菌LrGG、发酵乳杆菌LfYZUl5 及戊糖片球菌PpYZU32),采用5 种乳杆菌表面蛋白的提取物对小鼠鼠肠上皮细胞、巨噬细胞和脾细胞的粘附抑制作用进行实验研究。结果表明,菌株LrGG 表面蛋白对巨噬细胞粘附5 种菌体普遍显示了较强的抑制作用,抑制率为38.7%~76.0%,证明乳酸菌表面蛋白对粘附肠上皮细胞、巨噬细胞、脾细胞有重要作用。同菌株表面蛋白对肠上皮细胞的诱导增殖指数为0.05~0.35,巨噬细胞诱导增殖指数为0.05~0.42,对脾细胞诱导增殖指数为0.02~0.40。结果显示诱导效应具有菌株和剂量依赖性,表明乳酸菌表面蛋白在激活肠上皮细胞、巨噬细胞、脾细胞中发挥了重要作用。Chatchatee 等[13]研究了24 名对乳制品过敏的儿童血清,对血清及重叠的肽链明确了酪蛋白的6 个主要的IgE 表位和5 个主要IgG 表位,在酪蛋白发生变性或者分解的情况下,过敏表位才能与抗体接触,可能会导致过敏反应。吴爱娟等[57]用高产蛋白乳杆菌RA3,酶活达38.87 U/mL 的菌株发酵酸奶后β-LG 抗原性降低了75.2%。
6 发酵乳品的降敏机理
6.1 益生菌降敏
益生菌有助于平衡肠道微生物菌群,是活的非致病性微生物,在适量范围内有助于人类健康。益生菌的功效是通过表面分子蛋白用于特异性表达,形成各种组分并相互作用。不同菌种的益生菌作用不同,利用不同的作用机制,不同菌株使用剂量不同,从而产生免疫应答反应不同。益生菌发挥最佳效果是肠道微生物存在于肠表面粘液层的时候,影响肠道免疫系统,对肠道病原体具有清除作用,细胞信号传导提供抗氧化剂、抗诱变剂。益生菌的优势在于其表面含有多种微生物相关分子模式,可优先与巨噬细胞的表面识别受体结合,通过接头分子调节下游的信号转导通路,从而改善胃肠道生理机能,来预防或缓解过敏。
6.2 蛋白酶降敏
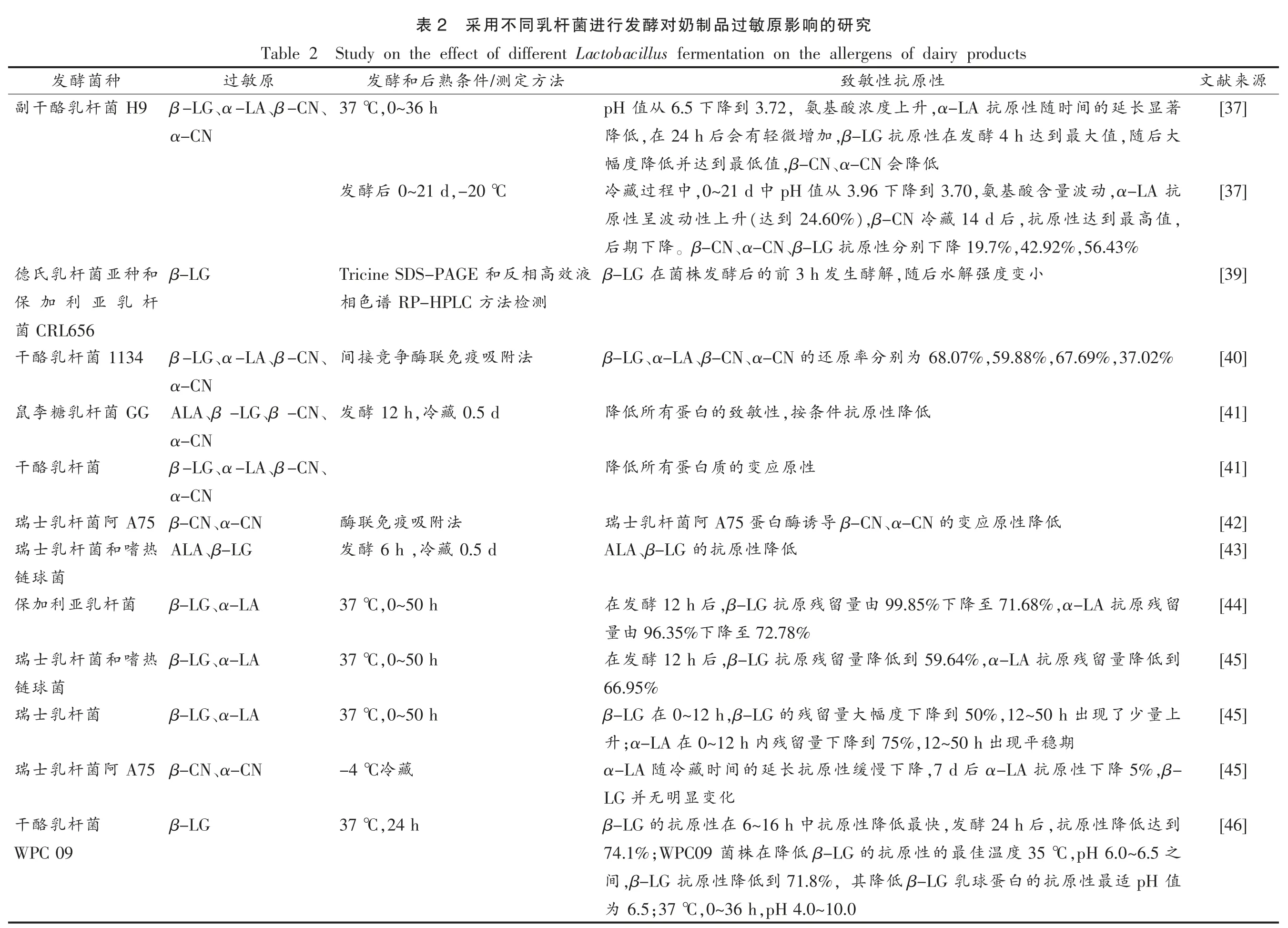
源来献[37][37][39][40][41][41][42][43][44][45][45][45][46]文究研的响影原敏过品制奶对酵发行进菌杆乳同不用采2表Study on the effect of different Lactobacillus fermentation on the allergens of dairy products Table 2 性原抗性敏致法方定测/件条熟后和酵发原敏过种菌酵发著显长延的间时随性原抗,α-LA升上度浓酸基,氨3.72到降下6.5从值pH,0~36 h 37 ℃、、β-CN、α-LA β-LG H9菌杆乳酪干副大后,随值大最到达4 h酵发在性原抗,β-LG加增微轻有会后24 h,在低降α-CN低降会、α-CN,β-CN值低最到达并低降度幅抗,α-LA动波量含酸基,氨3.70到降下3.96从值pH中,0~21 d中程过藏冷,-20 ℃0~21 d后酵发,值高最到达性原,抗后14 d藏冷),β-CN 24.60%到(达升上性动波呈性原,56.43%,42.92%19.7%降下别分性原抗、β-LG、α-CN。β-CN降下期后小变度强解水后,随解酵生发3 h前的后酵发株菌在β-LG液效高相反和Tricine SDS-PAGE β-LG和种亚菌杆乳氏德测检法方RP-HPLC谱色相杆乳亚利加保CRL656菌,37.02%,67.69%,59.88%68.07%为别分率原还的、α-CN、β-CN、α-LA β-LG法附吸疫免联酶争竞接间、、β-CN、α-LA β-LG 1134菌杆乳酪干α-CN低降性原抗件条,按性敏致的白蛋有所低降0.5 d藏,冷12 h酵发、、β-CN、β-LG ALA GG菌杆乳糖李鼠α-CN性原应变的质白蛋有所低降、、β-CN、α-LA β-LG菌杆乳酪干α-CN低降性原应变β-CN、α-CN 的导诱酶白A75 蛋阿菌杆乳士瑞法附吸疫免联酶A75 β-CN、α-CN阿菌杆乳士瑞低降性原抗的、β-LG ALA 0.5 d藏,冷6 h酵发、β-LG ALA热嗜和菌杆乳士瑞菌球链留残原71.68%,α-LA 抗至降99.85%下由量留残原,β-LG 抗12 h 后酵发在37 ℃,0~50 h β-LG、α-LA菌杆乳亚利加保72.78%至降96.35%下由量到低降量留残原抗,α-LA 59.64%到低降量留残原抗,β-LG后12 h酵发在,0~50 h 37 ℃、α-LA β-LG热嗜和菌杆乳士瑞66.95%菌球链上量少了现50%,12~50 h 出到降下度幅大量留残0~12 h,β-LG 的β-LG 在37 ℃,0~50 h β-LG、α-LA菌杆乳士瑞期稳平现75%,12~50 h 出到降下量留残0~12 h 内;α-LA 在升,β-5%降下性原抗α-LA后,7 d降下慢缓性原抗长延的间时藏冷随α-LA藏冷-4 ℃、α-CN A75 β-CN阿菌杆乳士瑞化变显明无并LG到达低降性原,抗后24 h酵,发快最低降性原抗中6~16 h在性原抗的β-LG 37 ℃,24 h β-LG菌杆乳酪干之,pH 6.0~6.5 35 ℃度温佳最的性原抗的β-LG低降在株菌;WPC09 74.1%WPC 09值pH适最性原抗的白蛋球乳β-LG低降,其71.8%到低降性原抗,β-LG间,pH 4.0~10.0,0~36 h;37 ℃6.5为
利用生物蛋白酶对蛋白质进行特异位点切割,通过断裂蛋白肽键,将过敏蛋白质水解成小分子肽段,降低分子质量,或是通过改变过敏原表位的三级结构,切除过敏原蛋白表面的一些表位作用,从而达到降低致敏性的效果。乳清蛋白包括β-乳球蛋白和α-乳白蛋白2 种主要过敏原蛋白。沈小琴等[58]研究了7 种生物酶水解乳清蛋白,结果显示由于碱性蛋白酶的酶切位点在疏水性氨基酸的羧基上,而乳清中有大量的疏水性氨基酸,从而碱性蛋白酶能够大量破坏上述结合表位,因此碱性蛋白酶对降低抗原性有最大作用。Kim 等[59]发现经100 ℃热处理后的乳清用胃蛋白酶和胰蛋白消化,可以降低乳清蛋白的抗原性,这是因为这2种酶存在乳蛋白的酶切位点。
7 低致敏性的发酵乳制品
近年来,有关低致敏发酵乳制品的相关研究表明,发酵乳制品可减轻一些遗传性过敏的症状,延缓其病症的发展。利用乳酸菌生产不同类型发酵乳制品,如利用保加利亚乳杆菌、嗜热链球菌生产酸奶,利用嗜热链球菌生产奶酪,利用副干酪乳杆菌、嗜酸乳杆菌、乳双歧杆菌、嗜热链球菌生产畅意酸乳,都可作为乳过敏患者食用的乳制品。郭鸰等[60]采用1 株瑞士乳杆菌为发酵剂,在10%的脱脂乳中添加瑞士乳杆菌发酵制备低致敏乳蛋白,结果表明发酵生产低致敏乳源蛋白可以降低乳蛋白致敏性。Majamaa 等[61]研究牛奶过敏的婴儿食用乳酸菌发酵的乳清蛋白后,婴儿的疾病肠道炎症能得到有效缓解。目前,国内企业及相关研究机构可通过菌种发酵生产高脱敏率的发酵型产品,以提高乳制品的附加值。
8 结论与展望
本文概述了生牛乳过敏蛋白 (αs1-酪蛋白、αs2-酪蛋白、β-乳球蛋白[β-LG]、α-乳清蛋白[α-LA])的蛋白结构以及过敏机理,并指出引起人过敏的主要蛋白为α-乳清蛋白、β-乳球蛋白,过敏是由于机体免疫系统产生过敏原特异性IgE 抗体,IgE 抗体与肥大细胞膜、嗜碱性粒细胞膜表面的特定受体结合,使机体处于致敏状态。随后再次摄入同一过敏原后,过敏原与IgE 发生桥联,诱导细胞脱颗粒,释放组胺、白三烯、激肽和嗜酸性粒细胞趋化因子等一系列炎症介质而触发食物过敏症。由于牛乳蛋白过敏受影响最大的人群是婴幼儿,消除和缓解婴幼儿的牛乳过敏问题对其生长发育具有重要意义。通过适当的食品加工技术降低牛奶蛋白的致敏性成为研究热点。发酵生牛乳是有效降低婴幼儿乳制品过敏问题的常用手段,一方面乳酸菌本身就具有预防和降低致敏的作用,日常膳食中使用发酵食品可有效预防过敏,减轻过敏症状;另一方面在微生物发酵过程中,乳酸菌会产生导致乳蛋白降解的蛋白酶水解乳蛋白过敏原表位而降低致敏性。
研究发现降低致敏性的菌种包括副干酪乳杆菌H9、德氏乳杆菌亚种、保加利亚乳杆菌CRL656、干酪乳杆菌1134、鼠李糖乳杆菌GG、瑞士乳杆菌阿A75、干酪乳杆菌WPC 09 等,在37℃,24 h 条件下发酵和4 ℃,24 h 的后熟条件下,产生蛋白酶对牛奶蛋白适当酶解,显著降低不同类型乳蛋白的致敏性。乳杆菌发酵结合其它加工手段可以降低致敏性,发酵前热处理样品或酶水解样品可以使发酵效果更好,得到的产品致敏性更低,并且可以通过发酵解决热处理产生蒸煮味等问题。
