改良隔日禁食干预对大鼠减脂效果的影响及Irisin调控作用
2021-05-15付悦于亮高扬
付悦 于亮 高扬
1 北京体育大学运动人体科学学院(北京100084)
2 苏州市体育科学研究所(江苏苏州215131)
间歇性禁食(intermittent fasting,IF)是指机体周期性的保持禁食与摄食交替进行的一种方法[1],其中,隔日禁食(alternate-day fasting,ADF)是IF 的主要形式,由24 h 禁食与24 h 自由摄食交替进行组成。前期对ADF 的研究发现,4 周ADF 具有控制体重、降低体脂的作用[2],但长期ADF不仅会由于能量尤其是蛋白质摄入不足造成骨骼肌质量下降[3],还可因为禁食时间过长造成人体实验中受试者消化系统问题及心理压力过大无法坚持实验等情况[4]。因此有学者提出更容易被接受的改良隔日禁食(alternate-day modified fasting,ADMF)方法,即指在ADF 基础上,于禁食日给予25%的基础能量食物,期间饮水自由,这种方法不良反应少[5],且与中等强度有氧运动的效果近似,都可以引起机体能量代谢状态发生变化。已经证明IF可以通过改变肠道菌群促进白色脂肪棕色化,同时上调解偶联蛋白1(uncoupling protein-1,UCP1)促进脂肪产热[6],而鸢尾素(Irisin)这一肌肉因子可与脂肪组织交互作用(crosstalk),增加机体能量消耗[7],引发白色脂肪棕色化[8],受能量代谢状态变化调控。ADMF 可否达到与运动近似的减脂效果,其减脂的主要机制是否通过改变能量代谢状态,调控Irisin促使白色脂肪棕色化尚需证实。Irisin 的前体蛋白为含Ⅲ型纤连蛋白域蛋白5(fibronectin type Ⅲdomain containing,FNDC5),也是研究Irisin 的重要蛋白。本研究通过建立4 周ADMF 模型,与ADF模型、中等强度运动模型相比较,观察4 周ADMF 干预对大鼠减脂效果的影响,探讨白色脂肪棕色化FNDC5-Irisin-UCP1 信号通路在ADMF 干预过程中的表达情况,为“禁食减脂”方法的不断优化提供理论依据。
1 材料与方法
1.1 实验动物与分组
40 只8 周龄SPF 级雄性SD 大鼠,体重300 ± 20 g,由北京维通利华实验动物技术有限公司提供,在北京体育大学SPF 级动物实验室饲养、训练,温度20℃~24℃,昼夜明暗交替各12 小时,大鼠3 天预适应后随机分为4组,分别为对照组(C组)、运动组(E组)、隔日禁食组(ADF组)、改良隔日禁食组(ADMF组),每组10只。
1.2 方法
1.2.1 干预方法
(1)禁食方法:ADF 组和ADMF 组单笼饲养,预适应期间每天称量大鼠的饲料量,计算得出大鼠平均每日进食量无统计学差异,为26.28 ± 1.95 g/天,正式实验期间,ADF 组大鼠24 h 禁食和24 h 摄食循环进行,ADMF 组在Krista 等[9]制定的ADMF 方案基础上,根据Parvaresh 等[10]提出的建议修改Krista 等制定的ADMF方案,即大鼠24 h 部分禁食和24 h 自由摄食循环进行,禁食日给予25%基础能量饲料。6.6 g/只/天,在1 h内吃完,两组饮水自由。以上禁食和称量均在每天同一时间点进行。见图1。
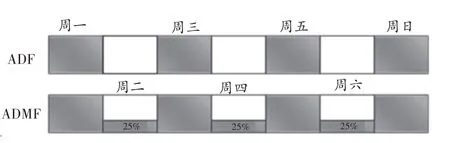
图1 ADF与ADMF模型(1周)示意图
(2)运动模型:运动组进行65% VO2max强度的跑台运动,预适应期间前两天进行5 min,10 m/min 的训练,后两天进行15 min,15 m/min 的训练。正式实验时60 min/天,5天/周,第1周坡度为0°,15 m/min,从第2周开始坡度5°,18 m/min。
1.2.2 双能X线吸收测量法(DEXA)
在实验干预前后对大鼠进行DEXA 扫描,校准仪器,将麻醉的大鼠放于扫描床上的指定位置,录入身长、体重后开始扫描,扫描结束后保存、分析数据,记录大鼠体脂率。
1.2.3 取材
4 周干预结束后禁食12 h,采用戊巴比妥钠麻醉大鼠,50 mg/kg 体重进行腹腔注射,对大鼠进行心尖取血,保留血液并离心,取上清保存。按次序分离双侧腓肠肌、肾周脂肪、附睾脂肪、腹股沟脂肪和肩胛处棕色脂肪,分别称量其湿重。取新鲜腓肠肌约黄豆粒大小,用冰冻切片包埋剂(optimal cutting temperature compound,OCT)进行包埋,取适量肾周脂肪、附睾脂肪投入4%多聚甲醛溶液中,以制备石蜡包埋样品,骨骼肌和脂肪剩余部分包在锡纸中投入液氮桶,以用于Western Blot实验,置于-80℃保存。
1.2.4 蛋白印迹测试(Western Blot)
取各部分样品0.1 g,剪碎后加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液(RIPA Lysis Buffer),冰上匀浆,4℃静止30 min。在4℃、12000 rpm 条件下离心8 min 取上清,加入RIPA 裂解液和5×loading buffer 将样品浓度调至统一,在100℃加热10 min,-40℃冷冻备用。
Western Blot 检测骨骼肌中AMPKα、p-AMPKα(Thr172)、PGC-1α、FNDC5 蛋白表达,脂肪组织中UCP1 蛋白表达。采用10%分离胶浓度,进行SDS-聚丙烯酰胺凝胶电泳,300 mA下转膜1.5 h,5%牛蛋白血清(bovine serum albumin,BSA)封闭3 h,使用5%BSA 配制一抗,AMPKα浓度1 ∶2000、p-AMPKα(Thr172)浓度1∶500、PGC-1α浓度1∶1000、FNDC5浓度1∶2000、GAPDH 浓度1∶2000、β-actin 浓度1∶1000、UCP1浓度附睾组织1 ∶1000、肩胛组织1 ∶5000)。4℃过夜。二抗浓度均为1∶2000,孵育1.5 h,洗膜后曝光。Image Lab软件进行灰度值分析。
1.2.5 免疫荧光检测Laminin
细胞外层粘连蛋白Laminin 位于细胞外基质,是基膜的特有成分和主要功能成分。通过检测其定位,可以反映骨骼肌横截面积[2]。对大鼠腓肠肌进行包埋,冰冻切片机预冷至-20℃,用OCT 将包埋样品粘到底座上,粗调待露出组织后再用8 μm 细调,将切下的组织固定在防脱载玻片上,-80℃保存。
样品取出后,用4%多聚甲醛4°C 固定10 min。用含有0.3%Triton 的PBS 破膜30 min,用含有0.1%Triton 的PBS 摇床洗3 次,每次5 分钟。用免疫组化笔标示样本范围,在样品上滴加5%羊血清封闭30 min。5%羊血清配置层粘连蛋白抗体(Laminin)作为一抗,浓度为1∶500,滴加后湿盒4℃过夜。次日加入荧光二抗,浓度为1∶500,DAPI 封片,利用激光共聚焦显微镜进行拍摄,每组取3 只,每只选8 张片子,Image -Pro Plus软件统计分析骨骼肌横截面积。
1.2.6 ELISA法检测血清Irisin
将各组大鼠血清样品取出,在酶标包被板上加入规定剂量的标准品和待测样品,留出空白孔,封板后37℃孵育30 min。洗涤酶标板。在各孔中加入酶标试剂,封板后37℃孵育30 min。洗涤酶标板。在各孔中加入显色剂,37℃避光显色15 min。加入终止液用酶标仪测定,记录各组数据。
1.2.7 脂肪HE染色
将存于4%多聚甲醛的附睾脂肪组织和肾周脂肪组织用流水冲洗12 h 后进行脱水,脱水完毕后使用石蜡包埋机进行包埋。
将包埋的石蜡组织进行纵行切片,厚度为7 μm,进行HE 染色。切片放入烤箱中,60℃30 min,脱蜡、水化,用苏木素染料染色12 min,流水冲洗1 min,然后浸入蒸馏水、盐酸酒精分化,氨水反蓝,流水冲洗1 min,用伊红染料复染5 min,流水冲洗1 min,酒精脱水,最后在二甲苯中浸泡,使用中性树胶封片,显微镜下采集图像信息,使用Case Viewer 软件对脂肪组织切片进行观察并保存400 倍镜下的图像,利用Image -Pro Plus 对脂肪细胞面积进行统计,每张图片测量3 次取平均值。
1.2.8 数据统计与分析
所有实验数据采用平均数±标准差(±s)表示,使用Image J、SPSS 22.0、GraphPad Prism、Image pro plus 等软件进行分析处理,组间分析采用单因素方差分析,方差齐时使用LSD法,方差不齐时使用Tamhane’s T2法,具有统计学意义的标准为P<0.05。
1.3 主要仪器及试剂
AMPKα抗体,ab80039,Abcam 公司;p-AMPK 抗体,ab133448,Abcam 公司;PGC-1α,ab54481,Abcam 公司,FNDC5 抗体,ab174833,Abcam 公司;UCP1 抗体,ab10983,Abcam 公司;Irisin ELISA 试剂盒,AD0002RA,Andy gene; Laminin 抗体,ab11575,Abcam 公司;磷酸酶抑制剂,Roche 公司;蛋白酶抑制剂,Roche公司;BCA 蛋白测定试剂盒,Thermo公司。Western Blotting 电泳仪、电转仪,Bio-Rad公司;xMark 酶标仪,Bio-Rad公司;防脱载玻片,北京中杉金桥生物技术有限公司。
2 结果
2.1 运动与禁食后体重、体脂的变化
如表1 所示,4 周实验干预后,运动组、隔日禁食组和改良隔日禁食组的体重相比于对照组均显著降低(P<0.01)。从4 周干预期间大鼠体重增长趋势来看,对照组、运动组和改良隔日禁食组大鼠体重从第2周开始相比于初始值即明显增加(P<0.01),而隔日禁食组体重增幅最小,直至第4周才与初始值有显著差异(P<0.05)。
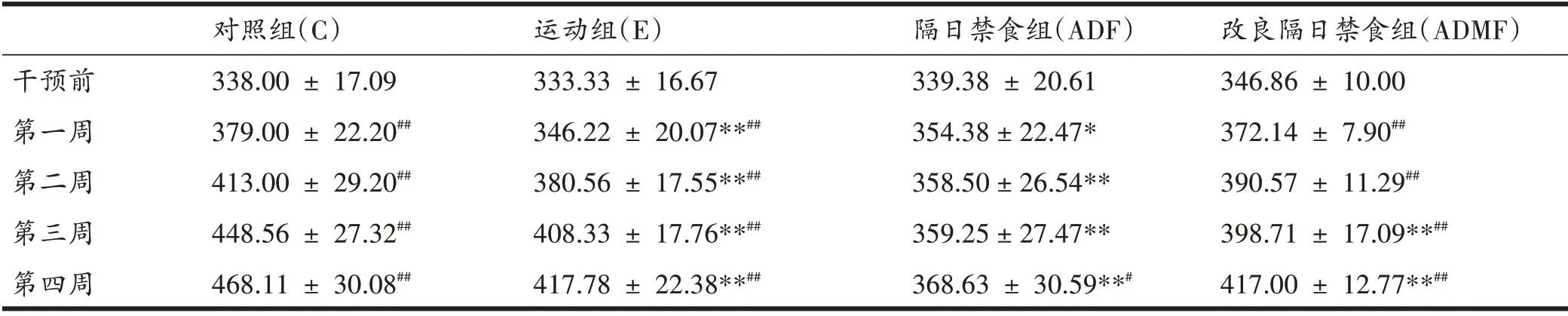
表1 大鼠体重增长趋势(g,每组n=10)
如表2 所示,运动组、隔日禁食组和改良隔日禁食 组的体脂率相比于对照组和初始值均减少(P<0.05)。

表2 大鼠体脂含量(%,每组n=10)
2.2 运动与禁食后腓肠肌湿重/体重和横截面积的变化
4 周干预后,运动组腓肠肌湿重/体重(9.71×10-3± 0.68×10-3)与对照组(9.44×10-3± 0.30×10-3)相比无显著差异,隔日禁食组(8.59×10-3± 0.59×10-3)和改良隔日禁食组(8.84×10-3± 0.48×10-3)与对照组相比显著减小(P<0.05),且隔日禁食组减小更明显(P<0.01)。
如图2 所示,4 周干预后,运动组和改良隔日禁食组的肌肉横截面积相比于对照组无明显变化,但隔日禁食组肌肉横截面积显著减少(P<0.01)。
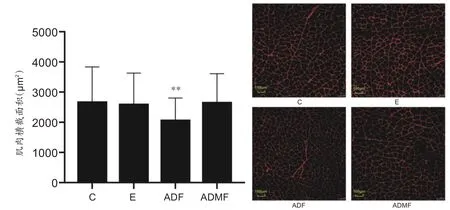
图2 各组大鼠腓肠肌横截面积与免疫荧光图
2.3 运动与禁食后脂肪湿重/体重和脂肪面积的变化
由表3 可知,4 周干预后,运动组、隔日禁食组和改良隔日禁食组的附睾脂肪、肾周脂肪和腹股沟脂肪湿重/体重相比于对照组均显著减少(P<0.01),三个干预组的肩胛脂肪(以棕色脂肪为主)湿重/体重相比于对照组有增高的趋势但无显著性差异。

表3 大鼠不同部位的脂肪湿重/体重(10-3,每组n=10)
对附睾、肾周脂肪细胞面积进行统计,如图3、图4所示,对照组(2176.24 ± 905.92 μm2)、运动组(2013.56 ± 1045.41 μm2)、隔日禁食组(2268.15 ±1189.48 μm2)和改良隔日禁食组(2263.25 ± 1056.38 μm2)四组大鼠附睾脂肪细胞面积无统计学差异,而运动组(2660.65 ± 1324.41 μm2)、隔日禁食组(1910.46± 923.58 μm2)和改良隔日禁食组(2114.14 ±1297.93 μm2)大鼠肾周脂肪细胞面积显著小于对照组(4065.88 ± 2227.94 μm2)面积(P<0.01)。
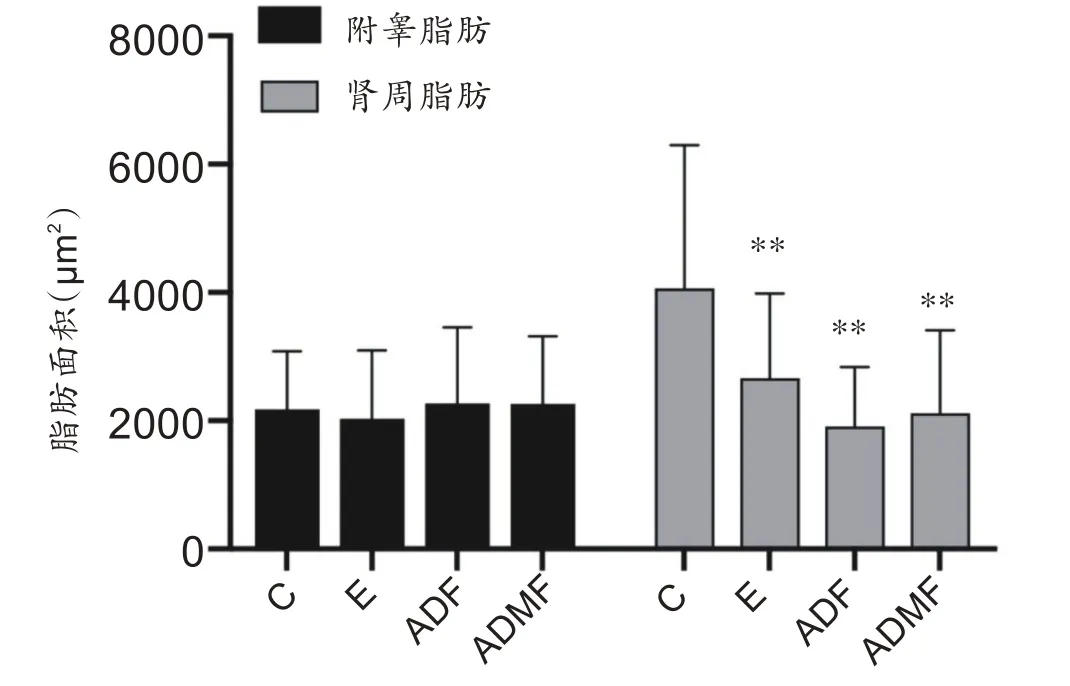
图3 附睾脂肪、肾周脂肪细胞面积

图4 附睾脂肪和肾周脂肪HE染色(×400,标尺=50 μm)
2.4 运动与禁食后大鼠骨骼肌中蛋白表达
如图5 所示,4 周干预后,四组AMPKα蛋白表达无显著差异,运动组、隔日禁食组和改良隔日禁食组p-AMPKα(Thr172)蛋白表达和p-AMPKα(Thr172)/AMPKα与对照组相比显著升高(P<0.05)。

图5 腓肠肌AMPKα、p-AMPKα(Thr172)、PGC-1α、FNDC5蛋白表达变化
4周干预后,相比于对照组,运动组、隔日禁食组和改良隔日禁食组腓肠肌中的PGC-1α蛋白表达显著升高(P<0.01),说明运动和禁食都可以诱导腓肠肌内PGC-1α蛋白表达的升高。
4 周干预后,运动组、隔日禁食组和改良隔日禁食组的FNDC5蛋白表达显著高于对照组(P<0.05)。
2.5 运动与禁食后大鼠血清Irisin水平
如图6 所示,4 周干预后,与对照组相比,运动组、隔日禁食组和改良隔日禁食组Irisin 浓度显著提高(P<0.05)。

图6 大鼠血清Irisin水平
2.6 运动与禁食后大鼠脂肪中蛋白表达
如图7 所示,4 周干预后,运动组、隔日禁食组和改良隔日禁食组的附睾脂肪和肾周脂肪中UCP1 蛋白表达相比于对照组显著增加(P<0.01)。
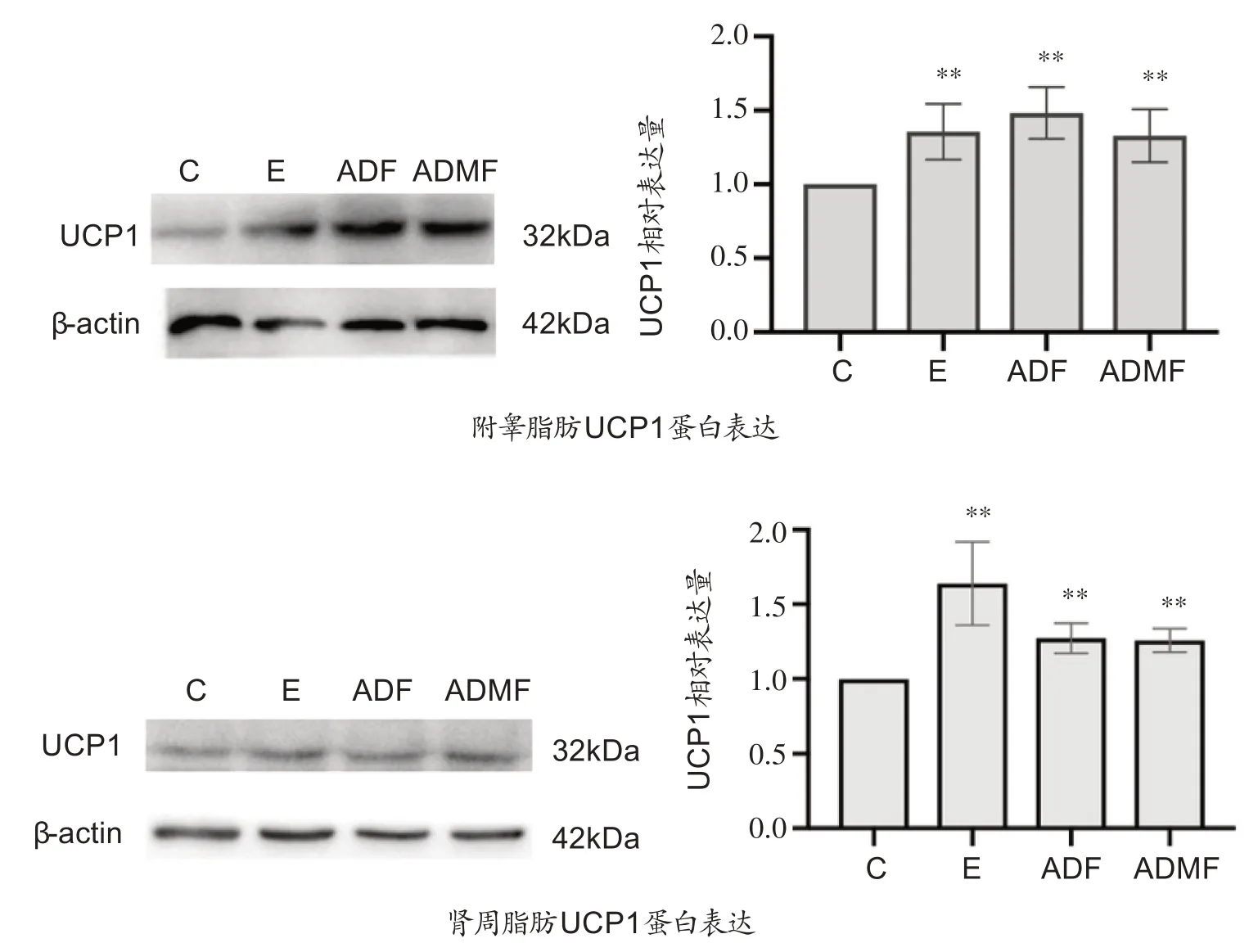
图7 附睾脂肪和肾周脂肪UCP1蛋白表达
3 讨论
3.1 改良隔日禁食可以有效控制体重、降低减脂
禁食是一种有效减少能量摄入的手段,此外还有延长寿命、增强免疫、改善心脑血管疾病、促进大脑的神经可塑性等益处[11-14],它是通过耗尽肝细胞中的糖原,引起机体从糖类供能向脂肪供能的转变,促进脂肪“燃烧”,减少体脂,从而达到有效控制体重及体脂含量的目的[15]。本课题组前期研究发现,4 周间歇性禁食可以控制大鼠体重、体脂增长,且效果优于中等强度运动[3]。对肥胖者进行改良隔日禁食,发现体重、腰围和脂肪量显著减少,如果食物中增加少量蛋白质,还可以提高饱腹感,有利于受试者长期配合[16]。即使对于正常受试者来说,改良隔日禁食对降低体脂也有显著效果[17,18]。本实验4 周干预后,改良隔日禁食组的体重、体脂与运动组和隔日禁食组变化趋势相近,说明改良隔日禁食同样可以有效控制体重、降低体脂含量。运动可以保持或增加肌肉质量[19],4 周干预后改良隔日禁食组和运动组腓肠肌横截面积相似,说明改良隔日禁食不会影响腓肠肌肌肉质量,而隔日禁食组可能由于强度过大,腓肠肌质量下降严重。对大鼠附睾、肾周脂肪细胞面积进行统计后,发现各组附睾脂肪细胞面积无显著差别,也许是因为中等强度运动和本实验的禁食刺激并未达到可以引起附睾脂肪细胞面积减小的有效强度,但是三个干预组的肾周脂肪面积相比于对照组显著减小,内脏脂肪细胞面积减小更加有益于机体健康[20],推测改良隔日禁食选择性地影响了内脏脂肪细胞大小。在实验喂养期间发现,禁食组的大鼠并未在摄食日暴饮暴食,反而总的能量摄入只占对照组的80%左右,推测禁食组体重小于对照组的原因可能是由于总能量摄入的减少。同时,4周禁食和运动干预后均激活“能量感受器”AMPK,说明改良隔日禁食与运动一样,可以有效刺激机体能量代谢发生改变。
3.2 隔日禁食可激活FNDC5-Irisin-UCP1 通路和白色脂肪棕色化
鸢尾素(Irisin)是过氧化物酶体增殖物激活受体γ辅激活因子(peroxisome proliferator -activated receptor gamma coactivated 1-alpha,PGC-1α)的依赖性肌肉因子,前体蛋白FNDC5 受PGC-1α的调控,随循环系统进入血液后刺激白色脂肪棕色化和产热作用,是运动减肥及防治代谢性疾病的新靶点[21]。在人体中,白色脂肪组织(white adipose tissue,WAT)作用是保温和储存化学能[20];棕色脂肪组织(brown adipose tissue,BAT)通过线粒体解偶联蛋白1(uncoupling protein-1,UCP1)介导的生热作用来维持体温,但成年人没有活性的BAT[21];而米色脂肪组织(beige adipose tissue)在成年人中仍然存在,它在基础状态下类似于白色脂肪组织,UCP1 表达极低,当受到特定刺激后表型会“转分化”,出现类似于棕色脂肪组织的多腔状改变[22],即所谓的白色脂肪棕色化,同时表现为UCP1 蛋白表达升高[24],脂肪产热增加,且米色脂肪组织优先对Irisin敏感,即Irisin会通过对米色脂肪组织的特定作用刺激白色脂肪棕色化[25],所以充分利用白色脂肪棕色化来减脂比试图激活BAT有更大的可行性。
运动引起机体能量代谢改变,激活AMPK 及下游PGC-1α[26],引起FNDC5/Irisin 高表达[21,27,28],血清中的Irisin 与脂肪组织交互作用(cross-talk)促进UCP1 的表达,增加脂肪产热[7]。理论上,禁食与运动对于机体来说都是一种巨大的刺激,哺乳动物禁食12~24 h 会使血糖降低和肝糖原耗尽,细胞中AMP/ATP 比率增加,AMPK 被激活[1],脂肪组织中UCP1 蛋白表达上调[29],但其间促进脂肪产热、降低体脂的机制尚不明确。本研究4 周干预后发现,三个干预组腓肠肌的p-AMPKα(Thr172)/AMPKα 表达显著升高,通过AMPK 磷酸化刺激了下游的PGC-1α和FNDC5/Irisin 表达升高,同时附睾脂肪和肾周脂肪中UCP1蛋白高表达,产生白色脂肪棕色化的反应,说明改良隔日禁食方法与运动一样,均可通过改变能量代谢状态调控刺激FNDC5-Irisin-UCP1信号通路及白色脂肪棕色化。
3.3 改良隔日禁食是一种更科学合理的减脂方法
为了保证禁食实验的科学有效,人体实验中对受试者饥饿、饱腹感和饮食满意度都通过视觉模拟量表(visual analogue scales,VAS)来衡量[30]。Heilbronn的隔日禁食实验中,通过VAS量表衡量受试者感受,发现受试者在禁食日的饥饿感并没有减少[31],而改良隔日禁食实验中,受试者饥饿感降低,实验满意度和饱腹感增加,甚至与能量摄入限制方法相比,改良隔日禁食是一种更好的非药物减脂方案,且受试者并不会在摄食日暴饮暴食,这是一种饮食行为良好的表现[15,32],更重要的是,通过对受试者的饮食失调症状进行多维评估发现,改良隔日禁食是一种安全有效的减脂方法,并不会引起胃肠道紊乱和睡眠障碍[33]。本研究中,虽然隔日禁食组的体重下降值更大,但体重的剧烈变化伴随能量摄入的缺失会明显影响到骨骼肌质量;在降低体脂和保持肌肉质量方面,改良隔日禁食同样效果显著,且减脂机制与运动相似,都是通过调节能量代谢状态和影响Irisin相关机制来促进脂肪产热。
4 小结
4周改良隔日禁食不仅能够有效控制大鼠体重、降低体脂含量,还可以平衡基础能量摄入,保证骨骼肌质量,整体效果优于隔日禁食。此方法可通过改变能量状态调控FNDC5-Irisin-UCP1 信号通路促使白色脂肪棕色化,达到减脂效果。
