纳米二氧化硅暴露对金属硫蛋白和人血清白蛋白二级结构的影响
2021-05-15李可欣罗幸玲张凌燕黄沛力
李可欣,罗幸玲,张凌燕,黄沛力
(1.首都医科大学公共卫生学院,北京100069;2.环境毒理学北京市重点实验室,北京100069)
纳米二氧化硅(silica nanoparticles,NPSiO2)是由二氧化硅颗粒组成的团聚体[1],由于生物相容性好,性质稳定,已被广泛应用于食品、药品和化妆品的研发与生产[2]。调查显示,人们每天可从食品添加剂中摄取1.8 mg的NPSiO2,并且美国食品药品监督管理局开始使用NPSiO2作为癌症的靶向探针进行Ⅰ期临床试验[3]。由此可见,环境暴露、职业暴露和医源性暴露等多种途径可使人们接触到NPSiO2。因此,深入研究NPSiO2对人类健康的影响具有重要的现实意义。已有研究表明,尽管NPSiO2在生物体的代谢速度较快,但长期暴露仍可引起实验动物的病理和生理变化,甚至具有全身毒性[4-6]。NPSiO2可以诱导细胞内活性氧(reactive oxygen species,ROS)的产生导致细胞凋亡[7-9],且其对细胞损伤作用存在尺度效应,即粒径越小,损伤越明显[10-11]。金属硫蛋白(metallothionein,MT)是一类广泛存在于生物体中的抗氧化蛋白,由于含有大量巯基,清除ROS的能力明显强于超氧化物歧化酶和谷胱甘肽[12]。但当MT结构遭到破坏时,其清除ROS的能力减弱,易造成ROS在体内的蓄积,导致机体氧化损伤。NPSiO2所引起机体的氧化损伤是否与其对MT结构的影响有关,迄今仍鲜有报道。本研究以20,60和100 nm的NPSiO2(NPSiO2-20 nm,NPSiO2-60 nm和NPSiO2-100 nm)作为研究对象,应用圆二色谱法研究NPSiO2对MT结构的影响,同时与人类血液中含量最多的人血清白蛋白(human serum albumin,HSA)进行对比研究,探讨NPSiO2致生物体氧化损伤的毒作用机制,为NPSiO2的生物安全性评价提供参考。
1 材料与方法
1.1 试剂和仪器
NPSiO2-20 nm,NPSiO2-60 nm 和 NPSiO2-100 nm,美国Nano Composix公司。MT和HSA,美国Sigma-Aldrich公司。透射电子显微镜(JEM-1400 plus),日本电子公司;动态光散射仪(NanoZS90),英国Malvern公司;圆二色光谱仪(J-810),日本JASCO 公司;超纯水机(Mili-Q),法国Milipore公司;超声波清洗器(KQ3200E型),江苏昆山市淀山仪器;漩涡振荡器(MVS-1),北京金紫光科技;超低温冰箱(MDF-U3386S),日本SANYO公司。
1.2 NPSiO2的表征
使用超纯水配制NPSiO2-20 nm 5 g·L-1,NPSiO2-60 nm 10 g·L-1和NPSiO2-100 nm 10 g·L-1溶液,超声振荡30 min后滴于支持膜上,使NPSiO2在支持膜上均匀分散,置干燥器中干燥,待其完全干燥后,使用透射电子显微镜观察不同粒径NPSiO2的形态;分别移取1.0 mL至1 cm比色杯中,用动态光散射仪测量NPSiO2的粒径分布。
使用PBS(0.01 mol·L-1,pH 7.4)精确配制MT 0.2 g·L-1和HSA 0.25 g·L-1溶液,分别与3个浓度(0.05,0.5和5 g·L-1)的NPSiO2-20 nm,NPSiO2-60 nm和NPSiO2-100 nm按体积比1:1混合后,于25℃反应30 min,使用圆二色光谱仪检测MT和HSA圆二色谱的变化,使用PBS缓冲液作为空白进行校正。扫描波长为 190~300 nm,扫描速度为50 nm·min-1,响应时间为1 s。取3次扫描的结果以x±s表示,使用 Spectra Manager Version2软件分析蛋白质4种二级结构(α-螺旋、β-折叠、β-转角和无规卷曲)含量的变化。
2 结果
2.1 NPSiO2的表征
NPSiO2-20 nm,NPSiO2-60 nm和NPSiO2-100 nm的形态如图1所示。3种粒径的NPSiO2均呈圆形,粒径分布均匀且分散好,其粒径大小与标注的尺寸大小基本一致。NPSiO2-20 nm,NPSiO2-60 nm和NPSiO2-100 nm的水合粒径如图2和表1所示,由于范德华力的作用,3种粒径的NPSiO2水合粒径均略有增加。

Fig.1 Morphology of silica nanoparticles(NPSiO2) by transmission electron microscope.NPSiO2was diluted with ultrapure water respectively,and dropped on the support film after 30 min of ultrasonic vibration,then dispersed evenly on the support film and placed in a desiccator to dry.After NPSiO2 was completely dried,the transmission electron microscope was used to observe the size and shape of NPSiO2of different particle sizes.
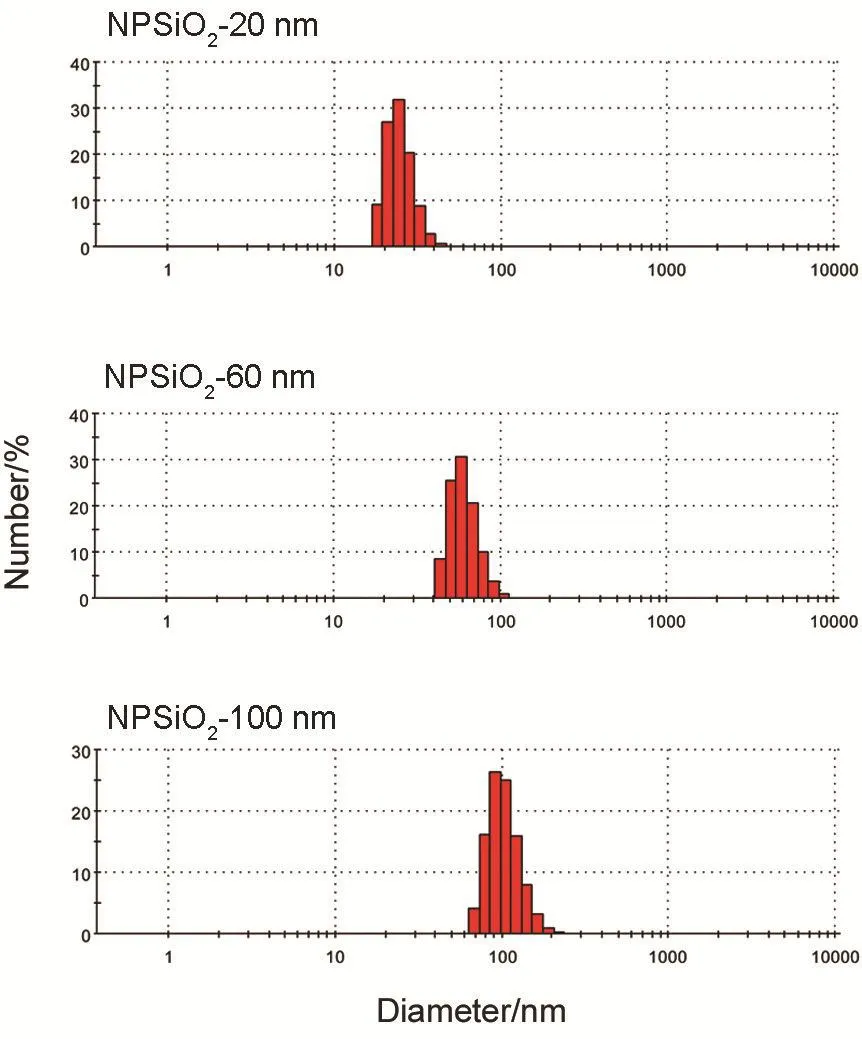
Fig.2 Hydrated particle size distribution charts of NPSiO2.NPSiO21.0 mL was pipetted into a 1 cm cuvette respec⁃tively,then dynamic light scattering instrument was used to mea⁃sure the hydrated particle size of NPSiO2.
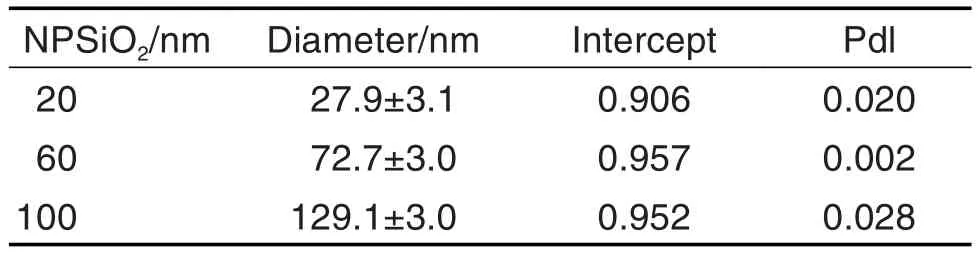
Tab.1 Hydrated particle size of NPSiO2
2.2 NPSiO2对MT和HSA二级结构的影响
不同粒径、不同浓度NPSiO2对MT和HSA二级结构的影响如图3、图4和表2所示。
由于MT中缺乏芳香族氨基酸,所以其蛋白质结构中不存在α-螺旋[13]。3种粒径的NPSiO20.05 g·L-1使MT的β-折叠在4种二级结构中所占比例减少、β-转角和无规卷曲所占比例增加,其中NPSiO2-60 nm 0.05 g·L-1对MT的β-折叠结构影响较为明显。3种粒径的NPSiO20.5和5 g·L-1可使MT的β-折叠在4种二级结构中所占比例减少、β-转角结构所占比例增加,但无明显的粒径-浓度关系。
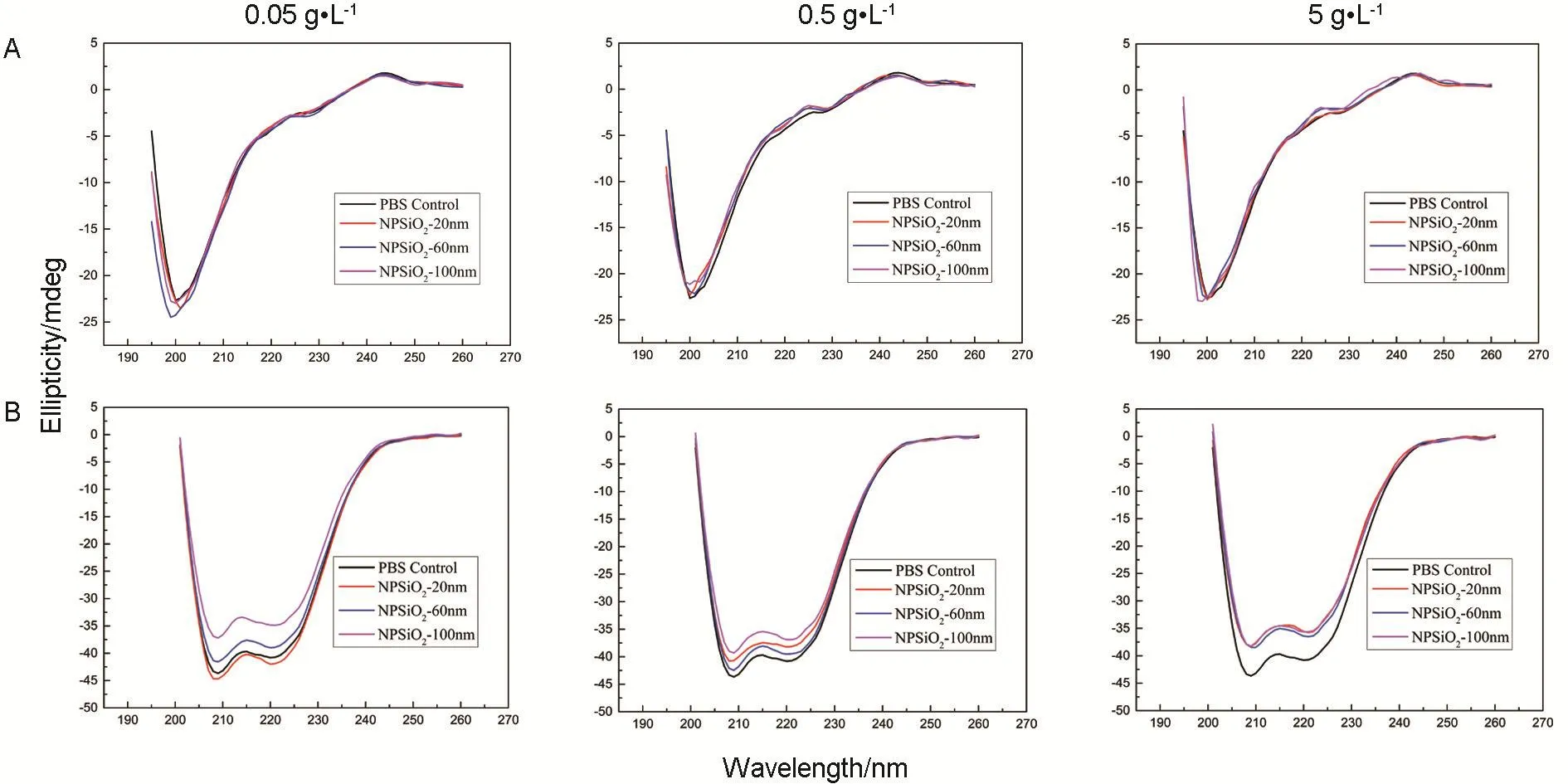
Fig.3 Circular dichroism chromatograms of metallothionein(MT,A)and human serum albumin(HSA,B)after interaction with NPSiO2.MT 0.2 g·L-1and HSA 0.25 g·L-1were mixed with NPSiO2at a volume ratio of 1∶1,at 25℃ for 30 min,the circular dichrograph was used to measure the secondary structure of the protein in the mixed solution.PBS buffer was used as a blank for calibration.
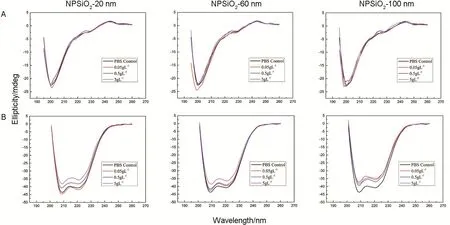
Fig.4 Circular dichroism chromatograms of MT(A)and HSA(B)after interaction with NPSiO2.See Fig.3 for MT and HSA treatment.

Tab.2 Secondary structure of MT and HSA after interaction with NPSiO2
不同粒径的NPSiO2均可使HSA的二级结构发生改变。NPSiO2-20 nm 0.05g·L-1可使HSA的α-螺旋在4种二级结构中所占比例增加、β-折叠所占比例减少;NPSiO20.5和5 g·L-1使HSA的α-螺旋和无规卷曲在4种二级结构中所占比例减少、β-折叠所占比例增加。NPSiO2-60 nm和NPSiO2-100 nm均可使HSA中α-螺旋和无规卷曲在4种二级结构中所占比例减少、β-折叠所占比例增加,但无明显的粒径-浓度关系。
NPSiO25 g·L-1使HSA 中 β-转角的出现受NPSiO2粒径大小的影响,粒径越大,出现的β-转角在4种二级结构中所占比例越多。
3 讨论
近年来,由于颗粒分布均匀,装载量大,NPSiO2作为药物分子、基因和蛋白等的载体通过多种方式进入人体血液循环的机会大大增加[14]。也正因如此,美国国家环境卫生科学研究所和国际经济合作与发展组织已将NPSiO2列入了毒性评价范围。研究表明,NPSiO2可通过负调节白细胞介素6受体/信号转导及转录激活蛋白/组织因子信号通路的微RNA451a,导致血管内皮功能障碍,促进血液凝结[15]。NPSiO2在RAW264.7细胞系和小鼠中可诱发促炎反应和氧化应激[5]。人群调查结果显示,在高NPSiO2暴露场所的工人中,系统性硬化症患者血清中硅含量普遍较高。硅元素的蓄积可导致更严重的疾病,如弥漫性硬皮病伴肺纤维化[16]。不仅如此,NPSiO2与体内生物大分子相互作用的结果与其自身粒径大小也有关系。Marichal等[10]使用不同粒径(10,30和80 nm)的NPSiO2与可溶性酵母蛋白提取物相互作用,吸附等温线表明,吸附蛋白的数量随NPSiO2粒径的增大而增加,大粒径NPSiO2的每个表面单位吸附的蛋白更多。Patwardhan等[11]研究了肽链在3种粒径(15,82和450 nm)NPSiO2上的吸附,发现NPSiO2的酸度随着粒径的增大而增加,碱性越强的肽对酸性越强的纳米颗粒的吸引力越大。
MT是富含半胱氨酸、低分子质量(7 ku)、热稳定高且能与金属结合的蛋白质[17]。由于具有与重金属结合的特性,MT常用于汞和镉等重金属的排毒,维持铜和锌等必需金属的稳定状态,并在抗氧化、防DNA损伤、提高细胞存活率、减少细胞凋亡和增殖等方面发挥作用[18]。Liu等[19]研究发现,MT对纳米银(silver nanoparticles,AgNP)有很高的亲和力,可在AgNP表面附着和聚集。AgNP的粒径不同,其表面附着MT的含量和聚集后的大小也不同。Hao等[20]则发现,纳米粒子的粒径不同,其表面曲率也不同,不同的表面曲率会对蛋白质的吸附产生不同的空间位阻,导致蛋白质的吸附数量和密度聚集的几何形状不同,对蛋白质二级结构的影响不同。本研究结果表明,NPSiO2-60 nm对MT β-折叠影响较显著,可能与NPSiO2-60 nm和MT的自身结构密切相关,更深入的原因有待进一步研究。
与MT不同,HSA是一个具有585个氨基酸残基、相对分子质量为66.5 ku的生物大分子,是人血浆中含量最丰富的蛋白质[21]。高浓度的HSA对多种化学物质具有很强的亲和力[22],极易与它们结合,导致结构发生变化。HSA构象的改变会对其功能产生影响。天然HSA的α-螺旋结构的圆二色特征光谱有 2处,分别在 208 nm(π-π*)和 222 nm(n-π*)处,β-折叠的圆二色特征光谱出现在215 nm处[23],HSA二级结构的变化与吸收带强度的变化有关。Zhang等[24]研究发现,加入富勒烯后,HSA的α-螺旋显著减少,β-折叠和无规卷曲略有增加,表明与富勒烯相互作用后HSA的生物学活性降低。Maji等[25]发现,与AgNP反应后,HSA中α-螺旋减少,但β-折叠和无规卷曲增加,表明与AgNP反应后HSA二级结构略微展开。本研究结果表明,游离HSA的二级结构包含52.2%的α-螺旋、13.8%的β-折叠和33.9%的无规卷曲,与文献[26]报道相近。与NPSiO2反应后,HSA中α-螺旋减少,β-折叠增加,并出现了β-转角,无规卷曲略有减少。Simon等[27]研究发现,较低浓度的纳米金(13 nm)可使HSA的α-螺旋增加、β-折叠减少;而Maji等[28]研究发现,在AgNP(17.8 nm)与HSA反应的质量浓度比为2∶1和1∶1时,浓度较高的AgNP会使HSA的α-螺旋和无规卷曲减少、β-折叠增加。这是由于纳米粒子可与HSA中主要多肽链的氨基酸残基结合,并破坏氢键网络,使氨基酸残基暴露于疏水腔中,导致在HSA中形成更加不紧密的构象状态,从而引起HSA二级结构的变化[29]。本研究结果表明,NPSiO2-20 nm在0.05 g·L-1时(与HSA 0.25 g·L-1的质量浓度比为1∶5)使HSA的α-螺旋增加、β-折叠减少;随着浓度增加(0.5和5 g·L-1)(与HSA的质量浓度比为2∶1和20∶1)NPSiO2-20 nm使HSA的α-螺旋和无规卷曲减少、β-折叠增加。研究报道,与NPSiO2反应后,HSA蛋白结构略有展开,蛋白稳定性降低[30]。
NPSiO2对MT和HSA二级结构的影响并无明显的粒径-效应关系和剂量-效应关系,可能与纳米颗粒自身所具有的独特性质有关。即使浓度相同,不同粒径的NPSiO2溶液中NPSiO2的粒子数、总表面积也会不同,每个纳米粒子表面负载的蛋白量也可能不相同,对蛋白质结构的影响也会不同。同时,蛋白质的结构复杂,NPSiO2的表面曲率不同,对蛋白质结构产生的影响也会不同。因此,对NPSiO2对MT和HSA结构的影响进行深入研究非常必要。
综上所述,NPSiO2可使MT和HSA二级结构发生改变,且NPSiO2对HSA二级结构的影响强于对MT二级结构的影响。
