电子转移黄素蛋白A对肝癌细胞SMMC-7721恶性生长的影响
2021-05-15刘根玉张纪岩
刘根玉,赵 敏,郭 璐,张纪岩
(军事科学院军事医学研究院军事认知与脑科学研究所,北京 100850)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,且发病率每年都在增加。全球每年有>70万人死于HCC,占癌症相关死亡率的9.1%,使其成为癌症相关死亡的第三大原因[1]。早期诊治对于提高HCC患者的生存率十分关键。早期的HCC患者通过根治性肝切除、肿瘤消融或经肝动脉化疗栓塞术等治疗手段,生存期可达5年以上[2]。但早期HCC的症状往往不明显,大多数患者在被确诊时已到晚期,丧失了根治的机会,只能通过化疗来缓解病情[3]。由于化疗往往存在复杂的耐药机制,晚期HCC患者总体预后较差。近年来,分子靶向治疗成为晚期HCC治疗的研究热点,针对晚期HCC的分子靶向药物如抗血管生成药物、血管内皮生长因子受体抑制剂、程序性死亡蛋白1抗体和免疫治疗药物等已取得实质性进展[4]。但由于存在个体差异和耐药性,上述药物并未展现出预期的疗效,因此需要寻找HCC治疗的新靶点。有研究发现,线粒体中脂肪酸β氧化异常在HCC的发生发展中扮演重要角色[5]。电子转移黄素蛋白A(electron transfer flavoprotein A,ETFA)是ETF的重要组成部分,在线粒体脂肪酸β氧化过程中起电子传递的作用。ETFA的功能异常导致线粒体脂肪酸β氧化功能障碍,最终导致脂质在肝组织和肌肉中大量堆积[6]。另外,大量数据表明,ETFA基因的遗传变异与胶质瘤的易感性高度相关[7-9],但ETFA与HCC直接关系的研究尚无报道。本研究构建以pGPU6/Hygro为载体的ETFA短发夹RNA(short hairpin RNA,shRNA)敲低质粒,并获得稳定敲低ETFA的SMMC-7721细胞克隆。通过体外和体内实验,观察ETFA对稳定敲低ETFA的SMMC-7721细胞体外非锚定生长能力和体内成瘤能力的影响,并对调控机制进行初步探讨,以期为HCC治疗提供新思路。
1 材料与方法
1.1 动物、细胞、试剂和仪器
6~8周龄雄性裸小鼠,维通利华公司,动物许可证号:SCXK(京)2016-0006。人肝癌细胞SMMC-7721,中国科学院典型培养物保藏委员会细胞库。DMEM培养基干粉,美国Gibco公司;PVDF膜,美国Millipore公司;牛血清白蛋白,美国Roche公司;胎牛血清(fetal bovine serum,FBS),兰州百灵生物技术有限公司;兔抗小鼠ETFA单克隆抗体,美国GeneTex公司;兔抗小鼠β肌动蛋白单克隆抗体和辣根过氧化物酶标记的山羊抗兔或抗小鼠IgG,北京中杉金桥公司;Lipofectamine 2000和潮霉素(hygromycin),美国Invitrogen公司;pGPU6/Hygro载体,上海GenePharma公司;琼脂、MTT、尼罗红和 DAPI,美国 Sigma-Aldrich 公司;Matri⁃gel,美国BD公司。高速离心机和酶标仪,美国Thermo公司;激光共聚焦显微镜(型号RADIANCE 2100)、Western电泳仪和转印仪,美国Bio-Rad公司;CO2细胞培养箱,美国Forma公司;透射电镜(JEM-2100),日本JEOL公司。
1.2 稳定敲低ETFA的SMMC-7721细胞的构建
将SMMC-7721细胞加入DMEM培养基中(含10%FBS、100 kU·L-1青霉素和100 mg·L-1链霉素),置37℃,5%CO2培养箱培养。取对数期生长的SMMC-7721细胞接种入6孔板,使用Lipo⁃fectamine 2000分别将携带对照shRNA、人ETFA shRNA 1#(5′-GCATGCAAATGATTCCCTAGC-3′)或2#(5′-GGAAATATCAGAGTGGCTTGA-3′)的pGPU6/Hygro载体进行转染,分别为对照组、ETFA-1#组和ETFA-2#组。通过潮霉素(75 mg·L-1)进行为期2个月的筛选,得到稳定敲低ETFA的SMMC-7721细胞,并置37℃,5% CO2培养箱中传代培养,用于以下实验。
1.3 Western印迹法检测细胞ETFA表达
取对数期生长的稳定敲低ETFA的SMMC-7721细胞加入RIPA裂解液(含PNPP 10 mmol·L-1,Aprotinin 10 mg·L-1,Na3VO410 mmol·L-1和 DTT 1 mmol·L-1)提取总蛋白。通过 SDS-PAGE凝胶电泳分离,并利用湿转法将蛋白转移到PVDF膜上;使用5%脱脂牛奶(TBST稀释)封闭1 h后加入一抗(1∶1000),4℃孵育过夜;第2天使用TBST洗3次,加入二抗(1∶2500),室温孵育1 h;再次使用TBST清洗3次,并对蛋白条带进行显影,以反映ETFA表示水平。实验重复3次。
1.4 集落形成实验检测细胞体外非锚定生长能力
取对数期生长的稳定敲低ETFA的SMMC-7721细胞与0.3%琼脂混匀,均匀铺于6孔板上(每孔1×103细胞),每组设3复孔。细胞培养10 d形成肉眼可见的集落后,每孔加入200 mL含MTT 5 g·L-1的DMEM,使其覆盖整个琼脂面,然后置37℃培养箱继续培养4 h,拍照并计数。实验重复3次。
1.5 皮下成瘤模型检测细胞体内成瘤能力
将2×106个稳定敲低ETFA的SMMC-7721细胞重悬在200 μL含Matrigel的DMEM培养基中(Matrigel与DMEM体积比为1∶1),并将细胞注射到裸小鼠皮下,每天观察小鼠皮下肿瘤的生长状态。待瘤体在皮下可触及时,使用游标卡尺每2 d测量1次瘤体的长度和宽度,绘制肿瘤体积的生长曲线,肿瘤体积(mm3)=长×宽2/2。待瘤体积达到一定差异时,处死裸小鼠,取出瘤块称重并拍照。
1.6 尼罗红染色检测胞中脂质堆积
将贴壁的稳定敲低ETFA的SMMC-7721细胞用4%多聚甲醛固定30 min,用1×PBS洗3次(每次10 min),用尼罗红(1 mg·L-1)室温染色10 min,用1×PBST(含0.1%的TritonX-100)洗3次,每次5 min。用 DAPI染核,5 min后用1×PBST洗1次,使用防淬灭剂封片,最后在激光共聚焦荧光显微镜下观察脂质堆积。实验重复3次。
1.7 透射电镜观察细胞的超微结构
取对数期生长的稳定敲低ETFA的SMMC-7721细胞用2%的戊二醛,固定后送往国家生物分析中心扫描电镜室,在电镜下观察细胞的超微结构。实验重复3次。
1.8 统计学分析
2 结果
2.1 稳定敲低ETFA的SMMC-7721细胞构建及鉴定
Western印迹实验结果(图1)显示,与对照组相比,ETFA-1#和ETFA-2#组SMMC-7721细胞中ETFA蛋白表达水平明显降低,表明稳定敲低ETFA的SMMC-7721细胞构建成功。
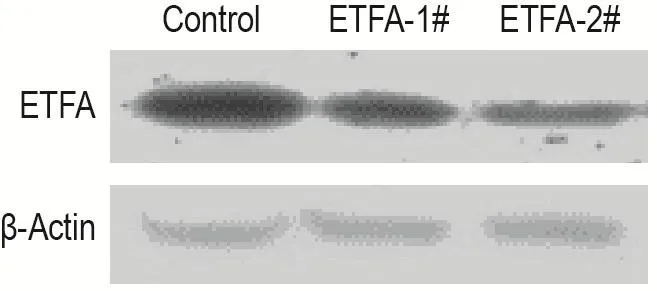
Fig.1 Efficiency of electron transfer flavoprotein A(ETFA)knockdown in SMMC-7721 cells by Western blotting.The pGPU6/Hygro vectors carrying control short hair⁃pin RNA(shRNA)or human ETFA shRNA 1#and 2#were trans⁃fected into SMMC-7721 cells.After hygromycin screening,stable clones of SMMC-7721 cells with ETFA knockdown were identi⁃fied as ETFA-1#and ETFA-2#groups,respectively.
2.2 敲低ETFA对SMMC-7721细胞体外非锚定生长的影响
集落形成实验结果(图2)显示,稳定敲低ETFA的SMMC-7721细胞接种第10天,与对照组相比,ETFA-1#和ETFA-2#组SMMC-7721细胞在软琼脂中形成的集落数目明显减少(P<0.01),表明敲低ETFA导致SMMC-7721细胞体外非锚定生长的能力明显下降。

Fig.2 Effect of ETFA knockdown on anchorage-depen⁃dent growth of SMMC-7721 cells.SMMC-7721 cells with ETFA knockdown were plated in soft agar(1×103per well)and assayed for colony numbers after 10 d.A:representative images;B:the quantitative result of A.±s,n=3,**P<0.01,compared with control group.
2.3 敲低ETFA对SMMC-7721细胞皮下成瘤能力的影响
皮下成瘤实验结果(图3)显示,稳定敲低ETFA的SMMC-7721细胞在裸小鼠皮下生长28 d,与对照组相比,ETFA-1#和ETFA-2#组SMMC-7721细胞在皮下形成瘤块的体积明显小于对照组(图3A和B),瘤重亦明显小于对照组(图3C),表明敲低ETFA导致SMMC-7721细胞的皮下成瘤能力明显降低。

Fig.3 Effect of ETFA knockdown on oncogenic growth of SMMC-7721 cells in in vivo xenograft in nude mouse model.SMMC-7721 cells with ETFA knockdown were injected into nude mice.After various periods of time as indicated,tumors were measured with vernier calipers(A).Tumor volume(mm3)=tumor length×(tumor width)2/2.Tumors were isolated after 28 d.Images(B) and mass(C) of subcutaneosus tumors were shown.±s,n=14(control group),8(ETFA-1#group),9(ETFA-2#group).**P<0.01,compared with control group.
2.4 敲低ETFA对SMMC-7721细胞脂代谢的影响
尼罗红染色结果(图4A)显示,ETFA-1#和ETFA-2#组稳定敲低ETFA的SMMC-7721细胞胞浆有大量的脂质堆积(红色斑点),而对照组胞浆中未出现明显的脂滴。透射电镜结果(图4B)显示,稳定敲低ETFA的SMMC-7721细胞胞浆中有明显的脂滴聚集且数量多、体积大,而对照组胞浆未见明显脂滴聚集。上述结果提示,敲低ETFA可导致SMMC-7721细胞线粒体脂肪酸β氧化功能障碍。

Fig.4Effect of ETFA knockdown on lipid metabo⁃lism of SMMC-7721 cells.A:Nile red staining of SMMC-7721 single clones;B:images of transmission electron micro⁃scope.The red dye(A)and black arrows(B)showed the lipid droplet.
3 讨论
能量代谢重塑是细胞癌变的显著特征之一[10]。在癌变的过程中癌细胞通过自身代谢重塑从缺乏营养的环境中获得必要的营养,并利用这些营养来维持生存和增殖[11]。近期研究发现,线粒体脂肪酸β氧化功能异常与肿瘤的发生高度相关,参与多种肿瘤如乳腺癌和结肠癌等存活、增殖、耐药和转移[12-14]。但脂肪酸β氧化在肝癌中发挥的作用尚无统一的认识。一些研究发现,脂肪酸β氧化可被低氧诱导因子1抑制,从而促进肝癌的发生[15-16];而另一些研究发现,脂肪酸β氧化可加速肝癌细胞增殖,抗脂肪酸β氧化的疗法是阻止恶性肿瘤生长的一种潜在方法[15,17]。ETF由α和β(分别由ETFA和ETFB编码)2个亚基组成,它可以将脂肪酸β氧化过程中产生的电子传递给ETF-泛醌脱氢酶,并最终转移到氧化磷酸化途径中生成能量[18]。ETF基因突变会导致β氧化过程中电子转移活动异常,引发脂质代谢障碍。
本研究通过敲低ETFA来阻断SMMC-7721细胞脂肪酸β氧化过程,初步探讨了ETFA、脂肪酸β氧化及HCC三者之间的关系。软琼脂集落形成率反映细胞的群体依赖性、锚定依赖性和增殖能力,是肿瘤细胞恶性度的重要指标[19-20]。为探究敲低ETFA是否会对SMMC-7721细胞的恶性生长产生影响,本研究首先对稳定克隆的SMMC-7721细胞进行了软琼脂集落形成实验。实验结果发现,敲低ETFA后,SMMC-7721细胞集落形成数目明显减少,表明敲低ETFA明显抑制SMMC-7721细胞体外非锚定生长的能力。随后进一步研究了敲低ETFA对SMMC-7721细胞体内成瘤能力的影响。皮下成瘤实验结果显示,敲低ETFA后,SMMC-7721细胞皮下生长速度明显较慢,瘤块体积和质量均明显较小,表明敲低ETFA可明显抑制SMMC-7721细胞的皮下成瘤能力。由此提示,ETFA是调控线粒体脂肪酸β氧化的关键蛋白。用尼罗红染色和透射电镜进一步观察发现,敲低ETFA后SMMC-7721细胞中出现大量的脂滴堆积,而对照组未见明显脂质聚集,表明敲低ETFA严重影响SMMC-7721细胞的脂质代谢过程,这与ETFA调控脂肪酸β氧化的生物学功能一致[6,21]。上述结果提示,ETFA 与SMMC-7721细胞的恶性增殖和生长成瘤能力密切相关,其机制与调控SMMC-7721细胞的脂质代谢有关。
既然ETFA与SMMC-7721细胞的关系如此密切,那么ETFA在HCC患者中是否存在异常表达呢?有趣的是,使用数据库分析发现,在肝癌患者中,肝癌组织和正常肝组织中ETFA在转录水平无明显区别[23-24]。然而蛋白质生理功能的发挥是一个复杂的生物学过程,涉及到转录、翻译和翻译后修饰等[22]。本课题组前期研究结果显示,ETFA是Neddylation类泛素化修饰的底物,在BNL CL.2细胞中,Neddylation可抑制ETFA的泛素化降解过程,进而稳定ETFA的结构和功能[6]。因此推测,在HCC患者体内,ETFA可能通过转录后的调控机制来影响其生物学功能,这将是本课题组下一步研究的重点。
此外,本研究使用的稳定敲低ETFA的细胞克隆是通过质粒转染及潮霉素筛选获得的,CRISPRCas9技术及基于shRNA的敲低技术存在一定缺陷,可能造成脱靶效应的产生。本研究通过转染2种shRNA质粒获得了2种稳定敲低ETFA的细胞克隆,且2种克隆细胞展示出相同的细胞效应,在一定程度上避免了脱靶效应的可能性,可明确敲低ETFA对肝癌细胞的影响。
综上提示,ETFA可通过调控SMMC-7721细胞脂肪酸β氧化代谢过程影响SMMC-7721细胞的增殖和成瘤能力,抑制ETFA可阻碍HCC的增殖和发展。针对ETFA的分子可能成为靶向治疗HCC的新靶点。
