兔血浆中纳曲酮LC-MS/MS分析方法的建立及其在纳曲酮-3-O-辛酸酯药动学研究中的应用
2021-05-15陈学军张瑞华李丽琴
王 陈,石 童,陈学军,张瑞华,李丽琴
(国民核生化灾害防护国家重点实验室,北京 102205)
纳曲酮主要作为阿片类毒品依赖者脱毒后预防复吸的辅助药物[1-2],最近也被用于治疗酒精成瘾[3-4]。目前上市产品仅有片剂,由于首过效应严重,口服生物利用度低(5%~40%),需要多次服药,患者依从性差,造成在抗复吸治疗中的脱失率较高。因此,为提高患者的使用依从性,减少服药次数,国内外研究者致力于开发多种长效制剂。一方面开发多种纳曲酮给药系统,包括透皮制剂、微针给药系统、微球植入制剂、口服缓释制剂等[5-6];另一方面,利用纳曲酮存在活性羟基的结构特点,开展酯化前体药物研究[7-13],以提高生物利用度。国内外已有文献报道应用液相色谱-串联质谱法(liquid chro⁃matography-tandem mass spectroscopy,LC-MS/MS)开展纳曲酮的药动学研究[14-17]。本研究建立了血浆用量少、灵敏度更高的方法,对纳曲酮-3-O-辛酸酯在兔体内的药动学进行研究,并与纳曲酮原型药物的药动学参数进行差异性比较,为该化合物的实际应用提供参考依据。
1 材料与方法
1.1 药品、试剂和主要仪器
盐酸纳洛酮(批号:112K0747)和色谱纯甲醇(批号:WXBB0253V),美国Sigma公司;纳曲酮和纳曲酮-3-O-辛酸酯(纯度>99%),防化研究院合成,化学结构式见图1。色谱纯甲酸(批号:4022536003719),德国Merck公司;分析纯甲基叔丁基醚(批号:20130518),天津光复精细化工研究所;分析纯氢氧化钠(批号:20130822),北京化工厂。Agilent 1200/6410 LC/QQQ系统,美国安捷伦公司;Genie Vortex-2型涡旋振荡器,美国Scientific Industries公司;Sigma 1-14高速离心机,德国Sigma公司;N-EVAP型氮吹仪,美国Organonation Asso⁃ciates公司;DT5-4B型低速台式离心机,北京时代北利离心机有限公司;超纯水系统,美国Millipore公司。
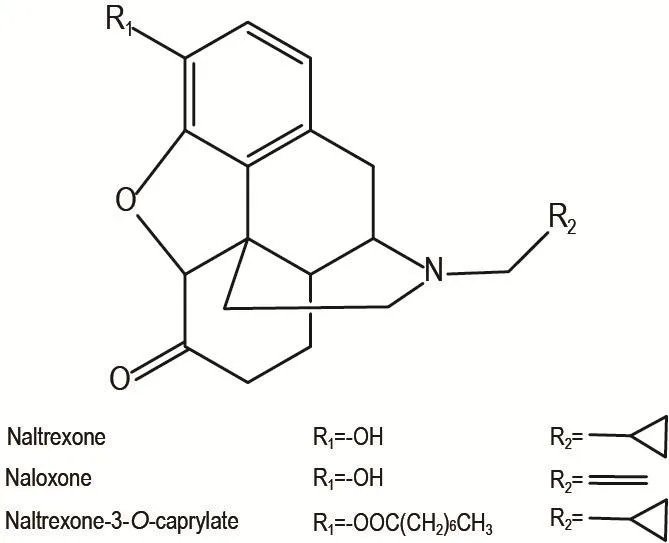
Fig.1 Chemical structures of naltrexone(NTX),naloxone and naltrexone-3-O-caprylate.
1.2 动物
12只新西兰大耳白兔,体重2.0~2.5 kg,成年,雌雄各半,由北京金牧阳实验动物养殖有限责任公司提供,合格证号为SCXK(京)2015-0005。实验动物使用许可证号:SYXK(军)2012-0017。饲养条件:温度保持在21~23℃,湿度保持在45%~75%,自由摄食饮水。本研究的动物使用方案获防化研究院实验动物福利与伦理委员会批准。
1.3 给药方案和样品采集
选用新西兰大耳白兔,雌雄各半,随机分成2组,每组6只,分别im给予纳曲酮1 mg·kg-1或纳曲酮-3-O-辛酸酯1.2 mg·kg-(1与纳曲酮1 mg·kg-1等摩尔剂量)。各组动物给药前及给药后(纳曲酮组:2.5,5,10,20,30,40,60,90,120,150 和240 min;纳曲酮3-O-辛酸酯组:5,15,30,60,120,240,360,480,600,720和1440 min)分别耳缘静脉取血0.3 mL,置于加有抗凝剂的塑料离心管中,30 min后166×g离心10 min取血浆,-20℃冷冻保存备用。
1.4 LC-MS/MS检测条件
LC条件:色谱柱:Aglient Zorbax SB-C18(100 mm×2.1 mm,3.5 μm);流动相:甲醇/0.1%甲酸水(50∶50);流速:0.2 m L·min-1;柱温:25℃;进样量:5 μL。
MS/MS条件:ESI源,正离子多反应监测模式:纳曲酮(342.1→324.1),内标纳洛酮(328.1→310.0),Fragmentor电压135 V,干燥气温度300℃,干燥气流速12 L·min-1,毛细管电压5 kV,Delta EMV为200 V。
1.5 标准曲线制备
精密称取盐酸纳曲酮溶于甲醇,配成1 g·L-1(游离碱计)储备液。该储备液用甲醇/水(50∶50)分别稀释成10,20,40,100,200,400,1000和2000 μg·L-1浓度系列的标准曲线工作液。精密称取标准品盐酸纳洛酮适量,用甲醇溶解后得到1 g·L-1(游离碱计)内标储备溶液,用甲醇/水(50∶50)稀释成200 μg·L-1,作为内标溶液。取100 μL空白兔血浆,加入5 μL标准曲线工作溶液,得到浓度分别为0.5,1,2,5,10,20,50和100 μg·L-1的血浆标准曲线样品。质控工作液(quality control,QC)同样稀释配制,纳曲酮浓度分别为0.8,10和80 μg·L-1,定量限溶液配置为0.5 μg·L-1。
1.6 血浆样品预处理
取兔血浆0.1 mL置于10 mL具塞玻璃试管中,加入5 μL甲醇/水(50∶50)(标准曲线样品和质控样品不加)、内标纳洛酮(200 μg·L-1)5 μL、0.1 mol·L-1NaOH溶液10 μL,涡旋振荡20 s后,加甲基叔丁基醚2 mL,涡旋振荡2 min,于400×g离心10 min,分取有机层1.6 mL,在50℃条件下氮吹仪吹干。残留物用流动相100 μL溶解,10 625×g离心10 min,分取上清75 μL,取 5 μL进样。
1.7 统计学分析
血浆样品预处理后经LC-MS/MS检测,所得的血药浓度数据经PKS V1.0软件(上海宏能软件有限公司)处理,采用非房室模型计算主要药动学参数。数据以±s表示,采用t检验进行统计学分析。P<0.05为差异具有统计学意义。
2 结果
2.1 质谱条件的确定和优化
纳曲酮和内标纳洛酮在ESI正离子电离方式下,主要生成准分子离子峰[M+H]+峰,分别为m/z 342和m/z 328,选择性对[M+H]+峰进行产物离子全扫描分析,纳曲酮和内标纳洛酮生成的主要碎片离子分别为m/z 324和m/z 310(图2),将其作为定量分析监测的产物离子,并进一步采用仪器自带的二级优化程序进行优化,最终优化碰撞能量分别为18 eV和20 eV。
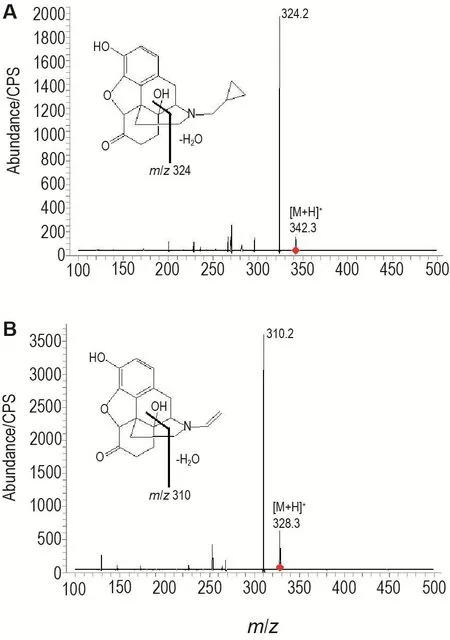
Fig.2 Product ion spectra of[M+H]+of naltrexone(A)and naloxone(B).
2.2 分析方法验证
2.2.1 专属性
在优化后的LC-MS/MS条件下,空白血浆样品、定量下限样品(lower limit of quantification,LLOQ)和兔im给药后的血浆样品色谱图见图3。研究结果表明,纳曲酮和内标纳洛酮的保留时间分别为1.45和1.35 min,空白血浆中的内源性成分在目标成分的出峰位置无干扰。
2.2.2 标准曲线和定量下限
以每个待测物浓度为横坐标,待测物与内标的峰面积比值为纵坐标,采用1/x加权最小二乘法进行线性回归,5 d内完成5条标准曲线的测定。平均标准曲线为y=(0.1987±0.0022)x+(0.0881± 0.0117)(n=5)。5条标准曲线在0.5~100 μg·L-1范围内均显示良好的线性(r2>0.999)。新配LLOQ(0.5 μg·L-1)浓度点样品进行定量下限的考察,每天测定5份样品,连续3 d,计算批间和批内的准确度和精密度。在LLOQ浓度下,批间和批内准确度为109.5%和108.1%,RSD分别为3.2%和5.2%。
2.2.3 稀释效应
对于超出线性范围的血浆样品,用空白血浆样品稀释10倍后进行重新测定,通过稀释效应进行考察。配制800 μg·L-1的血浆样品(n=3),用空白血浆稀释10倍后,按1.6方法进行操作。根据随行标曲计算样品的实测浓度平均值为81.4 μg·L-1,准确度为101.8%,RSD为2.4%。表明采用空白血浆对高浓度样品进行稀释,对测定结果基本无影响。
2.2.4 基质效应和回收率
取0.8,10和80μg·L-13个浓度的质控样品(n=6),按1.6方法进行操作,进行LC-MS/MS分析后所得的峰面积为A。取来源于不同兔的空白血浆0.1 mL,按1.6方法进行操作,残留物分别用100 μL浓度分别为0.8,10和80 μg·L-1的纳曲酮溶液(均含内标纳洛酮10 μg·L-1)复溶,进行LC-MS/MS分析后所得的峰面积为B;取0.1×10-3L的水代替空白血浆,按1.6方法处理,所得的峰面积为C。回收率(%)=A/B×100%,基质效应(%)=B/C×100%。
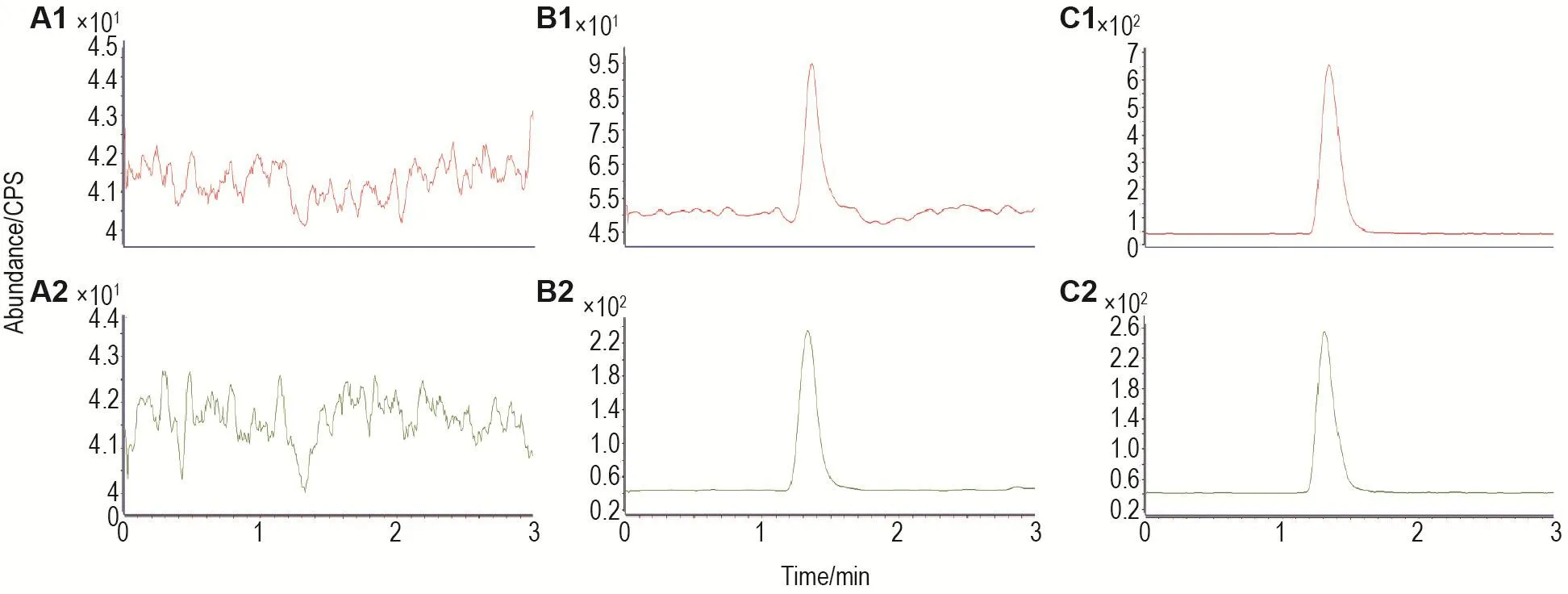
Fig.3 Representative multiple reaction monitoring(MRM)chromatograms of naltrexone(A)and naloxone(B)in rabbit plasma.A1,B1 and C1:blank plasma sample;A2,B2 and C2:blank plasma spiked with 0.5 μg·L-1naltrexone and 10 μg·L-1 naloxone.Plasma sample collected after an im administration of naltrexone-3-O-caprylate.HPLC separation was accomplished on an Agilent Zorbax SB-C18 column(100 mm×2.1 mm,3.5 μm)with a mobile phase composed of methanol-0.1 FA water(50∶50)at a flow rate of 0.2 mL·min-1.The ion transitions monitored in multiple reaction-monitoring modes were m/z 342.2→324.1 and m/z 328.1→310.2 for naltrexone and naloxone,respectively.
表1为基质效应和回收率的考察结果。在质控浓度为0.8,10和80 μg·L-1下,纳曲酮的基质效应分别为87.2%,84.6%和86.8%,基质可引起目标成分信号抑制,但3个浓度的抑制程度基本相当,因此不影响目标成分的定量测定,内标纳洛酮的基质效应为75.2%。3个浓度纳曲酮的回收率分别为77.1%,81.0%和76.5%,内标纳洛酮的回收率为77.8%。
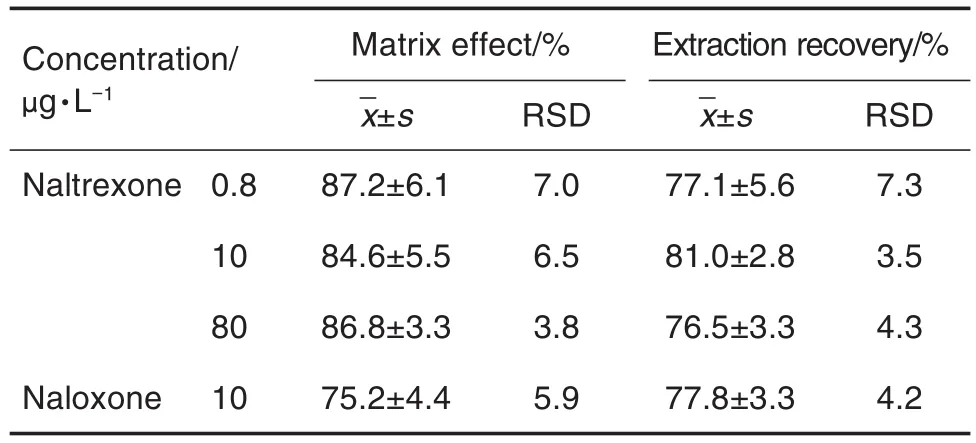
Tab.1 Matrix effect and extraction recovery of naltrex⁃one and naloxone in rabbit plasma
2.2.5 准确度和精密度
采用3个分析批次对测定方法的准确度和精密度进行验证,取浓度为0.8,10和80 μg·L-1的质控样品,按1.6方法进行操作,在每个分析批次内进行5次分析测定,每分析批次随行标准曲线,并以该标准曲线计算血药浓度,求算每批的批内精密度和准确度以及3批共15个数据的批间精密度和准确度。方法的准确度和精密度结果如表2所示,3个浓度的质控样品的准确度为94.9%~105.4%,批内精密度1.3%~5.0%,批间精密度2.7%~4.2%。分析方法的准确度和精密度均符合方法学要求。
2.2.6 稳定性
方法学验证过程中,利用0.8,10和80 μg·L-13个浓度的质控样品对稳定性进行考察,包括室温25℃放置4 h、-20℃冷冻条件下保存30 d、样品置于自动进样器中8 h和3次冻融循环的稳定性,并利用随行标准曲线计算样品的实测浓度。样品的稳定性考察结果如表3所示,血浆样品在室温下放置4 h、-20℃保存30 d,处理后样品在室温条件下在自动进样器内放置8 h以及血浆样品3次冻融循环后样品保持稳定,准确度为98.3%~103.0%,精密度为1.8%~6.7%。
2.3 药动学参数分析
应用所建立的LC-MS/MS方法测定了兔im给予纳曲酮和纳曲酮-3-O-辛酸酯后血浆中纳曲酮的含量,平均血药浓度-时间曲线见图4。采用非房室模型对所测数据进行分析,得到主要的药动力学参数见表4。研究结果表明,im给予纳曲酮1.0 mg·kg-1后吸收迅速;而与之相比,im给予纳曲酮-3-O-辛酸酯1.2 mg·kg-1后,血浆中纳曲酮浓度上升缓慢,Tmax,T1/2和 MRTtn均显著延长(P<0.01),Cmax显著降低(P<0.01)。
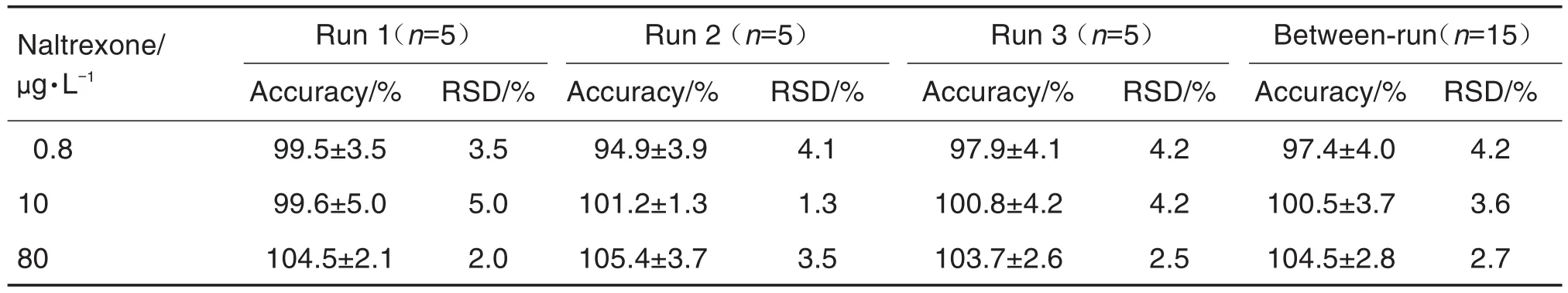
Tab.2 Accuracy and precision of determination of naltrexone in rabbit plasma
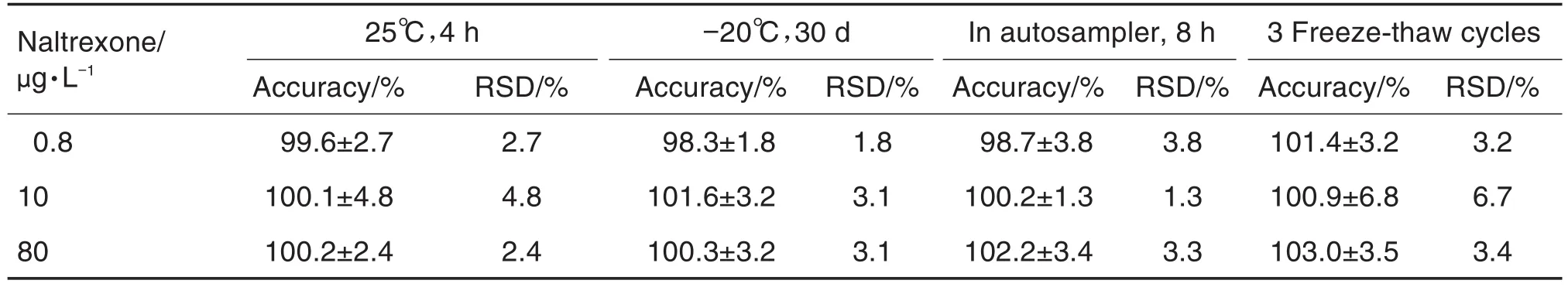
Tab.3 Stability of naltrexone in rabbit plasma
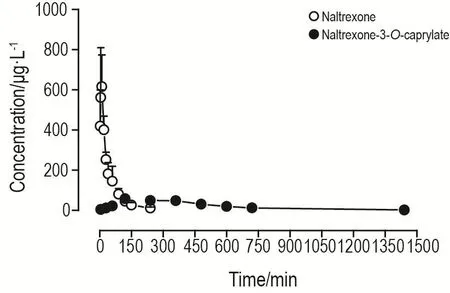
Fig.4 Mean plasma concentration-time curve of naltrex⁃one after intramuscular administration of naltrexone(1 mg·kg-1)or equal molar dose of naltrexone-3-O-caprylate(1.2 mg·kg-1)in rabbits.
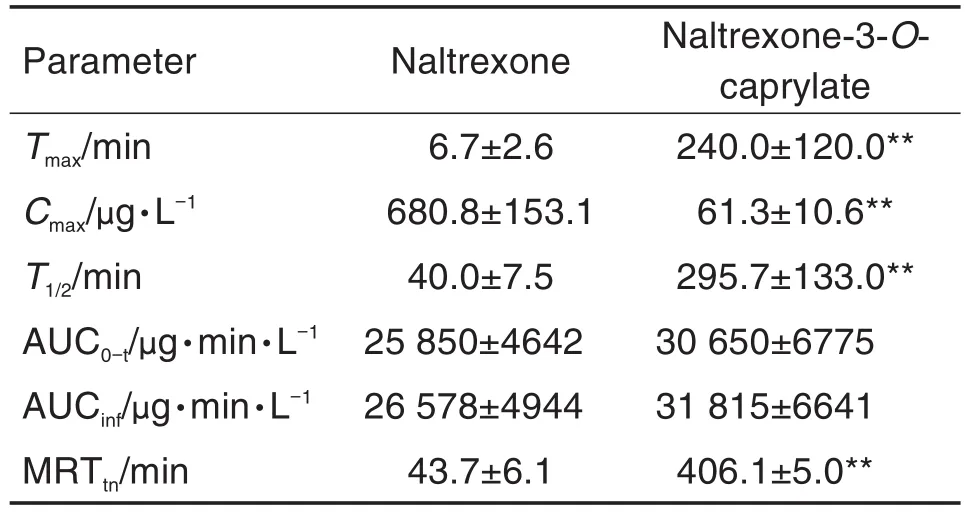
Tab.4 Main pharmacokinetic parameters of naltrexone after intramuscular administration of naltrexone or naltrexone-3-O-caprylate in rabbits.
3 讨论
本研究对LC-MS/MS方法学进行了系统验证。采用ESI源进行正负离子扫描,发现纳曲酮和内标纳洛酮在正离子模式下响应值较高,因此采用正离子检测模式。在色谱条件优化中,以分离度、对称性及保留时间为指标,对流动相组成及甲酸、乙酸、甲酸铵等添加剂的种类和含量进行优化,最终确定以甲醇/0.1% FA水溶液(50∶50)作为流动相。在样品预处理过程中,以回收率和基质效应为指标,考察了正己烷、乙酸乙酯和甲基叔丁基醚等有机溶剂及其不同比例的混合物作为提取溶剂,最后发现甲基叔丁基醚提取效率高,基质干扰少,最终优选其为提取溶剂。本研究所建立的方法快速、准确、灵敏度高,适用于兔血浆样品中纳曲酮含量的测定。
兔是药物临床前研究的主要实验对象之一。纳曲酮及其新剂型常以兔为实验对象开展代谢动力学研究[18-19],同时也有一些文献报道酯化前体药物在兔体内的药动学研究[20-21]。本研究发现,纳曲酮辛酸酯作为酯化前体药物,能够显著延长纳曲酮在体内的驻留时间,Tmax,T1/2和MRTtn都较纳曲酮显著延长,分别延长至35.8,7.4和9.3倍,Cmax降低至9.0%,起到明显的缓释效果。
本研究建立的LC-MS/MS方法可用于检测兔血浆样品中纳曲酮的含量,并比较了纳曲酮原型药物与酯化前体药物的药动学参数,为设计研发阿片类毒品依赖者脱毒后长效抗复吸药物提供数据参考。
