大蜡螟成虫3个醛氧化酶基因的鉴定、序列特征与组织表达模式
2021-05-15蒋秀云汪正威蒋兴川
刘 苏,蒋秀云,陈 诚,汪正威,蒋兴川*
(1.作物有害生物综合治理安徽省重点实验室,植物病虫害生物学与绿色防控安徽普通高校重点实验室,安徽农业大学植物保护学院,合肥 230036;2. 安徽审计职业学院,合肥 230601;3. 中国科学院热带森林生态重点实验室化学生态学组,中国科学院西双版纳热带植物园,昆明 650000)
昆虫的各项生命活动,如寻找配偶、定位寄主与产卵场所、躲避天敌等,都依赖于其灵敏的嗅觉系统(骆丹等, 2017; 盛子耀等, 2019)。昆虫的嗅觉过程始于环境中的气味化合物进入触角上的嗅觉感器,这些气味分子与感器中的载体蛋白和受体等互作,最终激活嗅觉神经元,引导昆虫产生行为反应(杜立啸等, 2016; 刘伟等, 2018; 张玉等, 2019)。当这一过程完成之后,感器中的气味分子会被迅速降解,才能使嗅觉神经元的敏感性恢复,以应对新一轮的气味刺激(Leal, 2013)。
与气味降解相关的酶统称为气味降解酶(odorant-degrading enzymes, ODEs),其包括多种代谢酶家族,如醛氧化酶(aldehyde oxidases, AOXs)、羧酸酯酶(carboxylesterases, CarEs)、细胞色素P450(cytochrome P450s, CYPs)和谷胱甘肽S-转移酶(glutathioneS-transferases, GSTs)等(Younusetal., 2014)。醛类是多种鳞翅目昆虫性信息素的主要组分,也是多种植物的主要挥发性成分,因此昆虫触角中的AOXs对于降解感器中的醛类气味分子和维持嗅觉神经元的敏感性具有重要作用(杨从文等, 2010; Chooetal., 2013; Xu and Liao, 2017)。
首个被鉴定的与气味降解相关的AOX来自烟草天蛾Manducasexta(Rybczynskietal., 1989)。随后的研究证实在家蚕Bombyxmori和多音天蚕Antheraeapolyphemus触角中也存在多个能够降解醛类(如苯甲醛benzaldehyde和蚕蛾醛bombykal)的AOXs(Rybczynskietal., 1990)。随着分子生物学技术的发展,编码AOXs的基因也先后从家蚕、甘蓝夜蛾Mamestrabrassicae、脐橙螟Amyeloistransitella等昆虫中克隆得到(Merlinetal., 2005; Pelletieretal., 2007; Chooetal., 2013)。Choo等使用昆虫细胞系表达了脐橙螟AtraAOX2,体外实验证明重组的AtraAOX2蛋白能降解包括绿叶气味反-2-己烯醛(trans-2-hexenal)和性信息素11Z,13Z-十六碳二烯醛(Z11Z13-16Ald)在内的多种醛类(Chooetal., 2013)。通过对多种昆虫的基因组和转录组数据进行挖掘,大量的AOXs基因得以鉴定,其中有很多基因特异性或高量表达于昆虫触角,表明它们可能会参与醛类气味物质的降解(杨瑜等, 2010; Zhangetal., 2014; Huangetal., 2016; Xu and Liao, 2017; Zhangetal., 2017)。此外,还有一些AOXs主要表达于昆虫的非嗅觉组织或幼虫期。如致倦库蚊Culexquinquefasciatus的一个AOX主要表达于高龄幼虫,并与杀虫剂抗性有关(Colemanetal., 2002);家蚕丝腺中的一个AOX具有催化吲哚-3-乙醛(indole-3-acetaldehyde)生成吲哚-3-乙酸(indole-3-acetic acid)的功能(Takeietal., 2019)。
大蜡螟Galleriamellonella属鳞翅目Lepidoptera螟蛾科Pyralidae蜡螟亚科Galleriinae,是危害养蜂业的重要害虫之一(杨爽等, 2016)。大蜡螟成虫在蜂巢中产卵,孵化的幼虫蛀食巢脾,为害严重时,整箱巢脾被毁,导致群蜂飞逃(Kwadhaetal., 2017)。目前已被鉴定出的大蜡螟成虫性信息素组分有3种,分别为壬醛(nonanal)、十一醛(undecanal)和5,11-二甲基二十五烷(5, 11-dimethylpentacosane)(Leyrer and Monroe, 1973; Svenssonetal., 2014)。大蜡螟成虫对其中的壬醛和十一醛均有显著的触角电位反应(Payne and Finn, 1977),因此基于醛类挥发物的性信息素通讯对于大蜡螟至关重要。基于此,可预测其触角中应当存在能降解醛类物质的AOXs。本研究通过检索大蜡螟触角转录组,在鉴定了3个AOXs编码基因(GmelAOX1、GmelAOX2和GmelAOX3)的基础上,分析了这些基因的序列特征、基因组位置、外显子-内含子结构以及组织表达模式。本研究结果以期为阐明大蜡螟AOXs的生理功能奠定基础。
1 材料与方法
1.1 实验试虫
大蜡螟幼虫采集自安徽省合肥市郊区养蜂场(蜜蜂品种为意大利蜜蜂Apismellifera)。将幼虫带回实验室,在人工气候箱中饲养并建立实验室种群。所用大蜡螟人工饲料的配方参考黄诚华等(2010)。饲养条件为:温度27±1℃,相对湿度65%±5%,光 ∶暗周期14 h ∶10 h。
1.2 同源检索与序列分析
基于Zhao等报道的大蜡螟触角转录组(Zhaoetal., 2019),本研究使用BioEdit软件中的TBLASTN程序在此转录组数据库中检索AOXs编码基因。所用的查询模板为从GenBank中下载的鳞翅目昆虫(如家蚕、棉铃虫Helicoverpaarmigera、大螟Sesamiainferens等)的AOXs蛋白序列,期望值(E-value)设为10-5。输出结果经BLASTX比对和手工检查剔除冗余序列。
获得大蜡螟GmelAOXs基因序列后,使用ORF Finder程序(www.ncbi.nlm.nih.gov/gorf/gorf.html)查找其开放阅读框(open reading frame, ORF);使用ExPASy工具(www.expasy. org/tools/protparam.html)计算蛋白质的理论分子量与等电点;使用NCBI的CD search(www.ncbi. nlm.nih.gov/structure/cdd/cdd.shtml)预测蛋白的保守功能域;根据已报道的大蜡螟基因组序列(Langeetal., 2018),使用Splign程序(www. ncbi.nlm.nih.gov/sutils/splign/splign.cgi)分析AOXs基因在基因组框架(scaffold)上的位置以及外显子-内含子结构。使用Clustal Omega服务器(www.ebi.ac.uk/tools/msa/clustalo)进行多序列连配,使用MEGA 7.0软件以neighbor-joining法构建系统发育树(Kumaretal., 2016),各分支置信度经Bootstrap法重复检验1 000次。
1.3 总RNA提取与cDNA合成
收集羽化后48 h之内未交配的大蜡螟雌、雄成虫,解剖为不同组织:触角、去除触角的头部、腹部和足。使用RNAiso Plus试剂(宝生物, 大连)提取总RNA,经琼脂糖凝胶电泳和NanoDrop2000微量分光光度计分析样品的质量和浓度后,使用ReverTra Ace qPCR RT Master Mix with gDNA Remover反转录试剂盒(东洋纺, 日本)合成第一链cDNA。
1.4 组织表达模式分析
使用实时荧光定量PCR分析GmelAOXs在大蜡螟成虫不同组织中的相对表达水平。所用引物见表1。在前期研究中发现甘油醛-3-磷酸脱氢酶(GAPDH)基因在大蜡螟不同组织中的表达水平较稳定,因此本实验使用该基因作为内参基因。在预实验中,使用琼脂糖凝胶电泳分析每对引物的扩增产物,并将产物送生物公司测序,以确定引物特异性。
定量PCR反应体系20 μL,包括10 μL SYBR Green Realtime PCR Master Mix(东洋纺,日本)、0.5 μL上游引物、0.5 μL下游引物、1 μL(10 ng)第一链cDNA和8 μL ddH2O。仪器为美国Bio-Rad公司CFX96型定量PCR仪,反应程序为95℃ 2 min,1个循环;95℃ 10 s,60℃ 25 s,40个循环。反应完成后,温度从60℃逐步升至95℃,绘制熔解曲线,以检测是否存在引物二聚体。实验设3次生物学重复,基因相对表达量使用2-△△Ct方法计算(Livak and Schmittgen, 2001)。使用DPS软件9.5版进行数据统计(Tang and Zhang, 2013),不同样本之间的差异显著性经由单因素方差分析(one-way ANOVA)和Tukey测验进行比较。显著性水平设为P<0.05。
2 结果与分析
2.1 GmelAOXs鉴定与序列分析
通过检索大蜡螟触角转录组,获得了3个编码AOXs的cDNA序列,分别命名为GmelAOX1、GmelAOX2和GmelAOX3(GenBank登录号分别为MT039791、MT039792和MT039793)。3个GmelAOXs的开放阅读框介于3 798~3 870 bp之间,编码的蛋白质长度介于1 265~1 289个氨基酸之间(表2)。根据cDNA推导的3个GmelAOXs蛋白的分子量较为相似(139.5~144.2 kDa),且等电点分别为6.1、6.0和6.4,均属于酸性蛋白(表2)。BLASTX比对结果表明,3个GmelAOXs与同属螟蛾科的亚洲玉米螟Ostriniafurnacalis和脐橙螟的AOXs的氨基酸一致性最高(一致性67%~72%; 表2)。但3个GmelAOXs之间的氨基酸一致性较低,其中GmelAOX1与GmelAOX2的氨基酸一致性为46%,GmelAOX1与GmelAOX3的氨基酸一致性为52%,GmelAOX2与GmelAOX3的氨基酸一致性为45%。多序列比对结果表明,3个GmelAOXs蛋白序列中均含有相似的结构域:2个铁硫氧化还原中心(2Fe-2S)、8个保守的半胱氨酸残基,1个黄素腺嘌呤二核苷酸(FAD)结合区域和1个钼辅因子(MoCo cofactor)结合区域(图1)。

表2 3个GmelAOXs的序列信息与BLASTX最佳匹配

图1 大蜡螟3个GmelAOXs蛋白序列比对Fig.1 Alignment of the protein sequences of three GmelAOXs from Galleria mellonella注:2个铁硫氧化还原中心([2Fe-2S] I和II)以灰色横线表示,保守的半胱氨酸残基以实心三角形标注。黄素腺嘌呤二核苷酸(FAD)结合区域和钼辅因子(MoCo cofactor)结合区域分别以虚线和点线表示。Note: Two iron-sulfur redox centers ([2Fe-2S] I and II)are indicated by the grey line, and conserved cysteine residues are indicated with solid triangles. The FAD-binding domain and the MoCo cofactor/substrate-binding domain are indicated by dashed and dotted lines, respectively.
2.2 系统进化分析
基于鳞翅目、双翅目、鞘翅目昆虫和脊椎动物的AOXs蛋白序列构建系统进化树(图2)。因AOXs与黄嘌呤脱氢酶(xanthine dehydrogenases, XDHs)具有较为相似的结构域(Kurosakietal., 2013),因此使用XDHs作为外群。结果清晰地显示,昆虫AOXs与脊椎动物AOXs以及脊椎动物和昆虫的XDHs分别聚类在独立的进化分支(图2)。大蜡螟GmelAOXs与来自鳞翅目的AOXs亲缘关系较近,GmelAOX1与棉铃虫HarmAOX2、大螟SinfAOX2、家蚕BmorAOX2和稻纵卷叶螟CmedAOX2聚为一支,GmelAOX2与脐橙螟AtraAOX2聚为一支,GmelAOX3与棉铃虫HarmAOX4和苹果蠹蛾CpomAOX1聚为一支。此外,3个GmelAOXs被分隔在不同的进化分支上,暗示它们可能具有功能上的分化(图2)。

图2 不同物种AOXs进化树Fig.2 Phylogenetic tree of AOXs from various species注:3个GmelAOXs以实心三角表示。Three GmelAOXs are indicated with solid triangles. 物种、基因名称与登录号。Species, gene names and GenBank accession numbers: 家蚕Bombyx mori: BmorAOX1 (NP_001103812), BmorAOX2 (NP_001103811), BmorXDH1(BAA21640), BmorXDH2(BAA24290); 大螟Sesamia inferens: SinfAOX1(AII21996), SinfAOX2(AII21997), SinfAOX3(AII21998); 苹果蠹蛾Cydia pomonella: CpomAOX1(AKQ06145), CpomAOX2(AKQ06146); 脐橙螟Amyelois transitella: AtraAOX2 (AGQ43599); 稻纵卷叶螟Cnaphalocrocis medinalis: CmedAOX1(KY595778), CmedAOX2(KY595779), CmedAOX3(KY595780), CmedAOX4(KY595781); 小菜蛾Plutella xylostella: PxylAOX1(Px007526), PxylAOX2(Px003730), PxylAOX3(Px007519); 棉铃虫Helicoverpa armigera: HarmAOX1-HarmAOX6(Xu and Liao, 2017); 冈比亚按蚊Anopheles gambiae: AgamAOX(XP_316291), AgamXDH(AAO14865); 致倦库蚊Culex quinquefasciatus: CquiAOX(AAF87601); 黑腹果蝇Drosophila melanogaster: DmelAOX1(AAF55207), DmelAOX2(AAF55208), DmelAOX3(AAF55209), DmelAOX4(AAF55210), DmelXDH(CAA68409); 赤拟谷盗Tribolium castaneum: TcasAOX1(XP_008190865), TcasAOX2(EFA11446), TcasAOX3(EFA13013); 小家鼠Mus musculus: MmusAOX1(NP_033806), MmusAOX2(NP_001008419), MmusAOX3(NP_076106), MmusAOX4(NP_076120), MmusXDH(NP_035853); 原鸡Gallus gallus: GgalAOX1(DQ150102), GgalAOX2(DQ150103), GgalXDH(NP_990458).
2.3 基因结构分析
使用Splign程序分析了GmelAOXs在大蜡螟基因组上的位置、长度和外显子-内含子结构。结果显示,3个GmelAOXs位于不同的基因组框架(scaffold)上,其中GmelAOX1和GmelAOX3位于scaffold69,转录方向均为反向,序列间的距离为602 kb;而GmelAOX2位于scaffold96,转录方向为正向(图3-A)。GmelAOX1、GmelAOX2和GmelAOX3在基因组上的长度分别为15 792 bp、22 970 bp 和27 237 bp。GmelAOX1和GmelAOX2分别含有17和16个外显子,而GmelAOX2的外显子数量较多,为21个(图3-B)。
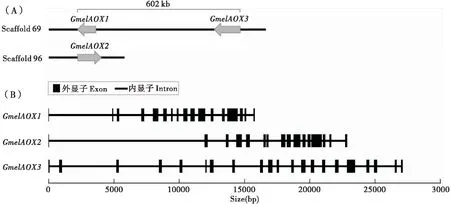
图3 3个GmelAOXs基因在基因组上的分布(A)和内含子结构(B)Fig.3 Genomic locations (A)and exon-intron structures (B)of three GmelAOXs
2.4 组织表达模式分析
定量PCR结果表明,3个GmelAOXs基因在大蜡螟成虫各组织中的表达模式不同。GmelAOX1主要表达于雌雄成虫触角和腹部,其在头部和足部中的表达量显著降低(P<0.05; 图4-A)。GmelAOX2主要表达于雌雄成虫触角,其在触角中的表达水平显著高于其它组织(P<0.05; 图4-B)。此外,GmelAOX2在雌雄触角中的表达差异不显著(P>0.05; 图4-B)。GmelAOX3在雌雄触角、腹部和足部均能检测到较高的转录水平,而在头部表达量显著低于其它组织(P<0.05; 图4-C)。

图4 GmelAOXs基因在成虫各组织中的相对表达水平Fig.4 Relative expression levels of GmelAOX genes in various adult tissues注:A~C分别表示GmelAOX1、GmelAOX2和GmelAOX3。各基因在雌成虫足部的表达量设为1倍。不同小写字母表示差异显著(P<0.05)。Note: A~C represent GmelAOX1 to GmelAOX3, respectively. The expression level of each gene in female leg was set as one-fold. Different lowercase letters represent significant differences (P<0.05).
3 结论与讨论
作为一类重要的代谢酶,AOXs在动植物体内广泛存在。在植物中,AOXs相关研究多涉及植物生长素如脱落酸和吲哚乙酸的合成(Kasahara, 2016);而在哺乳动物中,有关AOXs的研究主要集中于药物与外源物代谢方面(Romãoetal., 2017)。昆虫的AOXs虽然也具有多种功能,但目前关注较多的是该基因在嗅觉过程中的作用。此前已有研究发现AOXs基因特异性表达于家蚕和甘蓝夜蛾触角上对性信息素敏感的毛型感器(Merlinetal., 2005; Pelletieretal., 2007),并且烟草天蛾、多音天蚕和脐橙螟触角中的AOXs蛋白能够降解醛类性信息素和植物释放的醛类挥发物(Rybczynskietal., 1989, 1990; Chooetal., 2013)。大蜡螟成虫利用醛类性信息素进行种内通讯(Leyrer and Monroe, 1973; Payne and Finn, 1977; Svenssonetal., 2014),因此推测其触角中应当也存在能够降解醛类的AOXs。基于此假设,本研究从大蜡螟触角转录组中鉴定了3个GmelAOXs基因。这些基因编码的蛋白质均具有醛氧化酶的典型特征,包括2个铁硫氧化还原中心、1个FAD结合域和1个钼辅因子结合域,这些特征与其它昆虫AOXs蛋白一致(杨瑜等, 2010; Chooetal., 2013; Xu and Liao, 2017)。系统进化分析表明3个GmelAOXs均被划分在AOX分支,且与其它鳞翅目昆虫AOXs的亲缘关系较近。这些结果证明了本研究鉴定的GmelAOXs均属于醛氧化酶家族。
昆虫AOX是一类多基因家族,在家蚕、棉铃虫和黑腹果蝇Drosophilamelanogaster的基因组中分别发现了8个、6个和4个AOXs基因(杨瑜等, 2010; Mareljaetal., 2014; Xu and Liao, 2017)。本研究从大蜡螟触角中鉴定的GmelAOXs基因数量较少,可能是由于部分AOXs基因只表达于成虫除触角之外的其它组织,或是只表达于幼虫期,因而无法从成虫触角中鉴定。如家蚕的8个AOXs基因中仅有2个(BmorAOX1和BmorAOX2)表达于成虫触角(杨瑜等, 2010),棉铃虫HarmAOX5和HarmAOX6仅表达于幼虫期或蛹期,而无法在成虫期以及成虫触角中检测到(Xu and Liao, 2017)。在其它鳞翅目昆虫如大螟、苹果蠹蛾Cydiapomonella、小菜蛾Plutellaxylostella和稻纵卷叶螟Cnaphalocrocismedinalis中,从触角转录组中鉴定的AOXs数量也多在2~4个之间(Zhangetal., 2014; Huangetal., 2016; Heetal., 2017; Zhangetal., 2017)。另一方面,本研究仅是检索大蜡螟触角转录组,若对大蜡螟全基因组进行数据挖掘将会获得更加全面的AOXs基因家族信息。此外,本研究发现3个GmelAOXs基因均由数量众多的外显子(16~21个)组成,这与棉铃虫AOXs基因家族(16~21个外显子)一致(Xu and Liao, 2017),而与家蚕AOXs家族的外显子数量(12~20个)略有差异(杨瑜等, 2010)。虽然目前尚无关于昆虫AOXs基因可变剪切的报道,但在脊椎动物如小家鼠Musmusculus中已发现AOXs基因存在可变剪切的现象,但这一现象的生物学意义仍不明确(Kurosakietal., 2004)。因此,明确大蜡螟GmelAOXs的基因组信息与外显子-内含子结构将有助于深入探究该基因家族在昆虫中的进化与分化。
研究AOXs在不同组织中的表达模式有助于推测基因的功能。本研究发现GmelAOX2在大蜡螟雌雄成虫触角中均高量表达,且表达水平显著高于其它非嗅觉组织如头部、腹部和足部。大蜡螟性信息素中含有挥发性醛类组分(Svenssonetal., 2014),因此推测GmelAOX2编码的蛋白可能在降解进入触角感器的醛类挥发物过程中起作用。本研究虽没有验证GmelAOX2蛋白对醛类物质的降解功能,但GmelAOX2与脐橙螟AtraAOX2的氨基酸一致性较高(表2),而AtraAOX2重组蛋白可降解包括性信息素和植物挥发物在内的多种醛类底物(Chooetal., 2013),这为推测GmelAOX2的潜在功能提供了参考。GmelAOX1高量表达于雌雄成虫触角和腹部,GmelAOX3大量表达于除头部之外的所有组织,暗示这些基因可能具有双重功能,即降解进入触角感器中的醛类气味分子和清除进入体内的外源醛类物质。在其它昆虫如稻纵卷叶螟和棉铃虫中,也发现了多个AOXs基因同时高量表达于触角和非嗅觉组织(Xu and Liao, 2017; Zhangetal., 2017)。需要说明的是,本实验仅分析了GmelAOXs基因在大蜡螟成虫组织中的表达模式,没有检测这些基因在幼虫代谢器官(如中肠、马氏管和脂肪体等)中的表达情况,因此这些基因在大蜡螟幼虫生理过程中的功能暂不明确。后续研究将使用嗅觉感器定位、真核表达、酶活测定以及RNA干扰等技术,阐明大蜡螟AOXs在嗅觉和其它生理过程中的功能。
