四株PGPR菌株混菌发酵体系的构建及促生效应评价
2021-05-14周静黄文茂秦利军韩丽珍
周静 黄文茂 秦利军 韩丽珍
(贵州大学生命科学学院 农业生物工程研究院 山地植物资源保护与种质创新教育部重点实验室 山地生态与农业生物工程协同创新中心,贵阳 550025)
植物根际促生菌(Plant growth promoting rhizobacteria,简称PGPR)是指分布于植物根围土壤中、可直接或间接地促进植株生长的微生物类群[1],是微生物菌剂产品的核心和发挥促生效果的关键,也是微生物肥料重要的种质资源[2]。微生物菌剂分为单菌剂和复合菌剂,单菌剂是由一种功能微生物制成;复合菌剂是由两种或以上的有益微生物组成。相较于单菌剂,复合菌剂具有协同作用,通过分泌不同生理活性物质,影响植株的生理代谢活动,促进植物的生长,具有种类更多样、功能更齐全、促生效果更好的优点[3]。近年来利用复合菌剂进行不同植物的接种研究也已见报道。张英等[4]研究发现由4株PGPR制备的微生物接种剂对盆栽红三叶有显著促生作用。由中间苍白杆菌(Ochrobactrum intermedium)YCG1、 短 小 芽 胞杆菌(Bacillus pumilus)YCG2和枯草芽胞杆菌(B.subtilis)YCG3组成的PGPR复合菌剂可改善烤烟的农艺性状和烟叶的化学品质,降低烤烟发病率[5]。然而,这些复合菌剂均是由单菌株发酵后混合配制而成,制备过程繁琐耗时。混菌发酵又称混合发酵,不仅可缩短发酵时间、提高发酵效率,还可节约生产成本[6];在食品或医学微生物研究中偶有报道,如利用瑞士乳杆菌(Lactobacillus helveticus)和鼠李糖乳杆菌(L. rhamnosus)进行混合发酵后,获得的活菌数较单菌株培养分别提高了1.8倍和10.2倍[7];但混菌发酵用于制备促生菌复合菌剂的报道极少。同时,混菌发酵体系的构建是一个复杂的过程,除了必须考虑体系内不同微生物之间的相互作用外,适宜的培养基成分及发酵条件也是提高菌体生长量的重要途径。研究显示对9株益生菌混合培养的培养基配方和条件优化后,单位活菌数是优化前的2倍[8]。显然,建立优良的混菌发酵体系,对复合菌剂的制备及更好发挥微生物功能具有重要意义。
项目组在前期研究中,从茶树根际分离筛选到具有多种不同促生特性的4株细菌菌株,分别为恶臭假单胞菌(Pseudomonas putida)HGD3、弯曲芽胞孢杆菌(B. flexus)HGD12、贝莱斯芽胞杆菌(B.velezensis)HP9和洋葱伯克霍尔德氏菌(Burkholderia cepacia)P10,可以显著促进辣椒或花生的生长[9-10]。为了便于田间的应用,减少复合菌剂制备的复杂程度,本研究拟利用以上4株无拮抗性的PGPR菌株构建混菌发酵体系、优化其培养基组分和发酵条件,并进行混菌发酵制剂的盆栽实验,为下一步微生物菌剂的开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株及辣椒品种 供试菌株为P. putida HGD3、B. flexus HGD12、B. velezensis HP9和 B.cepacia P10,由项目组从茶树根际分离、并保存于本实验室。供试辣椒品种为遵辣9号。
1.1.2 培养基 LB液体培养基:胰蛋白胨10.0 g,NaCl 10.0 g,酵母浸出物5.0 g,蒸馏水1 000 mL,pH7.0-7.2,121℃灭菌20 min;
基础培养基:葡萄糖20.0 g,蛋白胨10.0 g,Na2HPO44.0 g,NaH2PO42.0 g,MgSO40.5 g,CaCl20.2 g,蒸馏水1 000 mL,pH值为7.0-7.2,115℃灭菌15 min。
1.2 方法
1.2.1 4株PGPR菌株的生长曲线测定及接种顺序的确定 将-80℃甘油保藏的HGD3、HP9、P10、HGD12菌株各取100 μL分别接种于50 mL LB液体培养基中,30℃、150 r/min振荡培养16 h,调节菌液OD600值为1.0。将4株菌株的活化菌液转接于100 mL基础培养基中,相同条件下恒温振荡培养24 h,每隔2 h测定OD600值,绘制各株菌的生长曲线,根据各菌株进入对数生长期的时间点确定接种顺序。实验设3个重复。
1.2.2 单因素及正交实验优化培养基 以菌体生长量为筛选指标,对不同碳源(葡萄糖、果糖、蔗糖、乳糖、麦芽糖)、氮源(牛肉膏、蛋白胨、酵母浸出物、硫酸铵、硝酸钠)、碳氮比(20∶1、15∶1、10∶1、5∶1、1∶1)进行优化;以相同含碳量的4种碳源替代葡萄糖,以相同含氮量的4种氮源替代蛋白胨(表1)。单因素优化在基础培养基条件下进行,将活化菌液按接种顺序依次接入,30℃、150 r/min振荡培养24 h,实验设3个重复。以优化结果设置3因素4水平正交实验L16(43)(表2),最终确定培养基最优配方。
1.2.3 单因子及响应曲面法优化发酵条件 以优化培养基为基础,OD600值为评价指标,选择培养温度(20、30、37、45、50℃)、初始 pH 值(4.0、5.0、6.0、7.0、8.0、9.0、10.0)、接种比例(1%、2%、3%、4%、5%)和装液量(50 mL、100 mL、150 mL、200 mL培养基于250 mL三角瓶中)进行发酵条件优化。
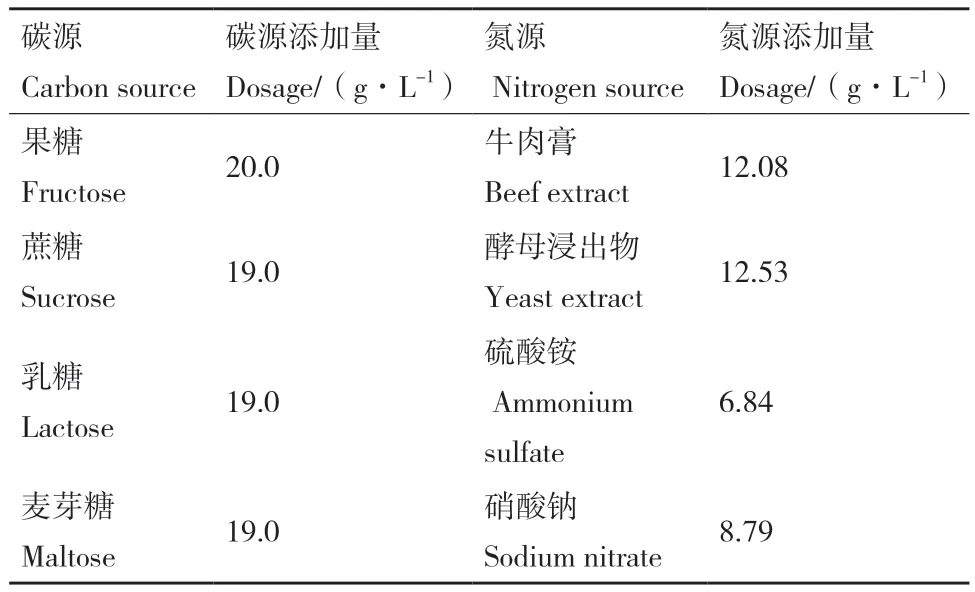
表1 碳氮源的类型及添加量Table 1 Type and dosage of carbon sources and nitrogen sources

表2 碳氮源的正交试验表Table 2 Orthogonal experiment for carbon sources and nitrogen sources
以单因子优化的最佳培养条件为中心点,运用Design Expert 8.0软件,针对温度、pH值、接种比和装液量使用中值组合重新编码,以菌体生长量为响应值,设计4因素3水平的响应面实验(表3)。实验均设置3个重复。运用回归分析对拟合得到的方程和各因子进行方差分析,并对模型可靠性进行分析,预测优化结果,并在预测的最优条件下进行验证。
1.2.4 混菌发酵菌液的盆栽实验及促生效应评价 按优化的混菌发酵体系制备PGPR复合菌液,混合菌液为4株菌培养液等比例混合;菌液离心后收集菌体,以无菌水重悬、调节OD600值为1.0备用。
以遵辣9号为实验材料,选择12-13 cm高的辣椒幼苗移栽至装有300 g土壤的实验盆中,每盆种植1株;移栽7 d后分别以复合菌液和单菌混合菌液进行灌根,每隔2 d一次,每株5 mL。以无菌水为对照组(CK),共3个处理组,每个处理设置5个重复。以第1次灌根为起始时间,30 d后测定幼苗的株高、鲜重、根重和叶绿素。
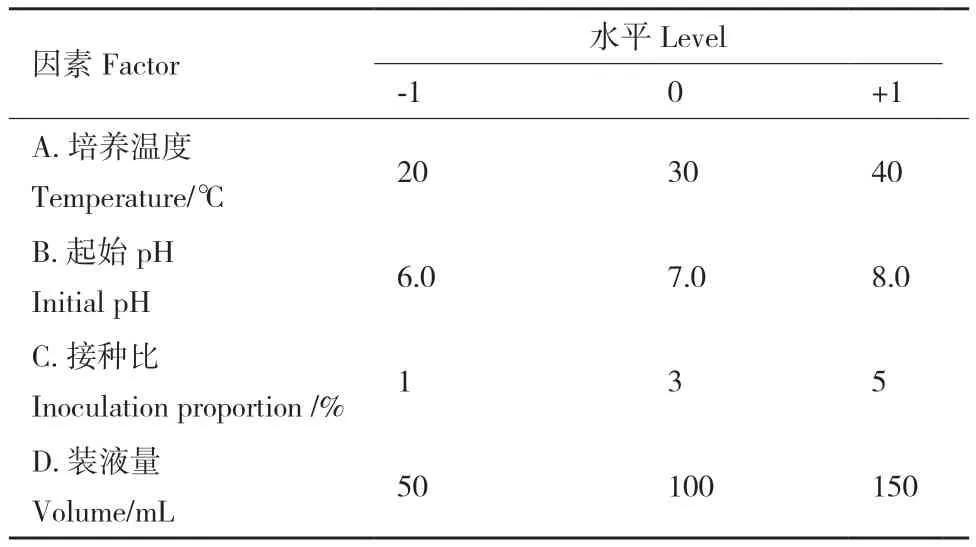
表3 响应面法设计的因素与水平表Table 3 Factors and levels designed by response-surface methodology
1.2.5 实验设计及统计分析 正交实验及数据分析利用SPSS20.0进行,响应曲面法根据Box- Benhnken中心组合设计方案,以Design-Expert 8.0.6进行分析。
2 结果
2.1 混菌发酵体系中4株PGPR菌株的接种顺序确定
从4株菌的生长曲线可以看出(图1),P.putida HGD3和B. flexus HGD12进入对数生长期的时间均约为3 h,B. velezensis HP9进入对数生长期的时间约为5 h,B. cepacia P10进入对数生长期的时间约为10 h。由此可知,混菌发酵体系的接种顺序为首先接种P10,间隔5 h后接种HP9,再间隔2 h后同时接种HGD3和HGD12。
2.2 单因素实验筛选碳、氮源及碳氮比
实验通过不同碳源、氮源和碳氮比的基础培养基进行混菌发酵,以OD600值作为评价指标(图2)。结果发现,复合菌的生长量随碳源的不同变化较大,以蔗糖为碳源时,复合菌的生长最好,果糖作为碳源时的生长量最低。氮源对其生长影响更显著,蛋白胨、牛肉膏、酵母浸出物等有机氮源有利于复合菌的发酵,以硫酸铵为氮源时尤不利于复合菌的生长。不同碳氮比对复合菌生长的影响表明20∶1时的生长弱于其余3个设定比例。
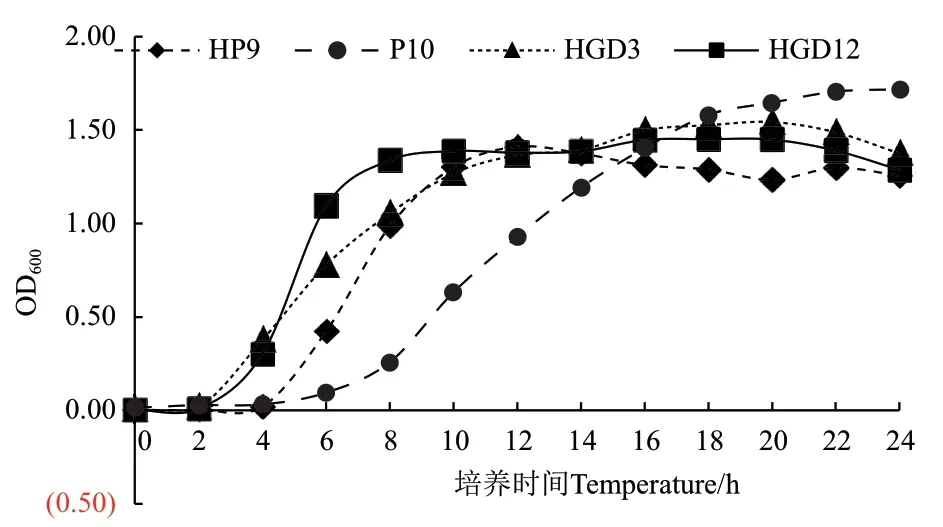
图1 四株PGPR菌株在基础培养基中的生长曲线Fig.1 Growth curves of four PGPR strains in basal medium
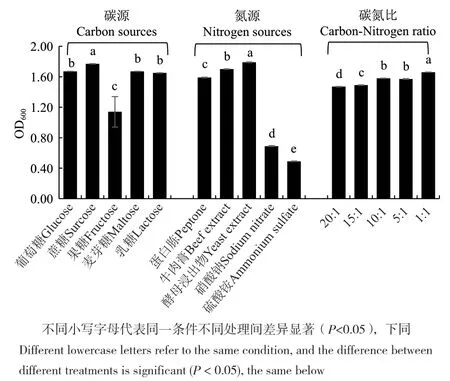
图2 不同碳、氮源及碳氮比对复合菌生长影响的单因素研究Fig.2 Single level studying of effect on the growth of compound agent under the conditions of different carbon, nitrogen sources and ratio
2.3 正交试验优化培养基成分
根据单因素实验结果,弃去果糖、硝酸钠和20∶1等3个值后,对碳源、氮源及碳氮比设计3因素4水平的正交试验。从优化结果(表4)和方差分析(表5)可以看出,3个因素对复合菌发酵影响最大的是氮源(B),其次是碳源(A),碳氮比(C)的影响最小;最佳的培养基组合为A2B3C2。综上可知,混菌发酵的最优培养基组成为:蔗糖18.65 g,酵母浸出物12.53 g,Na2HPO44.0 g,NaH2PO42.0 g,MgSO40.5 g,CaCl20.2 g,蒸馏水1 000 mL。进一步对最优培养基配方进行验证,结果显示复合菌在最优培养基中混菌发酵24 h的OD600值为1.805,相较于基础培养基提高约10%。
2.4 单因子实验考察发酵条件
环境条件对菌株的生长影响显著。由图3可知,温度对复合菌的发酵具有一定的影响。30℃时对复合菌液的发酵最优,45℃时的生长好于20℃,表现出复合菌液具有一定的耐热性;但50℃时,复合菌不能生长。pH值的影响结果显示,复合菌在pH4.0的培养基中无法生长,当pH值由5.0升高至7.0,复合菌的生长量也呈递增关系,起始pH为7.0时最有利于复合菌的发酵;pH 8.0-9.0时,复合菌的生长次之。不同接种比的复合菌发酵液的OD600值差异显著,3%接种比时菌液的生长量达到最高。装液量影响培养基的溶氧量,当装液量为50 mL时,复合菌生长量最大,随着装液体积的增加,发酵液的OD600值逐渐降低。
2.5 响应曲面法优化复合菌发酵条件
2.5.1 响应面模型构建及方差分析 根据Box-Benhnken中心组合设计响应面实验,发现混菌体系的发酵受培养温度、起始pH、接种比和装液量的影响;复合菌在不同实验条件下混合发酵24 h后,各组实验的OD600值均有不同变化(表6)。对实验数据进行拟合后得到的二次回归方程预测模型如下:
Y=1.76+0.03A+0.025B+0.012-0.19D+0.021AB-7.000×10-3AC+0.033AD+4.250×10-3BC+0.021BD+8.0×10-3CD-0.04A2-0.039B2-0.022C2-0.041D2
式中:Y为OD600值,A为温度,B为pH,C为接种比,D为装液量。
对所得回归方程模型进行显著性检验和方差分析(表7),显示实验结果与模型二次回归方程预测模型的失拟值为0.174 5,决定系数R2=99.45%,表明该方程拟合度高,能够很好地预测混菌发酵体系的最适发酵条件。根据F值的大小可以确定,在所选因素水平范围内,4个因素对复合菌的OD600值的影响顺序为:装液量(D)>温度(A)>pH(B)>接种比(C)。
2.5.2 影响复合菌发酵的主要因素分析 响应曲面三维图能够直观地将各因素之间的交互作用对响应值的影响程度呈现出来,根据表6中交互项的两因素对复合菌OD600值的影响绘制响应曲面图(图4)。结合显著性分析结果(表6)及响应曲面图,温度与pH对复合菌的发酵效果影响作用趋势一致,即OD600值随温度和pH的增加均表现为先增加后降低,温度与pH之间的交互作用显著。从温度与接种比的交互响应曲面图可以看出,OD600值随温度的升高而增大,随接种比的增加而增加,温度与接种比之间的交互作用不显著。而温度与装液量的交互影响上,OD600值随温度的增加呈小幅度增加后基本保持
不变,随装液量的增加而降低,温度与装液量这2个因素之间存在显著的交互作用。相应地,pH与接种比之间交互作用不显著,而pH与装液量、接种比与装液量之间交互影响显著。
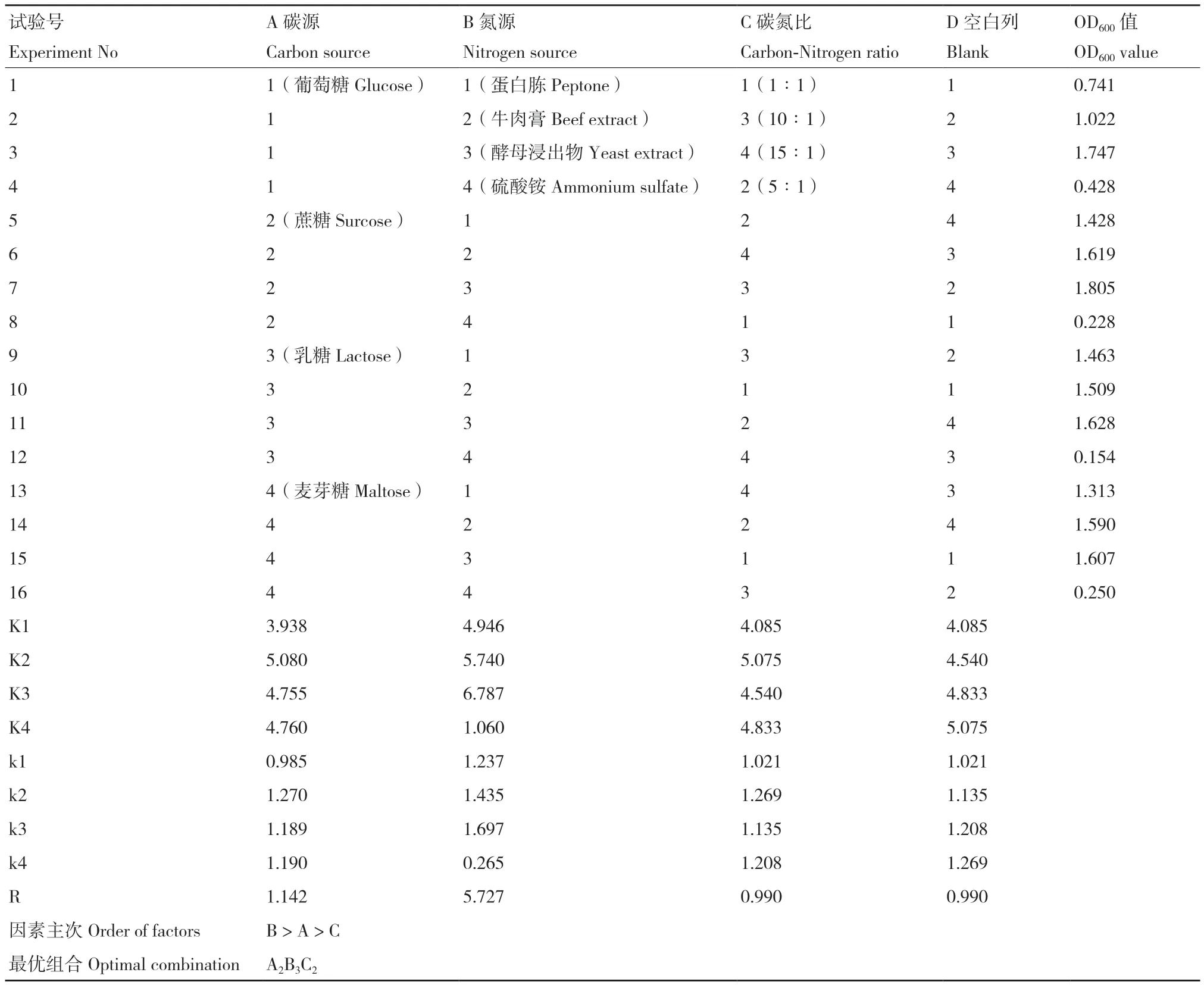
表4 正交试验优化结果Table 4 Optimized results of orthogonal experiment
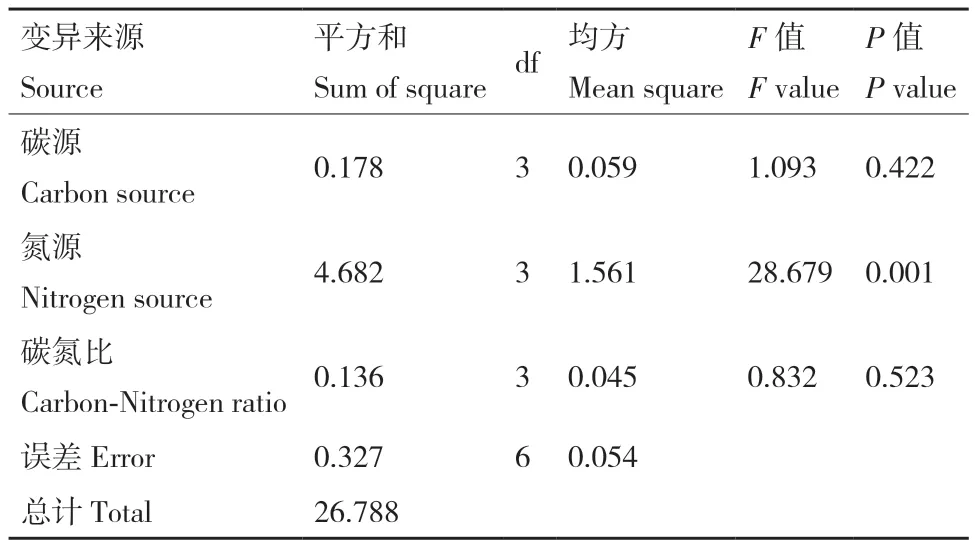
表5 单变量方差分析结果Table 5 ANOVA analysis results of variance
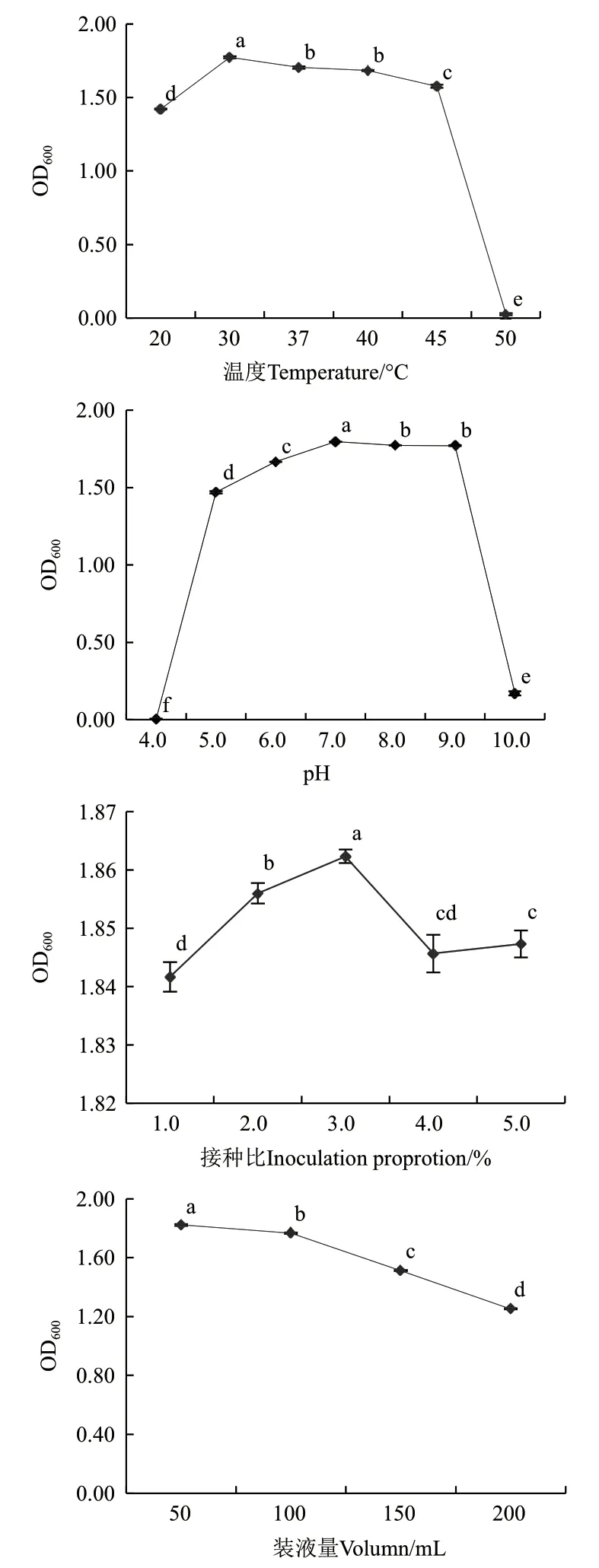
图3 环境因素对混菌体系发酵的影响Fig.3 Effects of environm-ental factors on mixed fermentation

表6 Box-Benhnken中心组合试验设计方案及结果Table 6 Experimental design and results of Box-Benhnken central combination
2.6 最佳条件参数确定及模型验证实验
通过Design-Expert 8.0.6进行优化分析,在选择的因素水平范围内,得到复合菌发酵的最佳条件参数为:当A为-0.030,B为0.045,C为0.097,D为-1.000时,即温度为29.7℃,pH为7.045,接种量为3.19%,装液量为50 mL/250 mL,可得到OD600值最大预测值为1.903。
以优化后所得最佳发酵条件参数进行验证实验,实测OD600值为1.908±0.005,与预测OD600值的偏差为0.35%,说明该模型能够很好地预测复合菌发酵的生长量;OD600值较优化前提高了15.39%,混菌发酵液的活菌数为2.94×1014CFU/mL,而4株单菌混合菌液的活菌数为5.73×1013CFU/mL,混菌发酵的活菌数是优化前单菌混合菌液活菌数的5.13倍。

表7 响应面二次回归预测模型方差分析Table 7 ANOVA analysis of quadratic regression model of response surface
2.7 混菌发酵菌液的促生效应评价
辣椒盆栽实验结果表明,经由4株菌制备的混合菌液和混菌发酵菌液处理后,辣椒的生长均优于对照组,尤以混菌发酵菌液的促生效果更好,根系发育情况更优(图5)。如表8所示,混菌发酵菌液灌根处理辣椒后,幼苗的株高、根重、鲜重及叶绿素含量均显著高于对照组(P<0.05),较后者分别提高了35.55%、179.51%、126.21%和17.26%;相较于单菌混合菌液组分别提高了8.01%、50.22%、43.66%和6.94%。
3 讨论
混菌发酵体系的构建是一个复杂的过程,筛选出最佳的碳源、氮源、碳氮比及适宜的发酵条件是构建复合菌发酵的重要环节[11]。培养条件的优化通常采用正交实验或响应曲面法,大多被应用于微生物酶活性的提高、分泌抗生素或抗菌蛋白等有益产物等方面[12-15],而在根际促生菌的培养条件优化方面研究较少[16]。有报道利用响应面法对红树林植物促生菌SZ7-1菌株的发酵培养基优化后,活菌数较优化前提高了12.4倍[17];经响应面法、正交实验优化烟草根际分离菌株的发酵条件,均明显提高了IAA产量[18-19]。王呈玉等[20]以高效玉米根际溶磷菌阿氏芽胞杆菌(B. aryabhattai)XF1和巨大芽胞杆菌(B. megaterium)XS2混合培养的菌株进行固态发酵基质和发酵工艺的优化,培养4 d的活菌数达2.56×1010CFU/g;利用制备的菌剂进行玉米拌种施用,并同时减施35%的化学磷肥,结果显示产量与常规施肥处理相当。显然,培养条件的优化对于促生菌菌数的增加或促生特性的提高仍是一条有用的途径。本研究中,通过4株PGPR菌株生长曲线的测定,根据菌株进入对数期的时间确定了接种顺序,以单因素和正交实验优化了培养基成分,继而利用单因素和响应曲面法对发酵条件进行优化,以此构建了混菌发酵体系;验证试验表明,利用混菌发酵体系获得的复合菌,其活菌数为2.94×1014CFU/mL,是单菌混合菌液的5.13倍,在相同的发酵时间内获得了更大的活菌数量,无疑可以节约时间、减少繁琐程度,并大大降低生产成本。
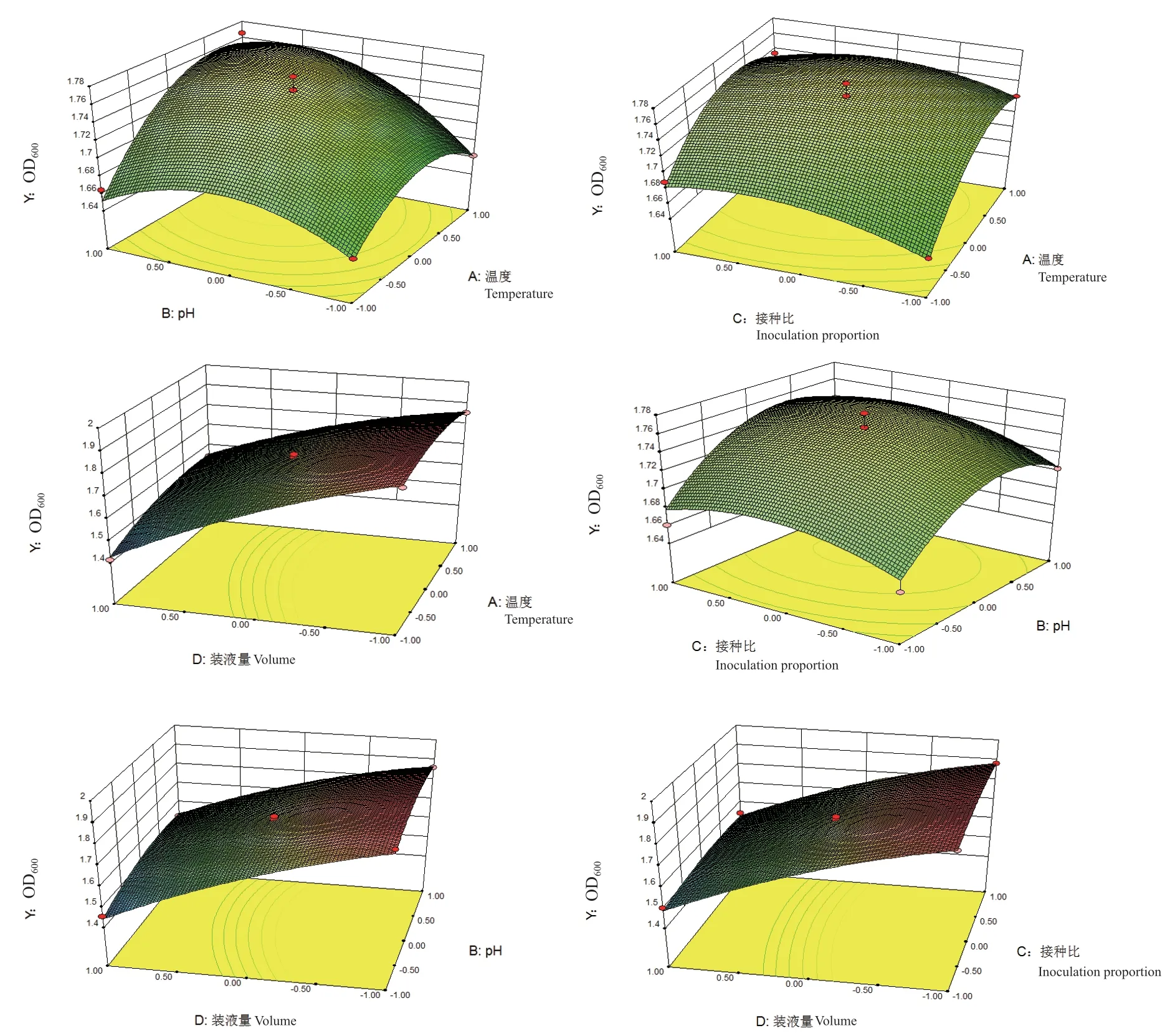
图4 各因素交互作用的响应面曲线图Fig. 4 Response surface curve of interactions among factors

图5 混菌发酵及单菌混合菌液对辣椒幼苗生长的影响Fig.5 Effects of mixed fermentation culture and single fermentation culture on the growth of pepper seedlings
随着社会对发展生态农业的重视及可持续发展意识的增强,使得以PGPR制成的新型生物菌剂部分或逐步取代化肥成为一种可能性。目前,对于微生物菌肥的研究应用已经有向多菌复合发展的趋势[21]。邓振山等[22]利用从不同植物根及根际土壤中筛选到的多株促生菌对玉米进行混接,发现多菌优于单菌接种。以胶质类芽胞杆菌(Paenibacillus mucilaginosus)3016和慢生根瘤菌(Bradyrhizobium japonicum)5136进行双接种,与单菌株接种相比,可显著增加大豆的单株分枝数、粒数、收获指数和占瘤率,降低单株空荚数,增加大豆产量[23]。利用根瘤菌和芽胞杆菌的双接种试验也增加了菜豆的结瘤和苗干重[24]。Egamberdieva 等[25]的研究还表明,利用慢生根瘤菌和恶臭假单胞菌进行双接种,还通过改变根系构型显著提高了盐胁迫下大豆植株的营养元素水平。但是,利用复合菌剂进行辣椒促生的研究报道很少,且复合接种多见于根瘤菌和其他不同种菌株的配合。Madhaiyan等[26]利用具不同促生特性的米亚甲基杆菌(Methylobacterium oryzae)与巴西固氮螺菌(Azospirillum brasilense)或吡咯伯克霍尔德氏菌(B. pyrrocinia)分别构建的双菌株复合菌剂接种辣椒,较甲基杆菌菌株单接种而言,幼苗茎长分别增长了3.66%和3.82%,根长也略有增加;较对照的茎长分别增长8.33%和8.49%,较根长分别增加30.70%和21.00%。本项目在前期研究中,分别利用HGD3、HGD12、P10及HP9进行单菌株接种及不同组合的等比例混合接种,发现4个菌株等比例混合接种对辣椒幼苗的促生效果最优,且幼苗的株高分别较4个单菌株增长27.69%、20.31%、19.42%和13.91%,根重分别增加39.26%、18.85%、1.79%和28.98%,鲜重分别增加32.60%、30.60%、14.18%和28.03%,表现出极为明显的复合促生效应(未发表资料)。
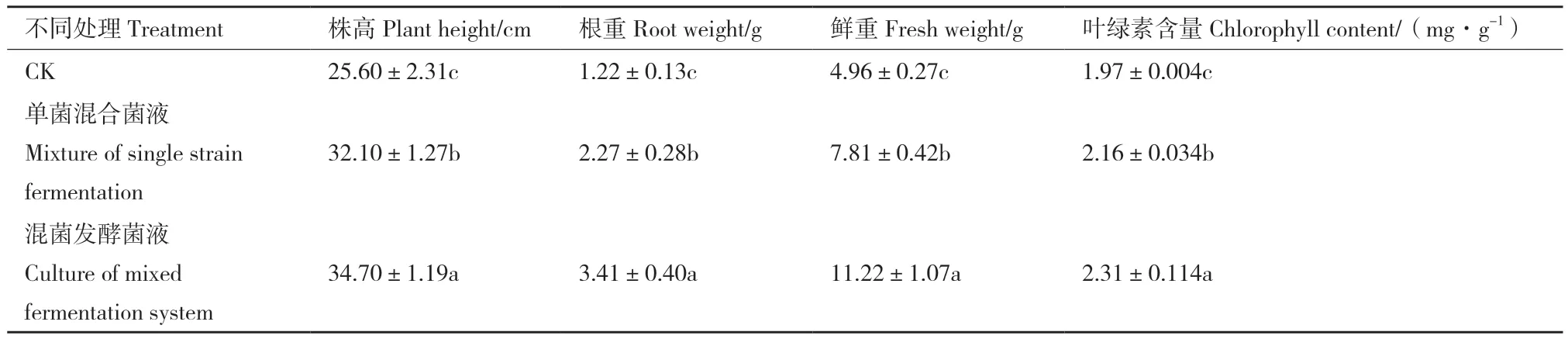
表8 两种不同复合菌剂对辣椒幼苗生长的影响Table 8 Effects of two different compound bacterial agents on the growth of pepper seedlings
微生物复合菌剂可提高单一微生物菌剂在农业中的应用可靠性和有效性,但目前对其构建方法的研究还不够深入,大多根据菌株的不同功能以1∶1的形式构建复合菌剂[27],这可能忽略了不同菌株混合培养时之间的互作。韩梅等的研究就显示互不拮抗的根瘤菌菌株S-2、溶磷菌菌株P-3和硅酸盐细菌K-5的复合培养具有1+1+1>3的溶磷效果,且S-2与P-3组合时的解钾能力也由于单菌株[28]。本研究表明,对4株菌通过构建混菌发酵体系,获得的复合菌液接种辣椒,不仅可显著促进辣椒的生长;且与4株菌株以等比例制备的混合菌液接种相比,辣椒的株高、根长、鲜重及干物质重量分别提高了8.01%、50.22%、43.66%和6.94%,呈现出更显著的促生效应;这也间接证实了4株菌在混合发酵的过程中,其促生特性可能有所提升,但深层的原因仍值得进一步研究。
4 结论
本研究以4株PGPR菌株构建混菌发酵体系,采用单因素实验、结合正交试验及响应曲面法,对培养基和发酵条件进行优化,最终确定的培养基组分为:蔗糖18.65 g,酵母浸出物12.53 g、Na2HPO44.0 g、NaH2PO42.0 g、MgSO40.5 g、CaCl20.2 g、 蒸 馏水1 000 mL。最适发酵条件为:温度29.7℃、初始pH7.045、接种量3.19%、装液量50 mL/250 mL。优化混菌发酵体系获得的活菌数为2.94×1014CFU/mL,是优化前单菌混合菌液活菌数的5.13倍。利用混菌发酵制备的复合菌液灌根接种辣椒后,幼苗的生长指标及叶绿素含量均显著高于单菌混合菌液组。
