内镜窄带成像技术在消化道疾病诊疗中的应用
2021-05-13周金池赵曙光
韩 伟, 周金池, 赵 丽, 张 哲, 魏 延, 赵曙光
空军军医大学唐都医院消化内科,陕西 西安 710032
21世纪以来,随着计算机和图像处理技术的不断进步,多种光学增强(optical enhancement,OE)内镜技术应运而生,主要包括窄带成像技术(narrow-band imaging,NBI)、智能比色分光技术(flexible spectral imaging color enhancement,FICE)、高清智能电子染色(i-Scan)及蓝激光成像(blue laser imaging,BLI)四大类[1],均能够清晰地显示消化道黏膜细微结构,且省时省力、操作简便、安全性更高,已广泛应用于消化道疾病的日常诊疗,其中NBI技术使用最为普遍,通过提高黏膜表面细微结构的显示水平,彰显出其在常见消化道癌前病变和早癌诊治、息肉及溃疡性质判断等方面的突出优势[2]。
1 NBI技术的原理及特点
NBI技术的基本原理是基于消化道黏膜对光的吸收和反射,将窄带滤波器置于传统疝灯光源及红、绿、蓝旋转滤光片之间,过滤掉宽带红光,仅保留(415±30)nm、(540±30)nm范围内的窄带蓝绿光作为照明光来形成NBI图像。由于光波对消化道黏膜的穿透能力与其波长成正比,光波波长越长,穿透深度越深,因此以415 nm为中心的蓝光可穿透黏膜浅层至0.16 mm深度,且恰好对应血红蛋白的主吸收峰谱,可突出显示黏膜表面腺体及微血管结构,而以540 nm为中心的绿光穿透较深,深度可达0.24 mm,可见黏膜深层和黏膜下层的血管结构,故黏膜表面腺体、绒毛等结构及浅层毛细血管以吸收415 nm蓝光为重点,镜下呈褐色,而较深的黏膜下血管在540 nm绿光下可见,镜下呈青色,不需要使用化学染色剂即可清晰地显示黏膜表面腺体结构及微血管形态,极大地提高了黏膜表面对比度,利于黏膜细节的可视化[3-5],在实际诊疗过程中有助于内镜医师确定病变部位和范围,发现黏膜细微变化及异常血管分布情况,进而有助于分析病变的良恶性及具体性质,可以使内镜医师获得更准确的实时光学诊断,并帮助其做出更好的临床决定,特别是与放大内镜技术(magnifying endoscopy,ME)有效结合形成的ME-NBI技术,更加促进了其在内镜下消化道各种病变的实时评估、活检取材指导及后续治疗策略的协助选择等临床诊疗过程中的广泛应用。
2 在常见消化系统疾病诊疗中的应用
2.1 在食管病变中的应用由于食管黏膜表面被覆鳞状上皮,缺乏腺体结构,因而NBI在食管多用于显示上皮乳头内毛细血管襻(intra-epithelial papillary capillary loop,IPCL)。正常IPCL管径细而均一,形状一致,但在发生炎症或肿瘤病变时,IPCL形态发生相应变化,且变化及破坏程度与病变性质及肿瘤浸润深度相关。Inoue将IPCL分为5型:Ⅰ型:即正常IPCL,其形态规则,分布均匀;Ⅱ型: IPCL延长和扩张,常见于炎症;Ⅲ型:IPCL轻度扭曲、扩张,常见于交界性病变或低级别上皮内瘤变,镜下多可见明显的病变区域;Ⅳ型:IPCL明显扩张、扭曲、管径粗细不一,形态多样,以上4种变化多合并出现2~3种,常见于高级别上皮内瘤变或原位癌;Ⅴ型:IPCL变化包括以上所有4个特征,提示病变已经进展为黏膜内或黏膜下癌[6];Dobashi等[7]通过观察并分析食管癌的IPCL,可见其明显扩张,管径粗细不均,排列紊乱,边界清晰,证实联合使用血管扩张和血管形态可作为判断早期食管鳞癌的简化标准(见图1)。因此,NBI内镜通过清晰显示食管IPCL,可准确判断病变黏膜区域,并基于IPCL的变化,帮助医师对病变性质及其严重程度做出初步判断并指导临床活检取材,进而提高病变诊断的准确率。

图1 早期食管癌的NBI及ME-NBI镜下表现Fig 1 NBI and ME-NBI appearances of early esophageal carcinoma
洪润生等[8]研究证实,NBI可准确鉴别糜烂性食管炎及非糜烂性食管炎,提高诊断准确率;Kato等[9]邀请2名内镜专家及非专家分别对248例Barrett食管患者的NBI黏膜结构及微血管结构图片进行观察并做出诊断,结果显示,NBI预测组织学异常的准确率为95%,证实NBI对Barrett食管具有较高的诊断准确性, Sharma等[10]的研究也得到相同的结论;Song等[11]的Mate分析包含了502例Barrett食管患者的3 988个病灶,结果显示:NBI内镜对单一患者诊断灵敏性和特异性分别为0.91(95%CI:0.86~0.94)和0.85(95%CI:0.76~0.92),对单一病灶的灵敏性和特异性分别为0.97(95%CI:0.95~0.98)和0.64(95%CI:0.59~0.68),证实NBI是诊断Barrett食管异常增生的一种准确方法。因此,NBI诊断食管炎及Barrett食管具有一定的优势。
在食管早癌诊断方面,滕晓琨等[12]研究显示,NBI诊断上皮内瘤变的准确率明显优于普通白光内镜,且NBI图像整体清晰度增加,病变部位IPCL结构显示更为清晰,联合应用ME明显提高早期食管癌和癌前病变的检出率;陈思杰等[13]研究发现,NBI对黏膜内癌的诊断准确率为91.1%,对黏膜下癌的诊断准确率为82.5%,总体准确率为86.8%,证实通过NBI观察IPCL形态可预判食管早癌的浸润深度;而Yu等[14]研究显示,ME-NBI内镜对判断食管鳞癌浸润深度的价值,共分析1 033例患者,其中包含207例黏膜下浸润癌,结果显示诊断灵敏性、特异性均为90%以上,说明ME-NBI内镜诊断食管鳞癌和预测浸润深度上均具有较高价值;Morita等[15]系统回顾和荟萃分析1 911例患者,比较NBI与碘染色白光对食管鳞癌的诊断价值,结果显示NBI对单个患者和单个病变诊断灵敏性和特异性分别为88%和94%、88%和65%,而碘染色为92%和98%、82%和37%,NBI诊断特异性明显占优,说明NBI是诊断食管高级别上皮内瘤变和鳞癌的有效辅助技术。
2.2 在胃部病变中的作用胃的不同部位由于腺体形态差异在NBI镜下常表现出不同的特点,胃底体的正常黏膜表现出排列规则整齐的圆形腺管,周围常包绕上皮下毛细血管而呈蜂窝状,而胃窦黏膜腺管成网状或线状,毛细血管多呈卷曲状,黏膜萎缩时,黏膜下血管显示就更为清晰。黏膜发炎时可出现腺管扩张,微血管显著迂曲伸长,小凹上皮呈蓝白色,严重时小凹呈绒毛样或指状突起,而胃黏膜发生肠化时的特征性表现是出现亮蓝冠(light blue crest,LBC),即腺管开口呈浅蓝色脊状改变,镜下呈现亮蓝色的线样反射光。黏膜出现癌变倾向时,常出现不规则的腺管结构和(或)不规则的微血管结构且与正常组织存在明显分界,多表现为腺管结构模糊,微血管结构紊乱、扩张或大量新生血管形成[16]。
NBI能够清晰地显示黏膜浅层毛细血管网和腺体结构,进而增强黏膜的对比性,是发现癌前病变及早期胃癌的一种有效手段。Dutta等[17]分别使用白光内镜及NBI内镜对200例患者中32例存在潜在癌前病变的患者进行观察,结果显示,普通白光内镜检查出17例病变(萎缩性胃炎12例、萎缩性胃炎伴肠化生5例),NBI内镜查出31例(22例、9例),表明NBI内镜对萎缩性胃炎诊断的灵敏性高于白光内镜;Song等[18]发表的一项纳入347例患者的Mate分析结果显示:NBI诊断单个患者肠上皮化生的的灵敏性为0.65,特异性为0.93;单个病变的灵敏性和特异性分别为0.69和0.91,NBI诊断胃黏膜肠上皮化生具有较高的准确性。
在胃癌的诊断方面,Horiuchi等[19]通过观察早期胃癌的表面细微结构,发现NBI模式下癌变区域正常黏膜结构消失,腺管明显扩张,迂曲,排列紊乱,与周围正常黏膜间边界明显,证实NBI可更为准确地识别早期胃癌(见图2);Yoshimizu等[20]研究证实,应用NBI可提高常规内镜下胃癌的检出率;而在胃良恶性病变鉴别方面,Zhou等[21]发表的一项Meta分析显示,ME-NBI内镜对幽门螺旋杆菌根除患者胃癌和非癌性病变的区分灵敏性为88%,特异性为96%,优于白光内镜;且发现根除幽门螺旋杆菌后,由于非肿瘤样黏膜上皮的覆盖使早期胃癌具有胃炎样特征,且往往边界不清,缺乏明显的癌变特征而难以准确诊断,在此情况下,ME-NBI同样能够很好地区分胃早期癌变,表现出良好的诊断准确率[22-24];此外,在胃癌病变细节及范围显示及胃部溃疡的良恶性鉴别方面同样具有明显优势[25-26]。

图2 早期胃癌的白光内镜及NBI内镜下表现
2.3 在十二指肠病变中的应用正常情况下,十二指肠黏膜绒毛在NBI镜下呈指状或叶状,排列整齐规则,但在黏膜萎缩时,绒毛多呈短截状或旋转状,甚至完全缺失,多见于乳糜泻、消化不良等疾病[27];降部壶腹周围的绒毛在NBI镜下可表现三种类型:Ⅰ型:卵形绒毛;Ⅱ型:松果/叶状的绒毛;Ⅲ型:不规则绒毛/ 无绒毛结构,并可见弯曲、扩张或网状等异常血管。Ⅰ型多见于炎症或增生性改变,而腺瘤和腺癌表现为Ⅱ型和(或)Ⅲ型,异常血管仅见于腺癌[28];此外,十二指肠球部也是发生胃黏膜异位或化生的常见部位,多呈结节样隆起性改变,由于胃黏膜上皮在组织形态学上绒毛短钝呈球状,NBI内镜下与正常十二指肠黏膜往往具有清晰界限,且可见胃黏膜上皮及胃小凹结构[29]。
Goswami等[30]研究发现,NBI-ME内镜诊断功能性消化不良患者十二指肠局部绒毛形态改变的灵敏性为95%,特异性为90.2%,证实NBI-ME内镜对不同类型的绒毛形态均具有良好的诊断性能;而Singh等[31]使用NBI内镜观察十二指肠绒毛形态时发现其正确识别有无绒毛萎缩的灵敏性和特异性分别为93.3%和97.8%,鉴别部分绒毛萎缩和全部绒毛萎缩的灵敏性和特异性分别为83.3%和100%,与Goswami等[30]研究结论一致;Luca等[32]也证实NBI内镜较白光内镜更能可靠预测脂肪泻患者十二指肠局部绒毛的变化;十二指肠球部胃黏膜异位及化生比较常见,李杨等[33]探索性研究发现,应用内镜NBI技术可初步鉴别十二指肠胃上皮化生和胃黏膜异位,具体应用效果仍需进一步研究。
活检对非壶腹部十二指肠腺癌的诊断准确性较低,且活检可诱导上皮性肿瘤病变处发生黏膜下纤维化,增加内镜下切除治疗的难度和手术并发症[34],因此急需探索十二指肠局部病变的新型内镜诊断方法。Yamasaki等[35]使用ME-NBI内镜评估114个病变的内镜图像(70个非壶腹部十二指肠上皮性肿瘤性病变和44个非肿瘤性病变),发现联合使用ME-NBI诊断十二指肠非壶腹部上皮性肿瘤和非肿瘤的灵敏性和特异性分别为96%和95%,证实ME-NBI在十二指肠降部及水平部肿瘤性病变诊断方面具有极大的临床应用价值;对于壶腹部隆起性病变的诊断,Park等[36]发现,NBI内镜下不规则绒毛排列和/或微血管结构异常对壶腹肿瘤的鉴别诊断有重要意义,且NBI可提高白光成像对壶腹部病变的准确诊断。此外,Kim等[37]曾报道使用NBI观察1例罕见的十二指肠含铁血黄色沉着症者,发现在ME-NBI下绒毛的微表面结构更为清晰,边缘可见淡蓝色的嵴,绒毛内的微血管结构消失,但绒毛上皮下可见大量深红棕色色素沉着。
2.4 在结肠病变中的应用NBI在结肠多用于息肉的良恶性判断、结肠癌的早期诊断、炎症性肠病、相关癌变的识别等方面。息肉在组织学上分为非腺瘤性息肉(炎性息肉和増生性息肉)和腺瘤性息肉(管状腺瘤、绒毛状腺瘤和绒毛管状腺瘤等),多表现为黏膜光滑的有蒂或无蒂的乳头状突起。Kudo根据内镜下息肉表面腺管开口类型将其分为5种类型。Ⅰ型:圆形;Ⅱ型:乳头状或星状;Ⅲ 型:分为两个亚型,ⅢL:管状或圆形,腺管开口较大,ⅢS:管状或圆形,腺管开口较小;Ⅳ型:沟回状或分支状;Ⅴ型:腺管开口消失。其中Ⅰ型和Ⅱ型多见于非肿瘤性上皮,即正常、炎症或增生性息肉,而ⅢL型和Ⅳ型为隆起性腺瘤性息肉,ⅢS型和Ⅴ型多见于结肠癌或早癌病变,其中腺瘤性息肉及增生性息肉NBI镜下表现如图3所示[38-39];息肉表面微血管结构采用Kudo分型,主要有以下三类:表面微血管不明显(Ⅴ1型),口径和排列均匀的表面微血管清晰可见(Ⅴ2型),口径或排列不均匀的表面微血管扩张(Ⅴ3型),Ⅴ1型主要见于非瘤变或正常黏膜,Ⅴ2型见于发生上皮内瘤变的黏膜,而Ⅴ3型主要对应侵袭性癌[40];除息肉可利用NBI进行分型外,结直肠早癌根据其在NBI镜下的黏膜表面腺体及血管的形态也相继出现了广岛(hiroshima)、佐野(sano)、昭和(showa)、慈惠(jikei)、NICE、JECT等多种分型,其中NICE分型最为权威,主要根据病变色泽、腺体及血管结构分为三型:Ⅰ型:色泽正常,表面腺体均匀一致,缺乏血管结构,多见于增生性病灶;Ⅱ型:呈褐色,表面腺体呈卵圆形、管状或分枝状,多由增粗的褐色血管环绕,多见于腺瘤性改变;Ⅲ型:呈深褐色或棕色,表面腺体扭曲或消失,血管消失或部分区域呈明显扭曲状,多见于黏膜深层浸润癌[41-42]。NBI镜下结直肠病变显示更加清晰,参考各型特点可初步判断病变性质,并可提高活检取材的准确性,总体提高结直肠病变的诊断准确率。
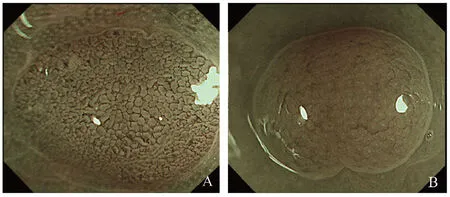
图3 腺瘤性息肉及增生性息肉的NBI镜下表现
在息肉性质判断方面,徐娟等[43]利用ME-NBI内镜观察结肠息肉腺管开口类型及微血管形态并探讨其与肿瘤性息肉之间的关系,结果显示NBI内镜对肿瘤性息肉的诊断符合率、灵敏性及特异性分别为91.16%、88.37%、95.08%,显著优于普通肠镜(80.27%、79.07%、81.97%),且对上皮内瘤变及早癌的诊断准确率也显著高于普通内镜,表明ME-NBI可提高结肠肿瘤性息肉的诊断率;Atkinson等[44]收集了11个关于NBI和白光内镜下结肠腺瘤性息肉检出率的随机对照试验进行Meta分析,结果显示NBI内镜对非腺瘤性息肉和平坦型息肉的检出率优势明显;而Viovan等[45]比较NBI内镜和普通内镜对结肠息肉的检出率,发现NBI组息肉和腺瘤检出率分别为55.3%和35.3%,均高于普通内镜组(43.3%和20%),且NBI组检出大量扁平腺瘤(28vs9),显示NBI内镜在结肠息肉检出及性质判断方面的明显优势;Chino等[46]也证实,ME-NBI对结直肠癌合并无柄锯齿状腺瘤/息肉的诊断价值较高。而在结直肠癌的诊断方面,韩益德等[47]证实NBI技术不仅提高图像清晰度,并且在诊断早期大肠癌的准确性、灵敏性及特异性方面具有优势,并对指导治疗有一定的临床价值;Maeyama等[48]研究发现,借助NBI镜下细微结构变化可预测肿瘤浸润深度和分级,有助于结直肠癌的诊断和治疗策略制定。
在溃疡性结肠炎(ulcerative colitis,UC)及其相关瘤变诊断方面,NBI技术同样具有独特的优势。张晓丹等[49]发现,ME-NBI内镜显示,UC病变轮廓、微血管形态更加清晰,且操作转换简单快捷,可作为初步鉴别UC肠道病变是否为肿瘤性病变的重要手段;Bisschops等比较常规染色内镜及NBI内镜对UC相关瘤变检出率,结果虽然显示二者并无明显差异,但NBI内镜检查用时明显短于染色内镜,仍具有明显的临床应用优势[50];新生血管是UC发病机制中一个重要的潜在组成部分,黏膜炎症过程中产生的血管内皮生成因子具有调节黏膜免疫、促炎和驱动血管生成的重要作用。Guo等[51]使用NBI内镜对UC患者黏膜血管类型及血管再生进行观察,发现NBI可评估UC患者黏膜血管类型并判定黏膜炎症和血管生成活动的严重程度,帮助预测UC的后续临床进程;孟祥坤等[52]也证实ME-NBI内镜对诊断轻、中度活动期UC具有更高的准确性,提示ME-NBI内镜是诊断UC活动度的一种准确可靠的检查方法。
3 总结和展望
NBI内镜能够更加清晰显示消化道黏膜表面腺体结构和微血管形态,为临床诊疗提供更多依据,但NBI内镜在胃、十二指肠部位成像较暗,如何克服仍需进一步的研究;目前人工智能诊断技术在皮肤癌、肝癌、肺癌等疾病诊疗中的优良价值已被证实[53],但在消化系统恶性肿瘤及息肉良恶性判断方面仍仅限于静态图像或视频分析,如何实现人工智能技术与实时内镜检查和评估的有机结合,降低甚至消除内镜医师主观误判带来的漏诊和误诊,提高微小病变的识别和诊断效率,仍需大量的研究,相信随着科技的不断进步,NBI内镜的应用前景将更加光明。
