miR-34a-5p对KSHV感染的神经细胞增殖和迁移能力的影响
2021-05-13吴淑媛曹冬冬李冬梅张晓艳徐慧玲李英潘泽民李冬妹
吴淑媛,曹冬冬,李冬梅,张晓艳,徐慧玲,李英,潘泽民,李冬妹*
(1 石河子大学医学院生物化学教研室/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002;2 新疆生产建设兵团第八师石河子市妇幼保健院,新疆 石河子 832000)
卡波氏肉瘤相关疱疹病毒(Kaposi's sarcoma-associated herpesvirus,KSHV),又称人类疱疹病毒8型(Human herpes virus,HHV-8),流行病学研究证实该病毒是卡波氏肉瘤(Kaposi's sarcoma,KS)、原发性渗出性淋巴瘤(Primary effusion lymphoma,PEL)及多中心卡斯特曼病(Multicentric castleman disease,MCD)的病原体[1]。自发现以来,人们对KSHV的致病性及其分子机制的研究已取得较大进展。
KSHV感染的生命周期包含两个阶段,一为短暂的裂解复制,二为持续的潜伏感染。在裂解复制期大量宿主细胞溶解、死亡,而潜伏感染则引起宿主细胞转化和肿瘤形成,这两种感染方式存在反馈性调节并且可以相互转化。目前已知KSHV感染的细胞类型为上皮细胞、B细胞、巨噬细胞和内皮细胞,且KSHV阳性细胞绝大部分处于潜伏感染状态,需要诱导进入裂解态。我们课题组在前期研究中,证实了KSHV可以感染神经细胞,并同时表达潜伏和裂解态的病毒基因[2]。
MicroRNAs(miRNAs)是长度约22个核苷酸的内源性单链非编码小RNA,可通过结合mRNA 的3'UTR区调控基因的表达[3]。在本研究中为寻找KSHV感染神经细胞中差异表达的miRNA,我们采用KSHV感染与未感染的神经细胞SH-SY5Y进行了转录组测序,并结合前期研究发现的c-fos在KSHV感染的神经细胞中表达上调,且促进病毒基因表达的过程[4],在测序结果中分析与c-fos表达调控相关并能够影响KSHV感染神经细胞的生命特征的miRNA,检测了miR-34a-5p在KSHV感染的神经细胞中的表达,以及对增殖、迁移和c-fos的调控作用。
1 材料与方法
1.1 试剂与仪器
高糖DMEM 培养基、嘌呤霉素、BI血清、胰蛋白酶、双抗(青霉素-链霉素)均购于美国Gibco公司;脂质体Lip2000购于美国 Invitrogen公司;20×PBS购于上海生工公司;DMSO、MTT均购于中国Solarbio公司;miR-34a-5p mimics、miR-NC、pmirGLO-c-fos-wt、pmirGLO-c-fos-mut购于上海吉玛公司;Trizol试剂购于上海ambion公司;Prime Script RT reagent Kit with gDNA Eraser逆转录试剂盒购于中国TakaRa公司;Transwell小室购于美国Corning公司;双荧光素酶试剂盒购自美国Promega公司;鼠抗人c-fos购于中国博奥森公司;山羊抗鼠IgG 购于北京中杉金桥公司。酶标仪购自美国Bio-Rad生物工程公司;PCR仪购自美国Eppendorf公司;高速冷冻离心机和CO2恒温培养箱购自美国Thermofisher公司。
1.2 方法
1.2.1 细胞培养
于液氮冻存的细胞复苏后,将SH-SY5Y细胞培养于含10%胎牛血清、1%青链霉素的DMEM细胞培养基中,SK-RG细胞培养于含10%胎牛血清、1%青链霉素、6 μg·mL-1嘌呤霉素的DMEM细胞培养基中,并置于37 ℃、5% CO2培养箱中培养。当细胞密度达到80%进行换液及传代处理,传代至少3次后进行后续实验。
1.2.2 miRNA转录组测序
提取SK-RG和SH-SY5Y细胞的RNA,于深圳华大生物公司进行转录组测序,每个细胞3个重复样品,将测序原始数据进行过滤后,比对高质量数据,并将数据整合,筛选并分析差异表达的miRNA。在KSHV感染的神经细胞表达下调的miRNA数据集合中,使用RNAhybrid、miRanda、TargetScan 3种软件预测其中可调控c-fos的miRNA,取交集,同时结合文献报道,最终选择fold change值高,统计学意义强的miR-34a-5p开展后续研究。
1.2.3 qRT-PCR检测
常规培养SH-SY5Y、SK-RG细胞于60 mm培养皿中。待细胞密度达到80%左右,采用 Trizol 试剂提取细胞总RNA,检测RNA浓度及纯度,按照日本TaKaRa公司的Prime Script RT reagent Kit with gDNA Eraser 逆转录试剂盒说明书计算RNA加样量,合成cDNA。
获得的cDNA 再进行RT-PCR反应。反应条件为:95 ℃,30 s;95 ℃,10 s;60 ℃,20 s;70 ℃,10 s,共40个循环。引物序列见表1。
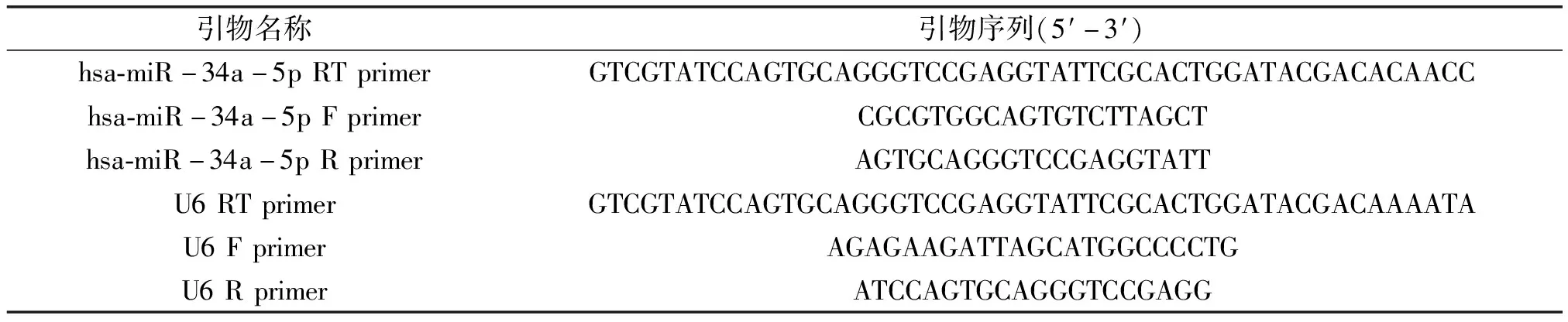
表1 引物序列
1.2.4 细胞转染
取对数生长期的SK-RG细胞铺板,16~24 h内使用 Lipofectamine2000 转染试剂分别将A液100 μL DMEM 加入2.5 μL的miR-34a-5p mimics,B液100 μL DMEM中加入2.5 μL的miR-NC,C液100 μL DMEM 加入3.5 μL的lip2000,静置5 min后,将C液分别加入到A、B中混匀,静置20 min。弃去6孔板中的培养基,用1×PBS洗两遍,加入1 mL DMEM,将混合液梅花样点入细胞中,4~6 h进行换液,继续培养后进行后续实验。
1.2.5 MTT实验
将转染miR-34a-5p mimics、miR-NC的SK-RG细胞培养24 h,用胰酶消化后进行离心,1 000 r·min-1,5 min。用1 mL培养基进行重悬并对细胞进行计数。按照每孔1×103个细胞数接种于96 孔板,每孔总液量为100 μL,每组设置4个复孔进行培养(边缘用1×PBS填充),分别在24、48、72、96、120 h检测细胞增殖情况。在第24 h每孔加入20 μL MTT溶液。继续培养4 h后,加入150 μL DMSO振荡15 min,酶标仪检测490 nm处的吸光度值。
1.2.6 平板克隆形成实验
对数生长期的转染细胞,用胰酶消化后进行离心。取1 mL培养基进行重悬,每孔300个细胞接种于6孔板中,每孔再加入2 mL的培养液,轻轻晃动使细胞分散均匀,继续培养12 d,每隔3~4 d换液,当出现肉眼可见的克隆时终止培养。
弃去培养液,用1×PBS清洗两遍,加入4%多聚甲醛固定40 min,0.1%结晶紫进行染色,30 min后1×PBS再次清洗两遍。将培养板置于室温晾干,在倒置显微镜下进行观察,计数每组细胞克隆形成数。
1.2.7 细胞划痕实验
将细胞铺于细胞培养皿中,转染,将转染后的各组细胞培养24 h后,待细胞密度达到90%左右,用1 mL灭菌枪头比着直尺,垂直于背后的横线划痕。用1×PBS洗涤两次,加入2%血清培养基继续培养,分别在0、12、36 h拍照并标记拍照位置。
1.2.8 Transwell 迁移实验
消化转染24 h后的细胞,加入1 mL 1×PBS 和DMEM洗涤,用DMEM重悬并计数,使细胞密度达到3×105mL,向上室加入200 μL细胞悬液,下室加入600 μL含10% FBS培养基。在显微镜下观察上、下室之间没有气泡产生,放入37 ℃,5%的培养箱中培养36 h后取出。吸去上、下室培养液,1×PBS清洗2遍,用棉棒在上室中轻轻转动,吸干水分并擦去膜内侧的细胞。下室加入1 mL的4%多聚甲醛固定40 min,用棉签擦拭上室内部。弃去下室液体,并加入0.1%结晶紫进行染色30 min,回收结晶紫,用流水缓缓冲去染液,再次用棉棒在上室中轻轻转动,吸干上室水分。倒置显微镜上放置载玻片,将小室放在上面进行拍照。
1.2.9 双荧光素酶报告基因实验
采用生物信息学软件TargetScan数据库分析miR-34a-5p 与c-fos 基因3'UTR区结合位点,构建野生型和突变型c-fos 3'UTR区质粒载体(pmirGLO-c-fos-wt、pmirGLO-c-fos-mut)。单独转染miR-34a-5p mimics和miR-NC于293T细胞中,鉴定转染效率并确定最佳转染剂量。之后将pmirGLO-c-fos-wt、pmirGLO-c-fos-mut分别与最佳剂量的miR-34a-5p mimics、miR-NC共转染293T细胞,标记为miRNA-NC+c-fos 3'UTR-wt组、miRNA-34a-5p+c-fos 3'UTR-wt组、miRNA-NC+c-fos 3'UTR-mut组和miRNA-34a-5p+c-fos 3'UTR-mut组。置于37 ℃培养箱继续培养24 h,收集并裂解细胞,使用双荧光素酶报告基因分析,以海肾荧光素酶活性为内参,计算荧光素酶的相对活性。
1.2.10 Western blot检测 c-fos的表达
转染miR-34a-5p mimics和miR-NC后48 h,弃去原培养基,加入1×PBS洗两遍,每孔加入200 μL细胞裂解液(RIPA:PMSF=100∶1),冰上静置30 min,用细胞刮将细胞刮下,12 000 r·min-1,20 min离心后收集上清液,对蛋白浓度进行测量后,加入1/4蛋白样品体积的5×loading buffer 100 ℃,10 min 进行煮沸。计算上样量,上样至浓缩胶孔中,80 V恒压30 min后调至110 V,60 min。蛋白质经过SDS-PAGE分离,然后转移至PVDF膜,60 min后取出PVDF膜放入含5%脱脂奶粉的TBST溶液中,封闭处理120 min。加入一抗(GAPDH、c-fos稀释比1∶1 000),4 ℃孵育过夜后洗膜,110 r·min-110 min,洗3次。加入二抗(稀释比1∶10 000)37 ℃孵育120 min,再次洗膜。经发光剂显影后,采用凝胶成像系统进行成像分析,并拍照。
1.3 统计学方法
本研究实验结果均重复3次,实验数据用Prism5.0 统计软件进行统计学分析,采用配对样本t检验。检验水准 α=0.05,P<0.05表示差异具有统计学意义。
2 结果
2.1 转录组测序及生物信息学筛选差异表达miRNA
在感染和未感染KSHV的神经细胞中进行转录组测序,筛选出差异表达的miRNA,其中表达上调的miRNA共有1462条,表达下调的miRNA共有152条(图1)。
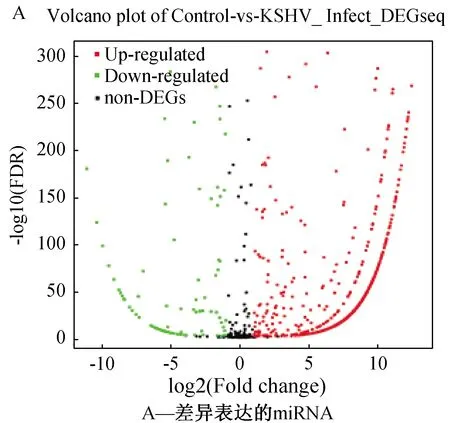
图1 转录组测序筛选差异表达的miRNA
进一步分析miRNA和mRNA表达谱关联性。在表达下调的miRNA中,采用RNAhybrid、miRanda、TargetScan 3种软件预测其中调控c-fos的miRNA,取交集,发现miR-34a-5p可能调控c-fos基因的表达(图2)。
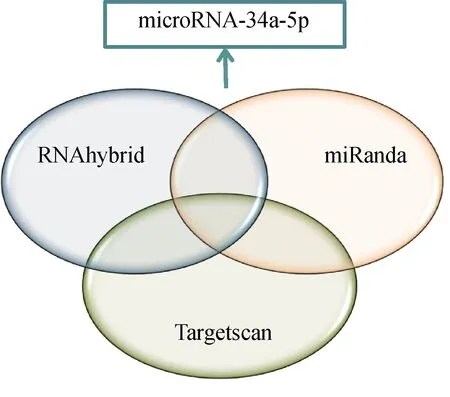
图2 差异表达miRNA中靶向调控c-fos基因的预测
2.2 验证miR-34a-5p在SK-RG中的表达
qRT-PCR检测结果显示,与未感染KSHV的神经细胞SH-SY5Y相比,miR-34a-5p在SK-RG细胞中表达下调,且差异具有统计学意义(P=0.000 7,N=3,图3)。
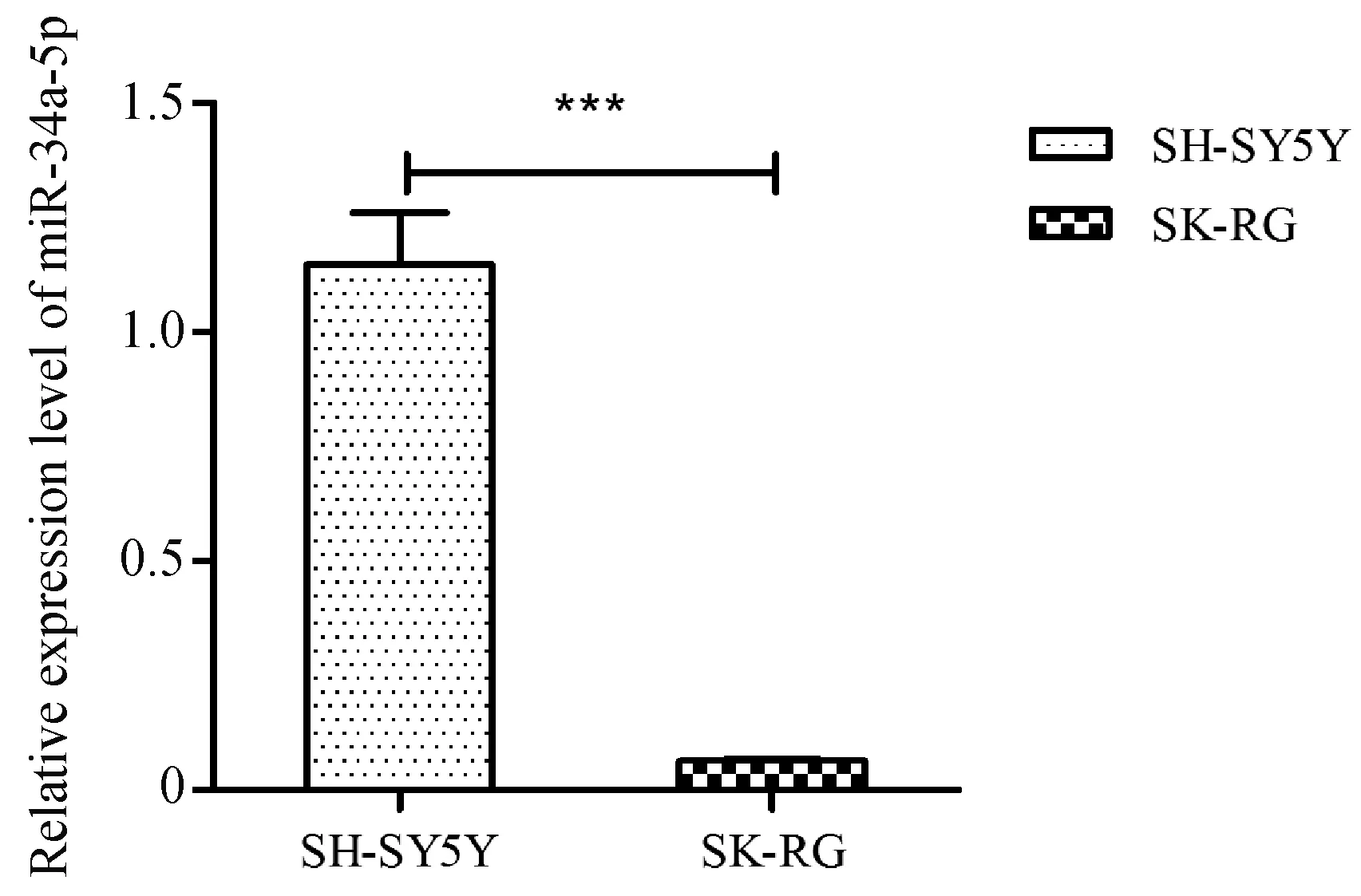
图3 qRT-PCR检测miR-34a-5p水平
2.3 MTT实验检测miR-34a-5p 对SK-RG细胞增殖能力的影响
MTT检测发现,接种细胞48 h后,miR-34-5p组细胞的增殖活力开始低于miR-NC组,且随着时间的推移,差异愈加明显,在96小时开始差异具有统计学意义P<0.001,N=3(图4)。
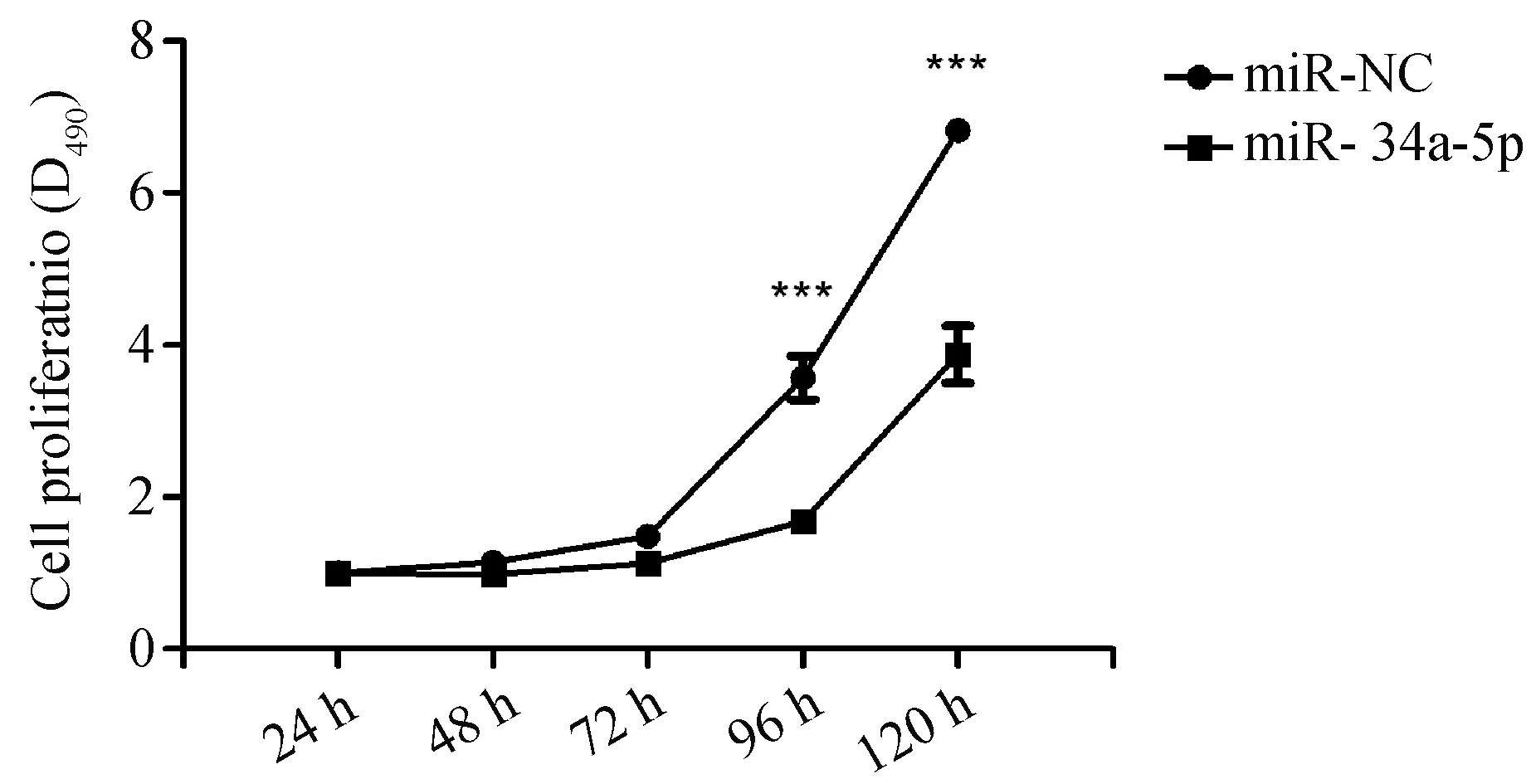
图4 MTT法检测细胞增殖能力
2.4 平板克隆实验检测miR-34a-5p对SK-RG细胞增殖能力的影响
平板克隆实验结果显示miR-34-5p组细胞集落数少于miR-NC组。此实验进一步证实了miR-34-5p能够抑制SK-RG细胞的增殖能力P<0.0001,N=3(图5)。
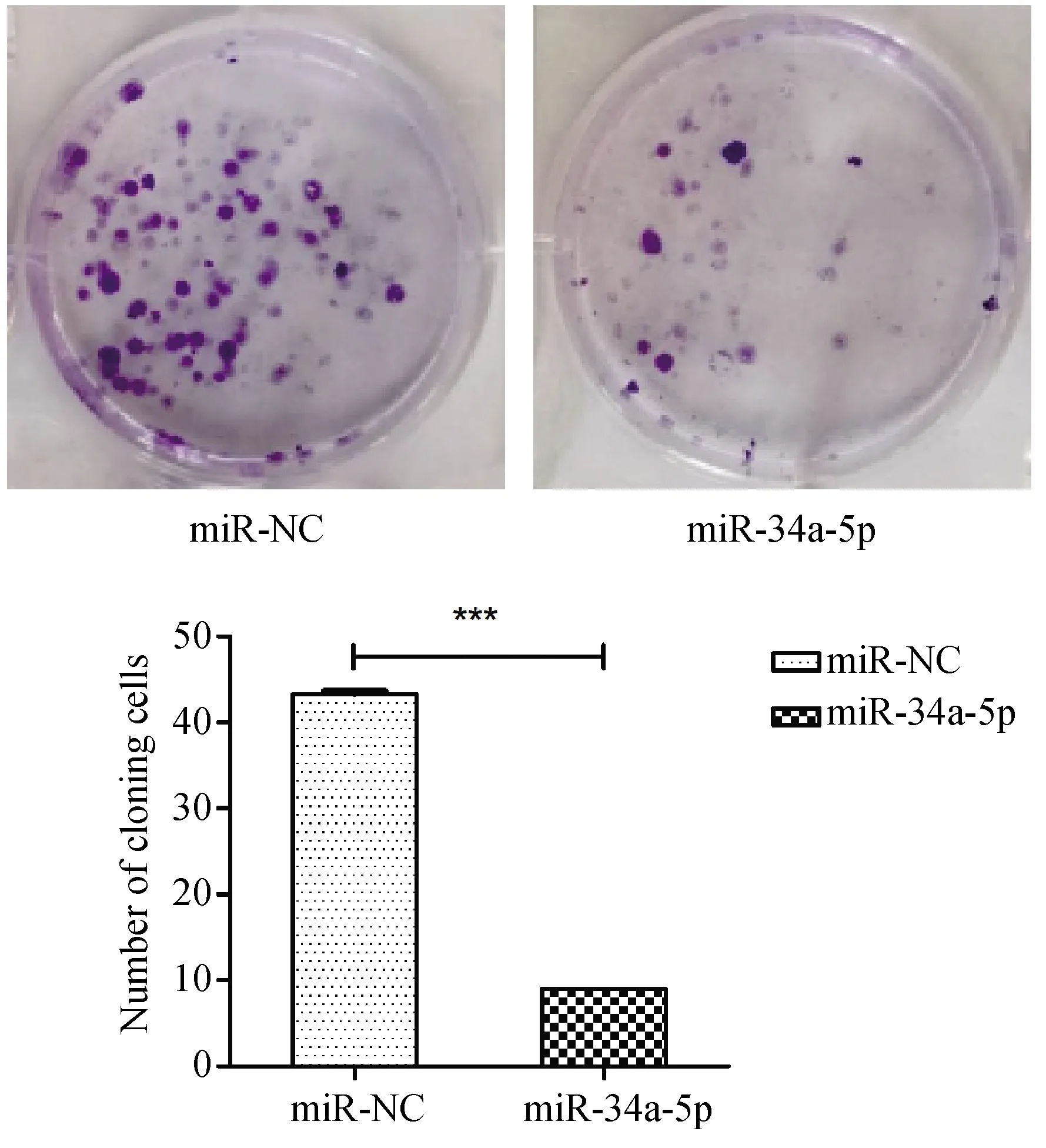
图5 平板克隆实验检测细胞增殖能力
2.5 细胞划痕实验检测miR-34a-5p对SK-RG细胞迁移能力的影响
细胞划痕实验显示在转染miR-34-5p mimics,miR-NC后,miR-34-5p组中的细胞迁移距离、迁移率均低于对照组P<0.01,N=3(图6)。
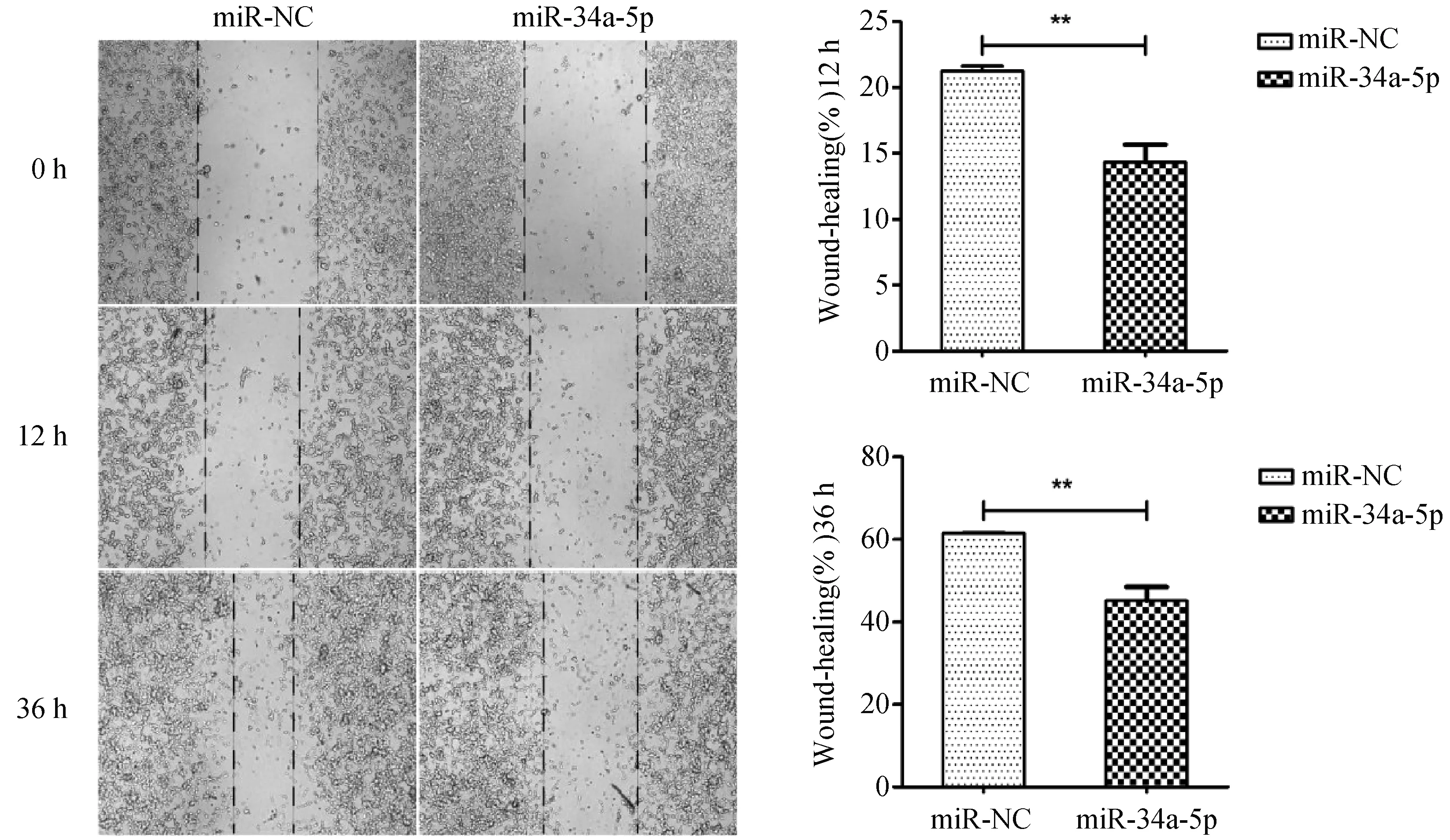
图6 划痕实验检测细胞的迁移能力
2.6 Transwell 迁移实验检测miR-34a-5p对SK-RG细胞迁移能力的影响
转染36 h后分别计数Transwell实验各组穿膜细胞数,结果显示miR-NC组穿膜细胞数多于miR-34a-5p组,说明转染miR-34-5p mimics细胞迁移能力减低,且差异具有统计学意义P<0.000 1,N=3(图7)。进一步验证了miR-34-5p能够抑制细胞的迁移能力。
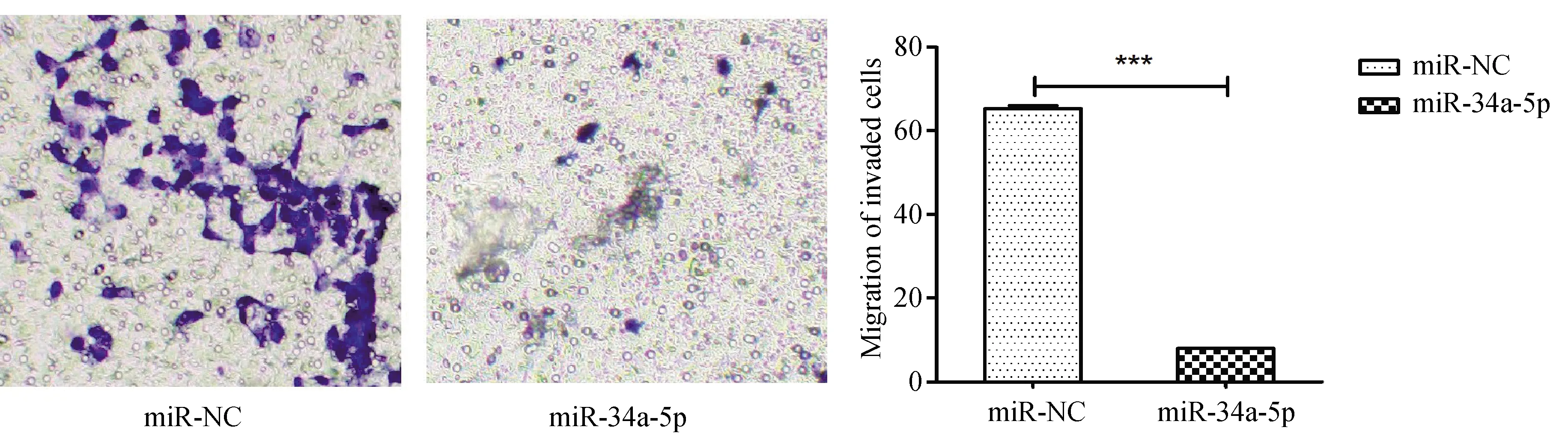
图7 Transwell 迁移实验检测细胞迁移能力
2.7 双荧光素酶报告基因验证miR-34-5p对c-fos的靶向调控作用
采用生物信息学软件TargetScan预测miR-34a-5p与c-fos 基因3 'UTR区的结合位点(图8),接下来我们通过双荧光素酶报告基因实验进行验证。结果发现miRNA-NC+c-fos 3'UTR-mut共转染组和miRNA-34a-5p+c-fos 3'UTR-mut共转染组荧光素酶的活性未见明显变化,而miRNA-NC+c-fos 3'UTR-wt共转染组、miRNA-34a-5p+c-fos 3'UTR-wt共转染组荧光素酶的活性出现变化P=0.003,N=3(图9)。这些结果表明miR-34-5p与c-fos具有靶向关系。
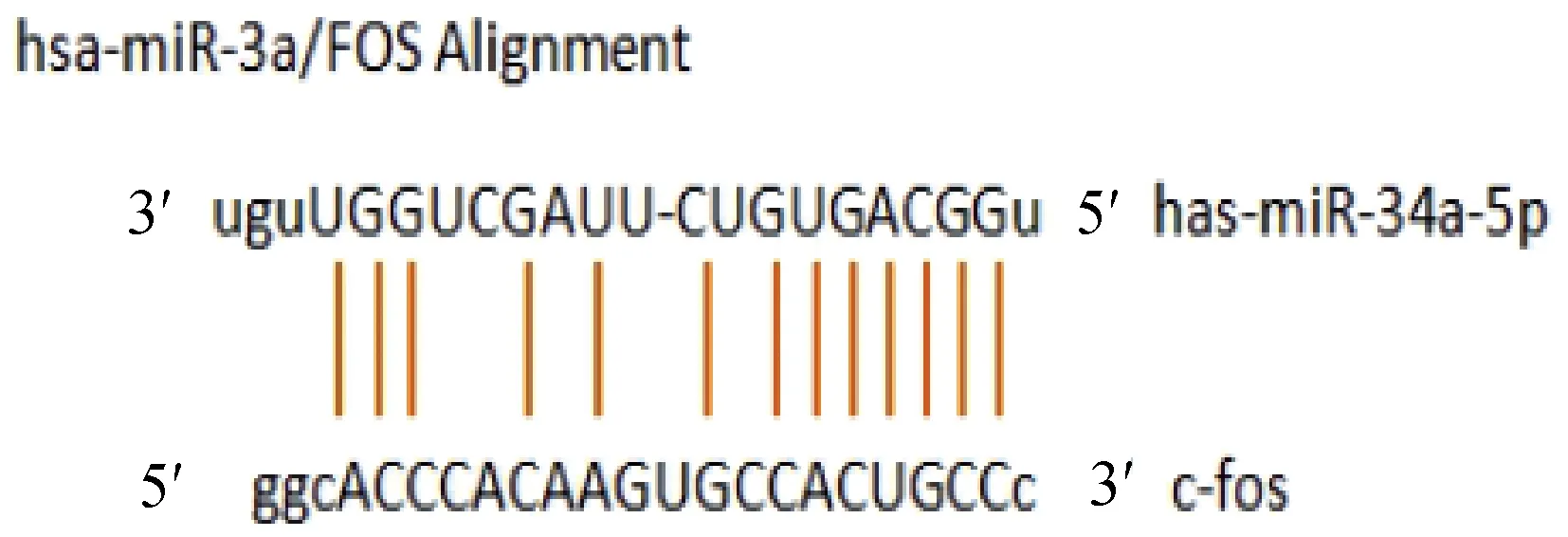
图8 预测miR-34-5p与c-fos 3’UTR的靶向调控位点
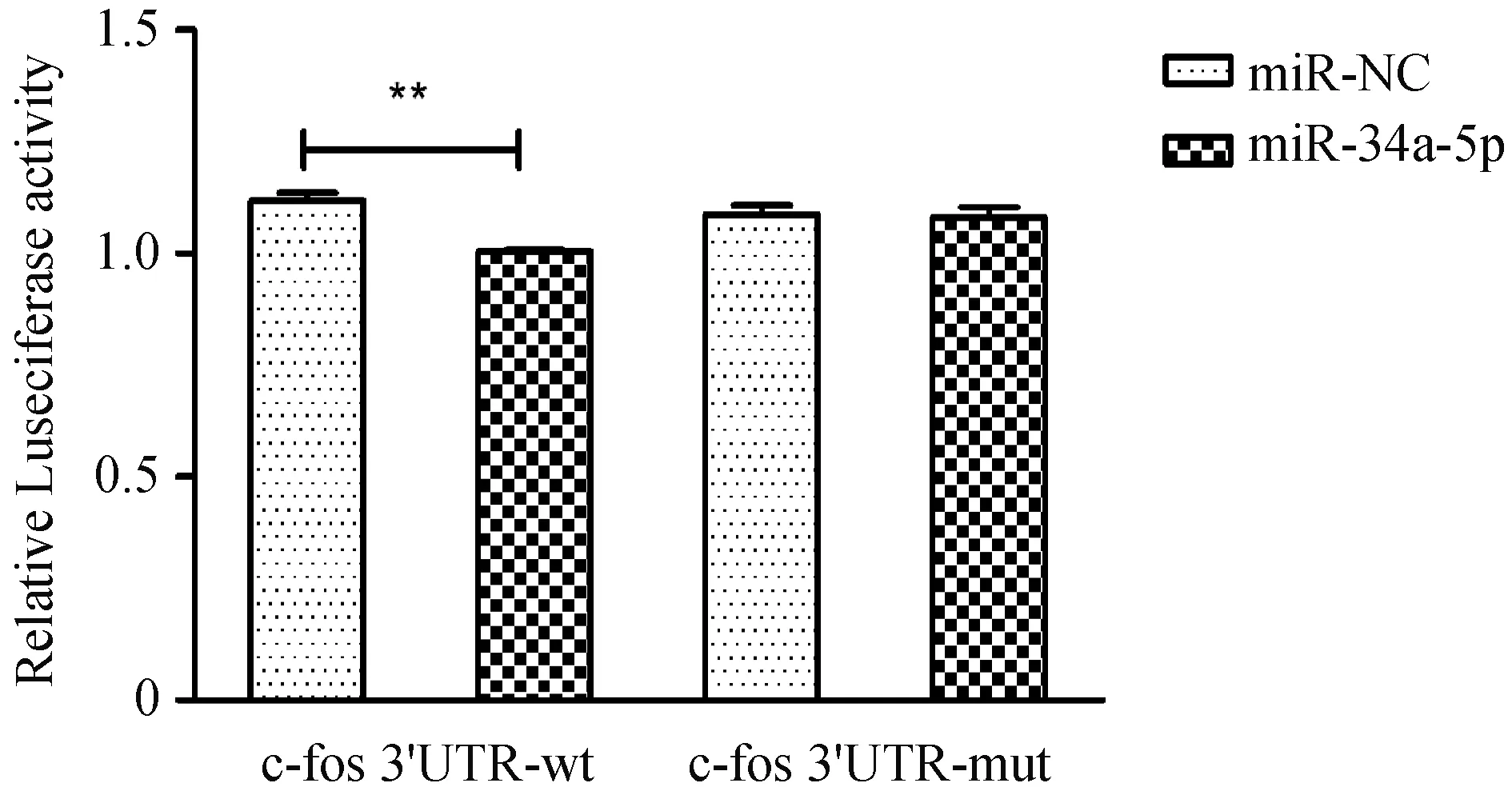
图9 双荧光素酶报告系统验证miR-34a-5p与c-fos的靶向关系
2.8 Western blot检测c-fos表达
SK-RG细胞中转染miR-34a-5p mimics、miR-NC后Western blot检测结果发现,过表达miR-34a-5p后c-fos蛋白表达水平低于miR-NC组,差异具有统计学意义P=0.004 9,N=3(图10)。
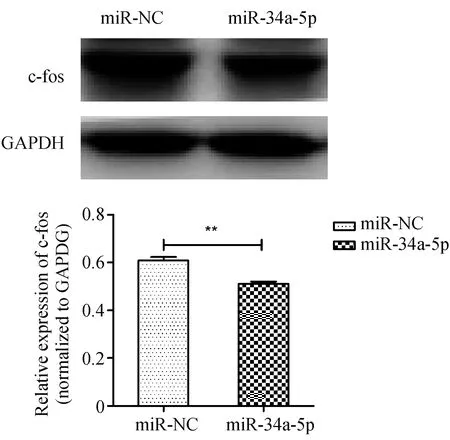
图10 Western blot检测 c-fos蛋白表达水平
3 讨论
许多miRNA已被发现在人类癌细胞中特异性调控失调,其中一些下调的miRNA具有肿瘤抑制基因的功能,而上调的miRNA则具有促肿瘤活性[5-7]。随着对miRNA在癌症生物学中的认识不断深入,以miRNA为基础的治疗策略正在兴起。
我们前期通过转录组测序及与mRNA表达谱关联性分析,发现miR-34a-5p在KSHV感染的神经细胞中与c-fos负相关,呈低表达。最新研究也发现miR-34a家族成员miR-34a-5p 可调节细胞的增殖和侵袭[8]。miR-34a-5p可以通过靶向调节HPV感染的人类表皮角质形成细胞中的JAG1/Notch1途径抑制细胞增殖、迁移和侵袭[9]。miR-34a-5p还可通过靶向调节HMGA2,抑制神经胶质瘤的发生和发展[10]。生物工程miR-34a-5p前体药在体内可以抑制尤文氏肉瘤生长。我们发现了miR-34a-5p在KSHV感染的神经细胞中表达下调,然而,其对此类细胞的作用和机制仍不明确。为进一步分析miR-34a-5p在KSHV感染的神经细胞增殖和迁移能力的影响,我们在SK-RG细胞中转染miR-34a-5p mimics后使得miR-34a-5p过量表达,然后检测细胞增殖和迁移能力,发现过量表达的miR-34a-5p能够抑制KSHV感染的SH-SY5Y细胞的增殖,同时抑制肿瘤细胞的迁移倾向。
目前认为 microRNA 可以通过识别靶基因 mRNA 的 3'UTR区发挥作用,并以完全或不完全的方式与互补序列结合,破坏mRNA的稳定性,抑制 mRNA的翻译,从而进一步调节转录后的基因表达[11-12]。在我们的前期研究中,发现c-fos在KSHV感染的神经细胞中表达上调,并且影响病毒的致病性和细胞的增殖[3],c-fos的表达上调可能涉及其上游的miRNA水平的改变,而生物软件预测miR-34a-5p能够靶向调控c-fos的表达。c-fos是一个核磷蛋白,其在上皮细胞中可激活KSHV病毒的裂解态分子开关ORF50[13],也有研究发现c-fos与KSHV病毒的多个启动子直接结合,激活多种病毒基因的转录[14-15]。c-fos同时也是神经元被刺激激活的一种标志,在神经元活化、突触可塑性及神经细胞凋亡中发挥重要作用[16]。我们通过生物信息学软件进一步预测了miR-34a-5p与c-fos 3'UTR区存在结合位点。双荧光素酶报告基因实验和miR-34a-5p过表达细胞中c-fos的表达检测进一步证实了miR-34a-5p对c-fos的靶向调节作用。KSHV可能在其感染的神经细胞中通过下调miR-34a-5p的水平而导致c-fos蛋白的表达增高,从而进一步影响细胞的增殖和迁移能力。
综上所述,我们证明了miR-34a-5p能够抑制KSHV感染的神经细胞的增殖和迁移能力,其机制涉及对靶基因c-fos的调控。在进一步的研究中,我们将检测KSHV是否调控miR-34a-5p的水平,以及上调miR-34a-5p 对KSHV感染相关疾病的逆转作用,从而为 KSHV 感染引起的疾病的靶向治疗奠定基础。
