缺氧环境对新生SD大鼠神经干细胞增殖的影响及与miR-124-3p的相关性研究
2021-05-12林超群范学政邱波
林超群 范学政 邱波

【关键词】神经干细胞;缺氧环境;增殖;miR-124-3p
各国科学家于上世纪90年代开始了神经干细胞(NSCs)的深入研究,研究人员对哺乳动物脑组织进行细胞群落筛选,发现了一个不仅可以不断分裂,还具有多分化潜能的细胞群落,把它命名为NSCs。脑缺血缺氧往往会导致NSCs的细胞活力受到抑制,甚至发生凋亡,而且NSCs对缺氧环境非常敏感,缺氧环境中NSCs非常容易发生延迟死亡。研究者发现在脑缺血缺氧大鼠模型中,NSCs可依然促进大鼠神经功能的恢复,但缺氧环境中,NSCs的神经修复功能是否削弱,国内外学者并未深入研究。近20年来的研究表明NSCs增殖能力可受到miRNA的调控,目前miRNA与NSCs功能的相关性研究正在逐步深入,其中miR-124-3p被证明与NSCs增殖关系密切,miR-124-3p的高表达可靶向抑制Delta-like1(DLL1)蛋白表达,促进NSCs的增殖。但缺氧环境中,miR-124-3p与NSCs的相关性研究,国内外文献尚未报道。本研究建立缺氧NSCs模型及无缺氧NSCs模型,比较两组模型NSCs的增殖能力,并且分析miR-124-3p与NSCs的相关性,为缺氧环境中NSCs增殖的机制提供理论基础本研究建立缺氧NSCs模型及无缺氧NSCs模型,比较两组模型NSCs的增殖能力,并且分析miR-124-3p与NSCs的相关性,为缺氧环境中NSCs增殖的机制提供理论基础。
1 材料与方法
1.1 材料与设备
培养基 DMEM/F12为1∶1,B27细胞补充添加剂、表皮生长因子(EGF)重组鼠源表皮生长因子及胰蛋白酶消化液来自于Gibco 公司(美国),重组鼠源碱性纤维细胞生长因素青霉素-链霉素双抗溶液来自于PeproTech公司(美国),Accutase分离液,美国Sigma-Aldrich公司、多聚赖氨酸PDL,美国Sigma-Aldrich 公司、PBS 磷酸缓冲盐溶液(pH7.2),美国Thermo Scientific公司、多聚甲醇,国药集团化学试剂有限公司、曲拉通Triton X-100来自于美国Amresco公司,小鼠抗兔多克隆抗体和兔抗小鼠IgG H&L采用美国Abcam公司、驴血清来自于美国Jackson 公司;4',6-二脒基-2-苯基吲哚(DAPI)染色液来自于雷根生物技术有限公司(北京)、Cell Counting Kit-8(CCK-8)试剂盒来自于凯基生物科技发展有限公司(南京)、RNA提取试剂盒,美国Invitrogen公司。 三气培养箱,Thermo Scientific公司;二氧化碳培养箱,美国Thermo公司;倒置荧光显微镜,日本Nikon 公司;激光共聚焦显微镜,美国OLYMPUS公司。
1.2 方法
(1)原代NSCs的提取培养(胎鼠海马来源)。实验使用雌性大鼠为:孕14天SD大鼠,所有大鼠均来源于维通利华实验动物技术有限公司(北京)。使用颈部脱臼的方法,结束孕14天SD大鼠的生命,在无菌操作台,0 ℃环境中腹部解剖实验大鼠,取出胎鼠,逐步分离出胎鼠的大脑,显微镜下解剖出胎鼠海马组织,显微剪均匀海马组织加入胰酶(0.25%)进行5分钟的消化处理,再给予胎牛血清(10%)对消化过程进行终止,给予5分钟的800r离心处理,弃上清液,加入NSCs完全培养后,仔细吹打均匀重悬,过400目细胞筛网,细胞计数后,接种于细胞培养瓶中,把细胞密度调整为5×105/mL。在温度37℃,二氧化碳浓度为5%的恒温培养箱中培养,3 天换液,7 天传代,每天在显微镜下观察NSCs的状态,取第2代悬浮NSCs球进行下一步实验。
(2)NSCs免疫荧光鉴定。使用浓度为100 μg/mL的多聚赖氨酸预先包被24 孔板爬片,PBS 轻柔冲洗3次,取吹打均匀的第2代悬浮NSCs 200 μL放置在24孔爬片上,在恒温箱内培养120 min,在细胞出现贴壁反应后,4%多聚甲醛固定30 min,PBS 轻柔冲洗3 次;加入0.3%曲拉通Triton X-100通透30 min,给予PBS实施3次的轻柔冲洗,给予驴血清(10%)实施一小时的37 ℃的封闭处理,不给予清洗操作,给予一抗(小鼠抗兔多克隆抗体Nestin),4度孵育過夜;PBS轻柔冲洗3次;在避光环境下加入同源荧光二抗(兔抗小鼠IgG H&L)在室温下一小时的孵育处理,给予PBS反复3次冲洗操作;给予DAPI染核处理,再实施PBS反复3次冲洗操作,将爬片处理后放置在脱载玻片进行封片处理,用荧光显微镜对染色结果进行观察分析。
(3)CCK8试验。用Accutase分离液消化第2代悬浮NSCs球,消化充分后细胞球消失,形成多个悬浮单个细胞,对细胞浓度进行调整,在96孔内实施1×104个/孔密度的细胞设置,我们建立缺氧NSCs模型及无缺氧模型,缺氧模型为37度,50%空气,45%N2,5%CO2,的细胞培养环境。无缺氧模型为37度,5%CO2,95%空气的细胞培养环境。我们将NSCs分为无缺氧组,缺氧组,两组不同细胞分别接种于96孔板,无缺氧组在无缺氧环境中培养72小时。缺氧组在缺氧环境中培养72小时,然后每个孔给予10 μLCCK8 试剂的加入,并实施两小时的37 ℃温度下的孵育处理,对450 nm波长各孔的吸光度水平实施酶标仪的检测处理,记录数据并统计。
(4)不同缺氧环境中NSCs增殖的形态学鉴定。为了研究缺氧环境中NSCs的增殖能力,取第2代悬浮NSCs,细胞计数后,接种于细胞培养瓶中,把细胞密度调整为5×105/mL。将NSCs分为无缺氧组和缺氧组,两组不同细胞在不同缺氧环境中培养,72小时后在显微镜下观察NSCs的状态。
(5)RT-PCR检测miR-124-3p的表达水平为了检测2组不同细胞miR-124-3p的表达水平,我们收集无缺氧组及缺氧组细胞后,使用Trizol法提取RNA,以37度持续60 分钟,85 度持续5分钟进行反转录反应;然后95度预变性10 分钟;95度变性20秒;60度退火15秒,72度延伸收集30秒,一共40个扩增循环。每个样本设置3个复孔,采用2-ΔΔCt 法计算miR-124-3p基因的相对表达量,该实验重复3 次并取其均值。
1.3 统计学分析
以上各项指标给予(x—±s)进行表示,开展GraphPad8.0軟件及SPSS 22.0软件对符合方差齐性及正态分布的数据资料实施t检验的处理,当P<0.05为差异具有统计学意义。
2 结果
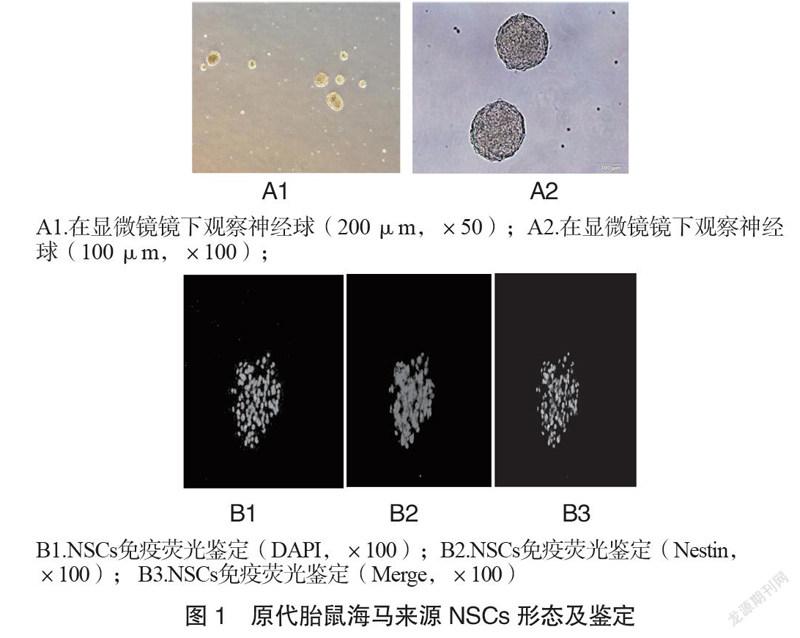
2.1 原代胎鼠海马来源NSCs形态及鉴定
NSCs悬浮生长,随着增殖的NSCs逐渐融合,6~7天后,肉眼就能辨认出含有数千个细胞的大神经球(图A1~A2)。原代NSCs在体外是神经球样的,通过免疫荧光法证实表达NSCs的特异性标记蛋白Nestin(图B1~B2)。
2.2 不同缺氧环境对NSCs活力的影响
本研究采用CCKB实验评估显示,在缺氧环境中,NSCs的细胞活力明显下降(P<0.01),见图2。
2.3 两种不同缺氧环境中原代NSCs增殖培养的形态
实验分组后,72 h后在显微镜下观察NSCs的状态:无缺氧组见大多数细胞显著增殖呈悬浮聚集成球生长,只有少数细胞呈单个细胞生长。缺氧组少部分细胞成球生长,大部分仍呈单细胞生长,见图3。
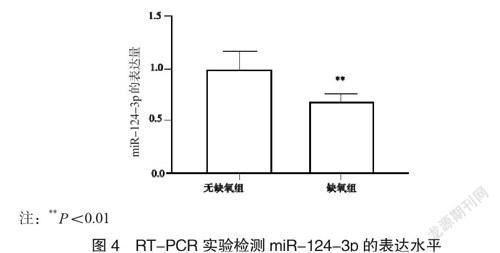
2.4 缺氧环境中NSCs的miR-124-3p的表达水平
实验分组后,72 h后使用RT-PCR实验检测两组不同细胞miR-124-3p的表达水平。通过实验发现,在缺氧环境中,miR-124-3p的表达量明显下降,见图4。
3 讨论
本研究的目的是探讨缺氧环境对新生SD大鼠NSCs增殖的影响,并且分析miR-124-3p与NSCs的相关性,为缺氧环境中NSCs增殖的机制提供理论基础[1-2]。本研究结果表明,在缺氧环境中,新生SD大鼠NSCs增殖受到明显抑制[3],并且NSCs中miR-124-3p的表达量高低与不同缺氧环境具有相关性[4]。
自从1992年Reynolds首次提出NSCs的概念后,通过NSCs治疗神经系统疾病,给脑损伤后神经功能的恢复带来了新希望。miR-124-3p作为中枢神经系统特异性的miRNA,在NSC 的增殖与向神经性分化过程中,起着关键性的作用[5]。研究证明,miR-124-3p的高表达可靶向抑制Delta-like1(DLL1)蛋白表达,促进NSCs的增殖,在NSC 的维持与神经再生中起关键作用[6].。在本研究中,我们建立缺氧NSCs模型的建立,证实了缺氧环境对NSCs增殖的影响非常大,同时也明确了miR-124-3p的表达量与缺氧环境的相关性,但miR-124-3p具体通过何种通路,在缺氧环境中调控NSCs的增殖机制研究,本研究并未明确,需要进一步研究来揭示这一机制。本研究有一定的局限性。由于本研究是在体外进行的,因此在体内缺氧环境中进一步NSCs的增殖机制仍有必要[7-8]。
综上所述,在缺氧环境中,新生SD大鼠NSCs增殖受到明显抑制;NSCs中miR-124-3p的表达量高低与不同的缺氧环境具有相关性。
