BRCA1基因miRNA结合位点多态性与肝细胞癌术后总生存期的关联研究
2021-05-11林秋伶刘颖春温秋萍周子寒蒋燕霁梁秀妹龚文锋马良刘书言余红平
林秋伶 刘颖春 温秋萍 周子寒 蒋燕霁 梁秀妹 龚文锋 马良 刘书言 余红平
肝癌是最常见的消化系统恶性肿瘤之一,2018年中国肝癌新发病例约41万例,位居恶性肿瘤发病谱第5位;肝癌相关死亡人数约39.1万例,位居恶性肿瘤死亡谱第2位[1]。肝细胞癌(hepatocellular carcinoma,HCC)是肝癌最主要的病理分型,占我国所有肝癌患者的90%[2]。近年来尽管肝癌的治疗水平有了很大提高,但5年生存率仍不理想[3⁃4]。据国家癌症中心统计,HCC患者的5年总生存率仅为12.1%[5]。导致HCC患者预后不良的危险因素除了临床分期、微血管侵犯、癌栓、甲胎蛋白(alpha fetal protein,AFP)等因素外,个体的遗传变异也可能影响HCC患者的预后[6]。因此,探索遗传变异对HCC预后的影响,对患者的个体化治疗和预后改善具有重要意义。
MicroRNA(miRNA)是一类非编码小RNA,通过与信使RNA非翻译区(3'⁃UTR)中的靶结合位点结合从而调控基因的表达[7]。位于miRNA结合位点上的单核苷酸多态性(single nucleotide polymorphism,SNP)可通过影响miRNA对靶基因的调控作用,改变靶基因转录水平或功能,从而促进肿瘤发生发展[8]。研究证实,位于功能基因的miRNA结合位点SNP在癌症发病风险和预后中起着重要作用[9⁃10]。YU等[11]研究发现FAM13A基因SNP rs9224(G>A)与肺鳞癌预后相关,A等位基因可能通过影响FAM13A基因和miRNA⁃22⁃5p的结合能力而增加肺鳞癌的死亡风险。ZHANG等[12]报道携带MDM4 rs4245739(A>C)AC/CC基因型的口咽癌患者较携带AA基因型患者的总生存率和无病生存率显著提高。ZHOU等[13]发现GOLGA7 rs11337(G>T)可能与胶质瘤患者预后有关,携带GT基因型患者的死亡风险高于携带GG基因型患者(HR=1.25,95%CI:1.04~1.50)。
DNA损伤可由各种内源性和外源性刺激引起[14],通过损伤修复反应维持基因组完整性[15]。同源重组是DNA修复主要途径之一,在DNA复制和DNA双链断裂损伤修复中起重要作用[16]。BRCA1 DNA修复相关基因(BRCA1 DNA repair associated,BRCA1)位于17q21.31号染色体上,在同源重组过程中起关键作用[17⁃18]。BRCA1表达水平的下调,降低了DNA修复能力,可增加癌细胞对包括化疗和放疗在内的DNA损伤因子的敏感性[19]。已有研究表明BRCA1高表达与多种肿瘤不良预后相关,包括卵巢癌、非小细胞肺癌和胃癌等[20⁃22]。DNA修复相关基因的遗传变异,不仅影响癌症发病风险,还影响患者的治疗反应,导致复发和生存时间的差异[23]。本研究主要探讨BRCA1 miRNA结合位点多态性与HCC患者术后总生存期(overall survival,OS)的关系。
1 资料与方法
1.1 研究对象
本研究基于本课题组肝癌分子流行病学遗传变异数据库中接受根治术治疗的411例HCC患者为研究对象,来源于2004年6月至2013年12月在广西医科大学附属肿瘤医院首次确诊且接受根治性手术切除的HCC患者,均经术后病理诊断或结合影像学及AFP等指标诊断为HCC。排除远处转移患者;合并严重心脏、肺脏、肾脏以及脑血管疾病患者;拒绝随访或无完整的临床资料患者;术前曾接受放射治疗和/或化疗患者。本研究通过广西医科大学附属肿瘤医院伦理委员会审批,且经研究对象知情同意。
1.2 资料收集与随访
通过电话进行随访。查阅病历收集患者性别、年龄、饮酒史、吸烟史以及乙型肝炎病毒(hepatitis B virus,HBV)感染情况、BCLC分期、肿瘤大小、肿瘤数目、是否合并肝硬化、有无癌栓等资料。患者出院后2年内每3个月电话随访1次,之后每6个月随访1次,随访截至2020年2月24日。以OS作为终点指标,OS为手术之日至患者死亡或末次随访的时间。失访或末次随访仍未死亡的病例作为截尾事件。
1.3 SNPs的选择和基因分型
1.3.1 BRCA1候选SNPs的选择 基于SNP功能预测网站(http://snpinfo.niehs.nih)筛选位于 BRCA1 miRNA结合位点上的SNPs。选择标准:⑴位于miRNA结合位点上;⑵在中国北京汉族人群中最小等位基因频率>0.05。最终筛选到SNPs rs8176318和rs12516,这2个SNPs均位于miRNA结合位点且完全连锁(r2=1)。本研究选择BRCA1的rs8176318(C>A)进行研究。
1.3.2 基因型检测和质量控制 采用苯酚⁃氯仿法从血液中提取DNA。SNP rs8176318(C>A)使用Agena Mass ARRAY分型系统(Agena;San Diego,California)进行基因分型检测。BRCA1 rs8176318位点PCR引物设计:上游序列为5'⁃ACGTTGGATGTCCTTCCATT⁃GAAGGGTCTG⁃3',下游序列为5'⁃ACGTTGGATGTG⁃GCCTCAAGAGAATAGCTG⁃3'。基因分型成功率为93.2%;随机抽取10%样品进行复检,复检一致率为100%。
1.4 统计学方法
以乘积极限法(Kaplan⁃Meier)进行单因素分析,log⁃rank法比较携带不同基因型患者术后OS的差异,并使用GraphPad Prism 7.0软件(GraphPad Software Inc,San Diego,CA,USA)绘制生存曲线。采用 SPSS 20.0软件进行单因素和多因素Cox比例风险模型分析,计算风险比(hazard rate,HR)和95%置信区间(confidence interval,CI)。表达数量性状基因座分析(expressionquantitativetraitloci,eQTL)数据来源于GTEx数据库(GTEx,V7,http://www.gtexportal.org/home/)。所有统计学检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 研究人群基本特征
本研究剔除基因分型失败的28例和OS<30 d的20例HCC患者,最终纳入363例HCC患者进行生存分析,随访截止时,截尾数据97例(26.7%),其中失访66例(18.2%)。患者的人口学和临床病理特征分布(表1):男性331例(91.18%),女性32例(8.82%);吸烟者151例(41.6%),饮酒者134例(36.91%);HBV感染者311例(85.67%);BCLC分期A/B期201例(55.37%),BCLC分期C期162例(44.63%);单个肿瘤285例(78.51%);肿瘤直径>5 cm 230例(63.36%);合并肝硬化201例(55.37%);发生癌栓98例(23.00%)。Cox比例风险回归分析结果显示,肿瘤直径>5 cm(HR=1.883,95%CI:1.441~2.462,P<0.001)和发生癌栓(HR=1.900,95%CI:1.443~2.503,P<0.001)的患者死亡风险更高。
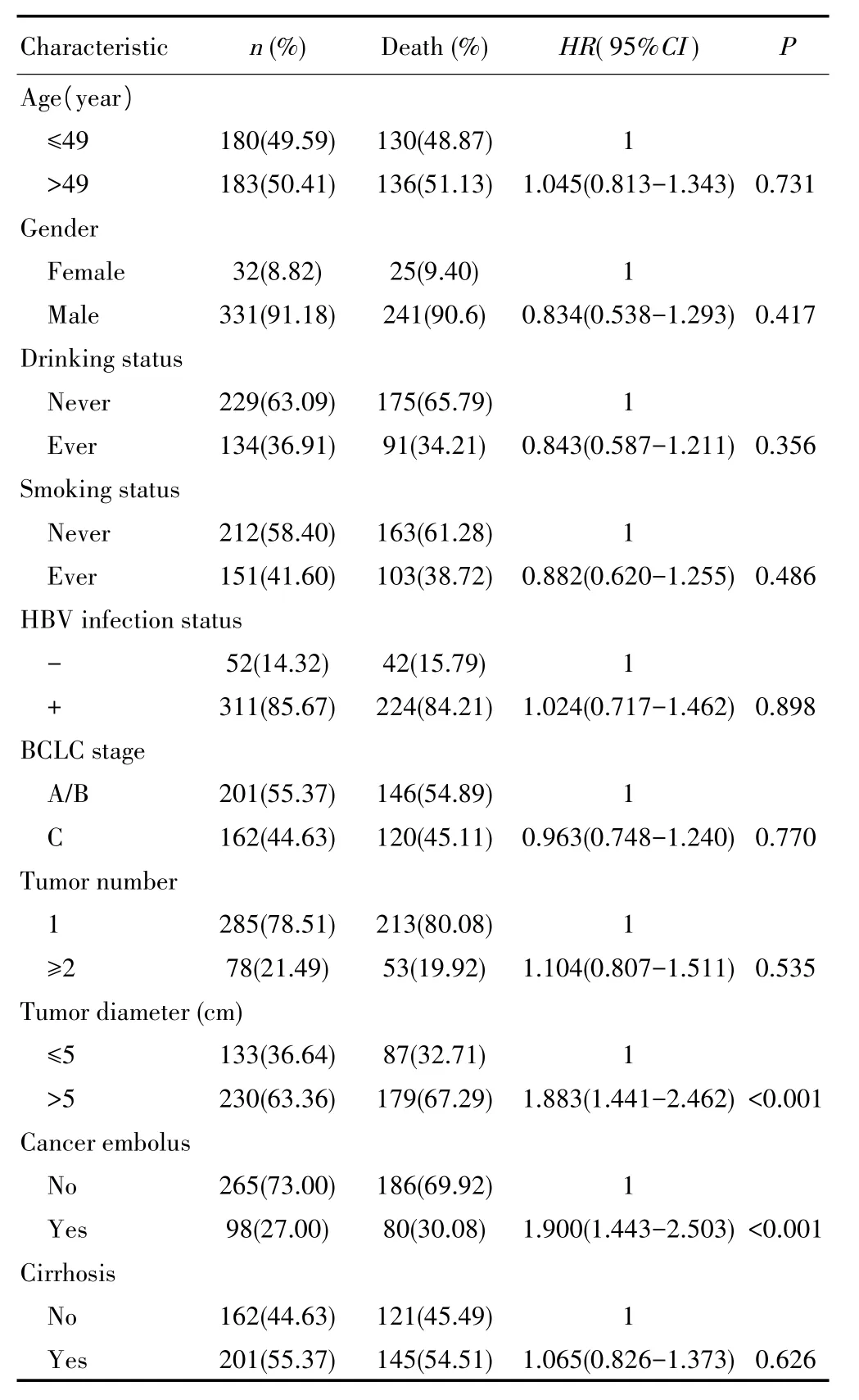
表1 363例HCC术后患者临床病理特征与OS的关系Tab.1 Association between clinicopathological characteristics and OS in 363 HCC patients after hepatectomy
2.2 BRCA1 rs8176318与HCC患者术后OS的关系
使用多因素Cox比例风险回归模型分析在不同遗传模型中rs8176318与HCC患者术后OS的相关性。在共显性模型下,调整年龄、性别、吸烟、饮酒、HBV感染情况、BCLC分期、肿瘤数目、肿瘤直径、肝硬化、癌栓等因素后,发现携带突变纯合子AA基因型的HCC患者术后发生死亡的风险降低了30.3%(HR=0.697,95%CI:0.493~0.984,P=0.040);在隐性模型(AAvsCC/AC)下,携带AA基因型的患者较CC/AC基因型患者术后发生死亡的风险降低了32.5%(HR=0.675,95%CI:0.494~0.922,P=0.014),见表2。Kaplan⁃Meier分析结果显示,携带AA基因型的HCC患者较携带AC/CC基因型患者术后中位OS更长(46.1个月vs33.8个月,P=0.049),见图1。
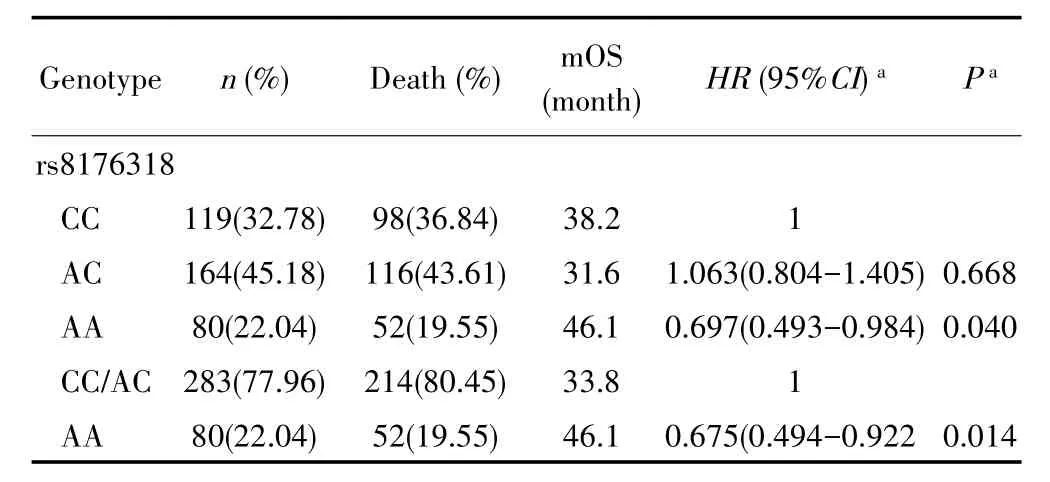
表2 BRCA1 rs8176318与HCC患者术后OS的关系Tab.2 Association between BRCA1 rs8176318 and OS in HCC patients after hepatectomy
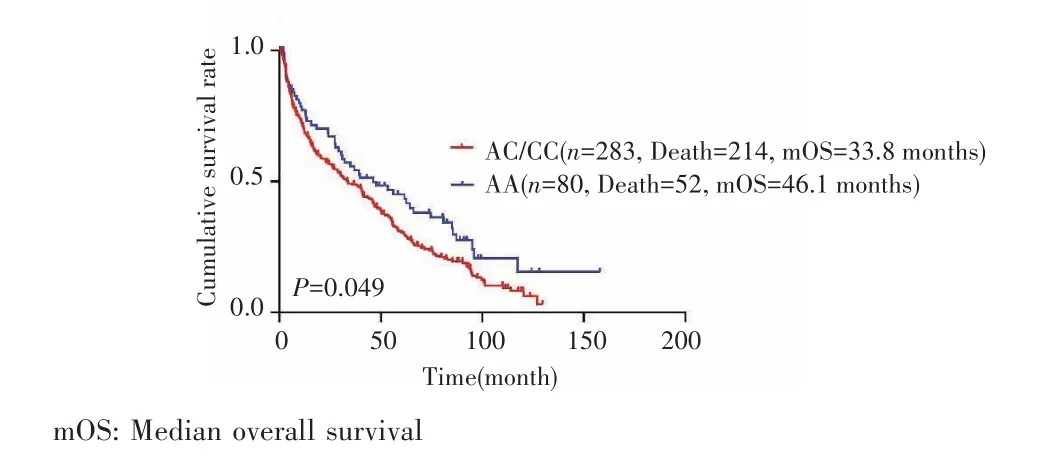
图1 rs8176318 HCC位点不同基因型 术后患者的生存曲线Fig.1 Survival curves for HCC patients after hepatectomy by rs8176318 genotypes
2.3 分层分析rs8176318对HCC患者术后OS的影响
在年龄、肿瘤大小、癌栓和肝硬化分层下,rs8176318与HCC患者术后OS无统计学关联(P>0.05)。而在男性人群中,携带rs8176318位点AA基因型的患者较CC/CA基因型患者术后死亡风险显著降低(HR=0.616,95%CI:0.443~0.856,P=0.004);在饮酒人群中,携带AA基因型较携带CC/CA基因型患者术后死亡风险显著降低(HR=0.670,95%CI:0.454~0.988,P=0.043);在不吸烟人群中,携带AA基因型的患者比携带CC/CA基因型患者具有更低的死亡风险(HR=0.616,95%CI:0.417~0.911,P=0.015);在HBV感染人群中,携带AA基因型的患者比携带CC/CA基因型患者具有更低的死亡风险(HR=0.664,95%CI:0.466~0.945,P=0.023);在BCLC分期A/B期人群中,携带AA基因型的患者比携带CC/CA基因型患者具有更低的死亡风险(HR=0.632,95%CI:0.419~0.952,P=0.028);在单个肿瘤人群中,携带AA基因型的患者比携带CC/CA基因型患者具有更低的死亡风险(HR=0.694,95%CI:0.491~0.981,P=0.038)。见表3。
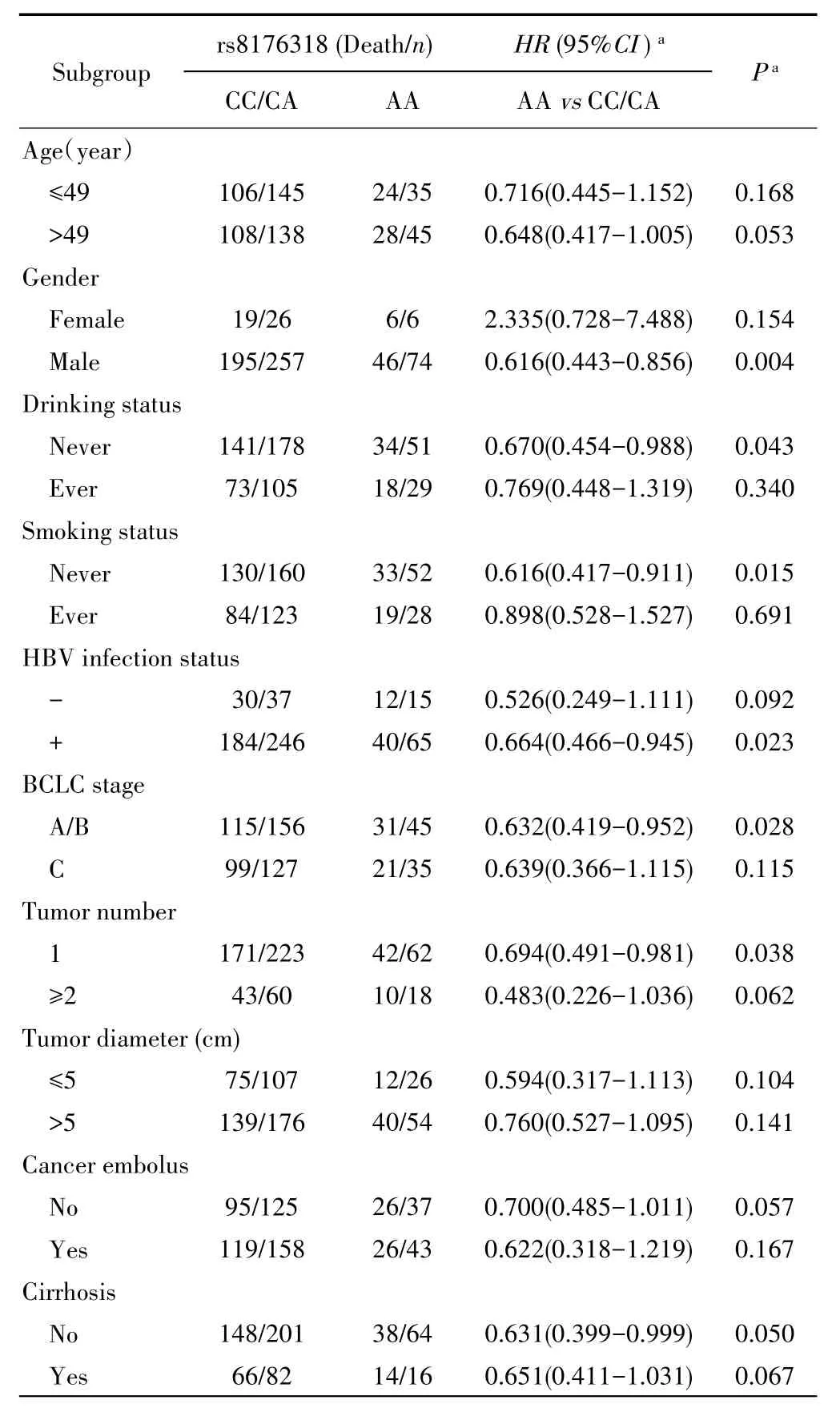
表3 分层分析rs8176318与HCC患者术后OS的相关性Tab.3 Stratification analyses of association between rs8176318and OS in HCC patients after hepatectomy
2.4 rs8176318不同基因型与BRCA1 mRNA表达水平的相关性
为评估rs8176318不同基因型与BRCA1 mRNA表达水平的相关性,本研究利用GTEx数据库中208例正常肝脏组织的 R NA⁃Seq 数据进行 e QTL分析。eQTL结果显示,rs8176318 AA基因型与较低的BRCA1 mRNA表达水平相关(P<0.001),见图2。
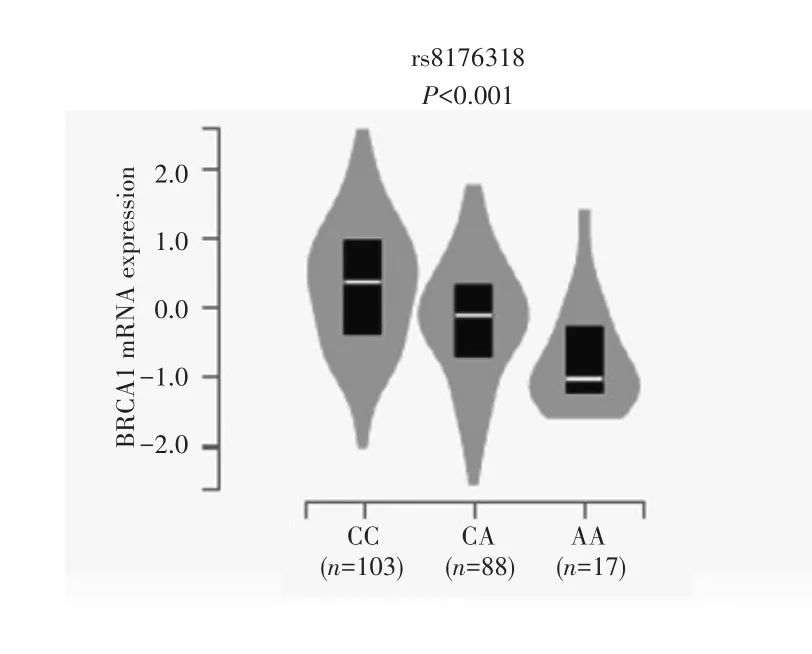
图2 rs8176318基因型与BRCA1 mRNA表达水平的相关性分析Fig.2 The correlation between BRCA1 rs8176318 genotypes and its mRNA expression levels
3 讨论
本研究发现BRCA1基因miRNA结合位点上的rs8176318多态性与HCC患者术后OS相关,A等位基因可降低HCC患者术后死亡风险且rs8176318 AA基因型与较低的BRCA1 mRNA表达水平相关。这表明rs8176318可能通过影响BRCA1的转录水平从而影响HCC患者预后,可作为判断HCC预后的生物标志物。
BRCA1是一个重要的DNA修复基因,主要参与机体的DNA同源重组修复。首先,BRCA1通过与abraxas⁃RAP80复合物结合从而被吸附到DNA双链断裂处[24];接着,通过与CtIP和MRN复合体的交互作用参与DNA双链断裂切除[25⁃26];最后,将RAD51募集到DNA损伤位点与PALB2和BRCA2等基因发生相互作用,从而完成同源重组修复,维持机体基因组的稳定性[27]。目前研究表明,BRCA1 DNA修复基因在肿瘤进展和治疗中发挥着双刃剑的作用。一方面,在正常细胞内,DNA修复相关基因可以通过基因修复帮助细胞抵抗自发或诱导的DNA损伤,抑制恶性肿瘤发生[28]。另一方面,在肿瘤细胞内,肿瘤细胞通过增强DNA损伤的修复能力来逃逸细胞死亡,从而导致肿瘤细胞对放化疗药物的耐受性[29]。有研究[30]发现miR⁃NA⁃140过表达可以靶向抑制肿瘤细胞中DNA修复基因FEN1的表达,显著增强乳腺癌细胞对化疗药物的敏感性。亦有研究发现,FEN1高表达水平与多种癌症耐药和预后不良有关[31⁃32]。ZHAO等[33]研究表明BRCA1表达水平下调可导致HCC细胞的同源重组修复能力下降,同时PARP1表达水平下调可导致HCC细胞的碱基切除修复能力缺失,两者发挥协同作用可造成HCC细胞不可修复的DNA损伤和细胞死亡,从而提高HCC细胞对化疗药物奥拉帕尼的敏感性。WANG等[34]发现小分子药物奥拉帕尼可阻断HCC细胞的同源重组修复和选择性非同源末端连接修复,而DNA⁃PK抑制剂能阻断HCC细胞的非同源末端连接修复,奥拉帕尼和DNA⁃PK抑制剂联合使用可以完全阻断HCC细胞的DNA双链断裂修复能力,进而有效抑制HCC细胞增殖,肿瘤增长抑制率达到62.3%~83.9%。PARK等[35]研究表明乳腺癌中BRCA1蛋白过表达与患者不良预后相关。
目前越来越多的证据表明,miRNAs可能通过影响BRCA1转录水平参与DNA损伤修复过程,从而正确调控细胞周期和维持基因组稳定性[36]。但是很少研究关注BRCA1基因miRNA结合位点SNP在肿瘤预后中的作用。泰国一项针对乳腺癌的研究发现,乳腺癌复发率降低与BRCA13'⁃UTR上SNPs 5711+421(G>T)和5711+1286(C>T)相关[37]。ZHU 等[38]研究也发现在口咽鳞状细胞癌中位于BRCA1 miRNA结合位点上SNP rs12516(T>C)的CC基因型可降低患者的复发风险。本研究结果也发现BRCA1 SNP rs8176318可影响HCC患者术后OS,AA基因型可降低患者的死亡风险。
miRNAs结合位点上的SNPs可能通过影响miRNA和靶基因的结合能力改变基因转录水平,导致基因部分功能改变[39]。本研究基于SNPinfo网站预测发现,BRCA1 SNP rs8176318可能存在5个靶向结合miRNAs(has⁃miR⁃1182、has⁃miR⁃149、has⁃miR⁃345、has⁃miR⁃544和has⁃miR⁃639)。其中,has⁃miR⁃149被普遍认为是一种肿瘤抑制因子[40],也是良好的肿瘤预后标志物[41]。ZHANG等[42]研究发现has⁃miR⁃149在HCC组织中的表达明显下调,且其低表达与较差的临床病理特征相关(包括肿瘤体积大、血管侵犯、淋巴结转移、更晚的BCLC分期)。LUO等[43]发现干扰has⁃miR⁃149后,HCC细胞迁移和侵袭能力均明显增强,而且其低表达是HCC预后不良的影响因素。也有研究发现干扰has⁃miR⁃345后,HCC细胞迁移、侵袭和上皮间质转化能力均明显增强,而且其低表达与HCC预后不良有关[44⁃45]。本研究的基因型⁃表型关联分析结果显示,rs8176318AA基因型与较低的BRCA1 mRNA表达水平相关,因此推测rs8176318突变纯合基因型AA可能通过提高miRNA与BRCA1的结合能力而抑制BRCA1 mRNA的表达水平,致使HCC细胞的同源重组修复能力下降,进而降低HCC患者术后的死亡风险,但是这一推测还需进一步进行功能学实验验证。
综上所述,BRCA1 rs8176318(C>A)AA可能通过提高miRNA与BRCA1的结合能力而抑制BRCA1 mRNA的表达水平,致使HCC细胞的同源重组修复能力下降,进而降低HCC患者术后的死亡风险。但本研究也存在一定的局限性:⑴本课题是以医院为基础的回顾性队列研究,病例纳入可能会存在入院偏倚;⑵样本量相对较小;⑶未能收集更完整的临床治疗数据,比如患者术后接受辅助性治疗等信息,未能对这些因素进行评估,可能对最终的研究结果产生一定影响。因此,本研究结果仍需开展更大样本量的多中心研究进行验证。
