AI-2、HBD在早产儿坏死性小肠结肠炎病情监测中的价值
2021-05-10裴小瑜李少芳刘凯
裴小瑜,李少芳,刘凯
(三二○一医院新生儿科,陕西 汉中 723000)
新生儿坏死性小肠结肠炎(necrotizing entero-colitis,NEC)是临床常见的小肠、结肠弥漫性坏死性的危重疾病,好发于早产儿,严重者可导致死亡[1-2]。目前NEC的发病机制尚不明确,可能与肠道菌群紊乱、机体免疫等有关[3],临床多通过炎症指标、影像学指标、尿液指标等[4-6]对NEC进行监测与预后判断,单一或联合检测的判断价值均良好,可为制订临床治疗方案以及治疗药物选择提供参考,但此类指标往往忽略了肠道菌群在疾病进展中的作用。采用基因组学、代谢组学等方法测定NEC患儿肠道菌群变化,可判断NEC患儿肠道菌群各菌属情况,但操作难度大、费用高、周期长,难以在基层医院实施。因此,急需寻找合适、简便易行的肠道菌群监测指标。粪便自诱导分子-2(autoinducer-2,AI-2)是机体肠道菌群的信号因子,与肠道菌群的稳定性、正常菌群定植以及胃肠道感染性疾病有关[7]。粪便人β-防御素(human β-defensin,HBD)是一类由胃肠道黏膜分泌的抗菌肽,主要分为HBD1、HBD2,与机体免疫功能和胃肠道炎症因子变化密切相关[8]。本研究旨在探讨AI-2、HBD在NEC中的水平及其对该病的监测价值,以弥补临床对NEC患者肠道菌群影响因子监测的不足。
1 资料与方法
1.1一般资料 选取2016年3月至2020年1月三二○一医院新生儿科收治的33例确诊NEC早产儿作为NEC组,其中NEC诊断时定为急性期,再次开奶 3 d后定为恢复期。NEC组中男18例、女15例;胎龄30~36周,平均(33.0±2.1)周;出生体重1 892~2 637 g,平均(2 355±218) g;Apgar评分6~8分,平均(7.5±1.1)分;入组日龄1~23 d,平均(7.3±1.0) d。选取同期41例早产非NEC患儿作为非NEC组,其中男23例、女18例;胎龄30~36周,平均(33.1±2.0)周;出生体重1 783~2 688 g,平均(2 369±213) g;Apgar评分6~9分,平均(7.4±1.1)分;入组日龄1~20 d,平均(7.4±1.1) d;新生儿病理性黄疸32例,新生儿肺炎9例。两组性别、胎龄等一般资料比较差异无统计学意义(P>0.05)。本研究通过三二○一医院伦理委员会审核批准,所有患儿家属均签署知情同意书。
1.2纳入与排除标准 纳入标准:①符合《儿科学(第8版)》[9]、《诸福棠实用儿科学(第7版)》[10]关于早产儿、NEC的诊断标准;②产妇既往无特殊病史;③单胎,头位;④入组日龄≤28 d;⑤粪便量足够(满足AI-2、HBD检测要求);⑥临床资料完整;⑦非NEC组无消化道症状;⑧依从性良好。排除标准:①全身严重感染;②消化道畸形;③先天性心脏病;④免疫缺陷性疾病;⑤心功能不全;⑥呼吸衰竭;⑦转院、转科、中途家属要求退出试验。
1.3方法 所有NEC患儿于诊断NEC当天和临床症状好转并开奶3 d时采集3~5 g粪便,置于-80 ℃保存。非NEC患儿于出院时采集3~5 g粪便,置于-80 ℃保存。取250 mg粪便溶于按1∶50配备的尿素和柠檬酸盐缓冲液中,采用漩涡振荡器(日本日立公司生产,型号:HM-2N)震荡30 s,采用离心机(北京奥德瑞泰科技有限公司生产,型号:MHY-13389)以13 000×g离心10 min,取上清液,采用酶联免疫吸附试验测定粪便中HBD1、HBD2水平。另取40 mg粪便标本混合于2216E液体培养基(青岛高科因海博生物生物技术有限公司生产,产品编号:HB0132-1,规格:250 g),漩涡震荡30 s后以2 300×g离心10 min,过滤后作为待测样本。
以1 μmol AI-2作为阴性对照,采用生物荧光检测法测定粪便中AI-2水平。采集0.2 g粪便样本用于提取微生物DNA,采用338F(5′-barcode-ACTCCTACGGGAGGCAGCA-3′)及806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行16S核糖体DNA的V3和V4区域的聚合酶链反应扩增,然后通过2%琼脂糖凝胶电泳分离以及AxyPrepDNA凝胶回收得到聚合酶链反应产物。采用QuantiFluorTM-ST蓝色荧光定量系统进行定量检测,并通过Illumina Miseq平台建库测序。对原始数据优化后采用Usearch 7.0进行操作分类单元划分,得到纲水平、种属水平肠道菌群情况,并根据Chaol算法计算香农-威纳指数(Shannon-Weiner指数),Shannon-Weiner指数越高,表明生物多样性越高[11]。
另采集3~5 g粪便送至三二○一医院临床检验中心,根据《肠道菌群粪便涂片检查图谱》[12]将粪便菌群紊乱情况分为以下4个等级。①基本正常:粪便标本细菌总数处于正常值范围,革兰阳性菌数大于革兰阴性菌数,革兰阳性或阴性球菌少见;②Ⅰ度失调:粪便标本细菌总数略低于正常值,革兰阳性菌数小于革兰阴性菌数,革兰阴性杆菌和革兰阳性球菌增多;③Ⅱ度失调:粪便标本细菌总数明显低于正常值,革兰阴性杆菌总数增多,革兰阳性球菌数目较多,有少量酵母样菌;④Ⅲ度失调:粪便标本细菌总数极少,未见或很少见革兰阳性或阴性杆菌,酵母样菌比例较多。
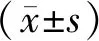
2 结 果
本研究病例经对症支持治疗后均康复出院,无死亡病例。
2.1两组肠道菌群紊乱分级比较 NEC组肠道菌群紊乱发生率高于非NEC组[81.82%(27/33)比41.46(17/41)](χ2=12.352,P<0.001),NEC组肠道菌群紊乱分级优于非NEC组[Z=-3.366,P=0.001],见表1。

表1 NEC组与非NEC组患儿肠道菌群紊乱分级比较 (例)
2.2非NEC组、NEC急性期和恢复期组肠道菌群纲水平和种属水平Shannon-Weiner指数比较 各组肠道菌群纲水平和种属水平Shannon-Weiner指数比较差异有统计学意义(P<0.01),NEC恢复期组纲水平和种属水平Shannon-Weiner指数低于非NEC组和NEC急性期组(P<0.05),NEC急性期组与非NEC组比较差异无统计学意义(P>0.05),见表2。

表2 非NEC组、NEC急性期和恢复期组肠道菌群纲水平和种属水平Shannon-Weiner指数比较
2.3非NEC组、NEC急性期和恢复期组前三位纲水平肠道菌群的相对丰度比较 各组变形菌门、厚壁菌门、拟杆菌门的相对丰度比较差异有统计学意义(P<0.01),NEC急性期组变形菌门、厚壁菌门相对丰度高于非NEC组,而拟杆菌门相对丰度低于非NEC组(P<0.05);NEC恢复期组变形菌门、拟杆菌门相对丰度均低于非NEC组和NEC急性期组,而厚壁菌门相对丰度高于非NEC组(P<0.05),见表3。
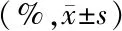
表3 非NEC组、NEC急性期和恢复期组前三位纲水平肠道菌群的相对丰度比较
2.4非NEC组、NEC急性期和恢复期组前三位种属水平肠道菌群的相对丰度比较 各组大肠埃希菌-志贺菌属相对丰度比较差异无统计学意义(P>0.05),克雷伯菌属和肠杆菌属比较差异有统计学意义(P<0.01),NEC急性期组克雷伯菌属相对丰度高于非NEC组,而肠杆菌属相对丰度低于非NEC组(P<0.05);NEC恢复期组克雷伯菌属相对丰度低于NEC急性期组和非NEC组,而肠杆菌属相对丰度高于NEC急性期组和非NEC组(P<0.05),见表4。
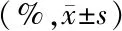
表4 非NEC组、NEC急性期和恢复期组前三位种属水平肠道菌群的相对丰度比较
2.5非NEC组、NEC急性期和恢复期组粪便HBD、AI-2水平比较 各组HBD1、HBD2及AI-2水平比较差异有统计学意义(P<0.05),NEC急性期组和NEC恢复期组HBD1、HBD2及AI-2水平均低于非NEC组(P<0.05);NEC恢复期组均低于NEC急性期组(P<0.05),见表5。

表5 非NEC组、NEC急性期组、NEC恢复期组粪便HBD1、HBD2、AI-2水平比较
3 讨 论
NEC是临床常见的、多种因素导致的儿科危重症,严重威胁患儿生命安全。目前,对于NEC发病机制的研究主要集中在肠道菌群紊乱、机体免疫、新生儿感染、喂养成分、缺血性损伤等方面,特别是患儿机体免疫力及日常喂养成分对NEC患儿的治疗和康复具有重要影响[13]。目前关于NEC患儿胃肠道菌群变化的研究较少,缺乏相关特异性指标,而早产儿因自身胃肠道发育极不成熟,更易发生NEC。Pammi等[14]研究发现,NEC患儿肠道菌群数量往往低于正常水平,同时产气荚膜梭菌、大肠埃希菌、艰难梭菌等非益生菌异常增殖进一步加重了NEC患儿的肠道菌群紊乱。本研究中,NEC组肠道菌群紊乱发生率高于非NEC组(P<0.05),表明NEC早产儿肠道菌群紊乱明显,肠道微生态可能参与NEC的发生、发展,NEC患儿肠道免疫功能和菌群平衡被打破,患儿更易感染病原微生物,进而加重肠道局部炎症反应,导致手术、死亡等不良转归。
Pammi等[14]研究发现,新生儿肠道紊乱与NEC的发病情况密切相关,拟杆菌门/属细菌的相对丰度变化对NEC疾病的发生发展具有一定作用。本研究参照付春燕等[15]研究方法继续予恢复期组患儿广谱抗生素治疗,通过分析早产儿肠道菌群的纲水平和种属水平菌群相对丰度情况发现NEC患儿的肠道菌群紊乱,益生菌与有害菌相对丰度失衡,拟杆菌门相对丰度远低于非NEC患儿,且纲水平和种属水平的Shannon-Weiner指数也有所下降,提示NEC患儿肠道菌群紊乱,NEC使早产儿肠道菌群结构严重破坏。本研究进一步分析急性期和恢复期NEC患儿肠道菌群发现,恢复期NEC患儿的肠道菌群仍明显紊乱,益生菌与有害菌相对丰度仍存在明显失衡,原因可能是恢复期广谱抗生素治疗导致NEC患儿肠道菌群多样性较非NEC患儿降低,且变形菌门、大肠埃希菌-志贺菌属、肠杆菌属等异常增殖,但具体原因有待后续研究的探讨。因此,可强化药物及饮食对恢复期NEC患儿肠道菌群的调节,以增加NEC患儿肠道菌群多样性,促进疾病的康复。
目前,HBD、AI-2等是临床针对肠道菌群紊乱研究的热点指标。HBD是一类小分子抗菌肽,与呼吸道、胃肠道感染等疾病密切相关。相关研究表明,HBD能与多种病原微生物结合,起到杀伤作用,进而维持肠道菌群数量的稳定[16]。另有研究表明,HBD能趋化巨噬细胞、单核细胞等多种免疫细胞,并借助Toll样受体4等多种识别受体调节机体免疫反应,进而改善肠道菌群紊乱,维持机体正常免疫功能[17-18]。AI-2是LuxS细菌基因编码产生的特殊信号分子,与细菌毒力、正常菌群定植、肠壁细胞增殖分化等密切相关。Christiaen等[19]研究表明,粪便AI-2水平与肠壁细胞结合力呈负相关,故补充AI-2可促进肠壁细胞结合力的恢复。Sun等[20]研究表明,AI-2可调节肠道菌群平衡和细菌毒力,促进NEC患儿康复,因此HBD、AI-2水平变化可能提示NEC转归。本研究结果显示,NEC急性期和恢复期的HBD1、HBD2、AI-2水平均低于非NEC组。甘馨[21]研究显示,NEC患儿的肠黏膜功能随疾病进展不断减弱,机体分泌HBD1、HBD2、AI-2能力下降,肠道菌群紊乱明显,临床针对性治疗可有效纠正肠道菌群紊乱,降低肠道炎症反应,使肠黏膜功能逐渐恢复,进而提高HBD1、HBD2、AI-2的分泌和释放。分析其原因可能为急性期HBD、AI-2水平降低与NEC早产儿肠道免疫功能下降和肠道菌群紊乱有关,患儿更易感染病原微生物,导致肠道局部炎症反应所致的损害加重;NEC恢复期HBD、AI-2水平未见明显恢复可能与NEC患儿治疗期间服用广谱类抗生素导致肠道菌群紊乱,影响HBD1、HBD2、AI-2释放有关,具体机制有待深入探究。
综上所述,NEC患儿AI-2及HBD的水平较低,AI-2及HBD可能成为监测NEC病情的潜在指标。因此,临床应加强早产NEC患儿HBD1、HBD2、AI-2水平的监测,及时纠正患儿临床症状,强化营养干预,调节肠道菌群构成,进而改善患儿预后。
