肺腺癌患者血清BUB1B表达水平与其临床病理特征和预后的相关性
2021-05-10高小燕江爱桂卢慧宇
高小燕,江爱桂,卢慧宇
(泰州市人民医院呼吸与危重症医学科,江苏 泰州 225300)
肺癌是全球男性恶性肿瘤的主要死因,女性恶性肿瘤的第二大死因,治疗难度大、病死率高,严重影响患者及其家庭的正常生活[1]。肺腺癌是肺癌最主要的类型之一,其发病极为隐匿,多数患者确诊时已为晚期而失去手术机会[2]。除手术治疗外,靶向治疗是肺腺癌最常用的治疗手段,由于个体差异较大,靶向药物的治疗有效率较低(仅10%)且极易耐受[3]。因此,探索肿瘤筛查、侵袭转移及预后判定的新靶点尤为重要。研究发现,纺锤体检测点蛋白BUB1B,又称BUBR1具有诱导纺锤体故障,引起细胞染色体不稳定性,导致癌变的作用[4]。BUB1B在多种肿瘤组织中呈高表达,如多发性骨髓瘤、胃癌、结肠癌[5-6],并与肿瘤的侵袭转移密切相关。陆展鹏[7]通过对TCGA数据库调取的501例肺腺癌组织中BUB1B表达情况进行分析发现,BUB1B信使RNA在肺腺癌患者癌组织中也呈高表达,可能成为肺腺癌患者预后的生物标志物,但其在血液中的表达情况尚不清楚。为进一步研究血清中BUB1B的表达情况、验证其评价化疗效果和预后的临床价值,本研究主要评估监测血清BUB1B对肺腺癌患者化疗效果及预后的临床意义。现报道如下。
1 资料与方法
1.1一般资料 选取2012年1月至2015年12月泰州市人民医院内科收治的100例Ⅲb/Ⅳ期无手术切除机会的肺腺癌患者作为肺腺癌组,选取同期100例健康体检者作为对照组。肺腺癌组男54例、女46例,年龄42~76岁,平均(63.8±7.0)岁;TNM分期:Ⅲb期62例、Ⅳ期38例。对照组男55例、女45例,年龄38~79岁,平均(64.1±8.7)岁。两组性别、年比较差异无统计学意义(P>0.05)。
1.2纳入与排除标准 纳入标准:①所有患者经影像学检查拟诊断肺癌,并经组织病理学确诊肺腺癌;②根据TNM分期标准[8]评价为Ⅲb或Ⅳ期,且失去手术机会者;③中性粒细胞绝对值≥7.5×109/L,血红蛋白≥90 g/L,肌酐清除率≥45 mL/min;血小板≥300×109/L;丙氨酸转氨酶<80 U/L;④临床资料完整;⑤患者均签署了知情同意书。排除标准:①合并严重的肝、肾等器官功能损害者;②入组前3个月内有放化疗史者;③存在基因突变者;④未完成随访者。
1.3治疗方法 顺铂联合培美曲塞(AP方案):疗程第1天静脉滴注培美曲塞,剂量标准为500 mg/m2;且第2天至第3天静脉滴注顺铂,剂量标准为75 mg/m2;21 d为1个周期,同时给予地塞米松、复合维生素、格拉司琼和甲氧氯普安预处理,并给予水化、利尿治疗。
1.4酶联免疫吸附测定法检测血清BUB1B表达 采集肺腺癌组患者治疗前1 d清晨空腹肘静脉血5 mL,对照组体检当日同方法采集血样5 mL,血样静置30 min后,4 ℃条件下以离心半径13.5 cm、1 000 r/min离心10 min,取血清,-80 ℃冰箱保存备用。采用人抗BUB1B抗体酶联免疫吸附测定试剂盒(英国Abcam公司生产,批号:ab70209)测定血清BUB1B表达水平,严格按照试剂盒说明书操作。
1.5疗效判断标准及随访 利用胸部CT观察化疗前1 d和化疗结束后1周患者病灶的变化情况,依据世界卫生组织实体瘤疗效评价标准[9]判定疗效:疾病进展、稳定、部分缓解、完全缓解,总有效率=(部分缓解例数+完全缓解例数)/总例数×100%。随访所有患者并记录患者生存时间等信息,生存时间分为入院接受治疗开始至患者死亡和入院接受治疗开始至患者失访前最后一次随访。
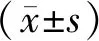
2 结 果
2.1两组治疗前血清BUB1B水平比较 治疗前,肺腺癌组血清BUB1B水平明显高于对照组[(145.8±11.8) μg/L比(21.0±3.3) μg/L](t=104.757,P<0.001)。
2.2BUB1B的表达水平对患者预后的预测效果 利用ROC曲线(治疗效果作为状态变量,BUB1B表达水平作为检测变量)分析预测效果显示,曲线下面积为0.804(95%CI0.757~0.851,P<0.001),经计算最佳临界值为148.05 μg/L,特异度为91.00%(91/100),灵敏度为81.00%(81/100),见图1。
2.3治疗前不同BUB1B表达水平肺腺癌患者的疗效 根据ROC曲线将肺腺癌组患者分为高表达组(BUB1B≥148.05 μg/L,43例)和低表达组(BUB1B<148.05 μg/L,57例),结果显示,低表达组患者治疗总有效率明显高于高表达组[63.16%(36/57)比18.60%(8/43)](χ2=19.745,P<0.001)。
2.4肺腺癌患者BUB1B表达的影响因素分析 以治疗前肺腺癌组患者血清BUB1B表达水平与临床资料进行单因素分析,结果显示,年龄≥60岁患者的BUB1B水平高于年龄<60岁患者,Ⅳ期患者BUB1B水平高于Ⅲb期患者,肿瘤直径<5.0 cm患者的BUB1B水平高于肿瘤直径≥5.0 cm患者(P<0.05),不同性别、有无吸烟史、是否转移、分化程度患者BUB1B水平比较差异无统计学意义(P>0.05)。以BUB1B高低表达为因变量,年龄(≥60岁=1,<60岁=0)、TNM分期(Ⅲb期=1,Ⅳ期=0)及肿瘤直径(≥5.0 cm=1,<5.0 cm=0)为自变量进行Logistic回归分析,结果显示,TNM分期及肿瘤大小是BUB1B高低表达的影响因素(P>0.05),见表1、2。
2.5肺腺癌患者生存分析 将本研究考察的所有因素设为自变量,对肺腺癌患者生存情况进行Cox回归分析,结果显示,血清BUB1B≥148.05 μg/L(RR=1.612,95%CI0.813~2.411,P=0.036)、伴有淋巴结转移(RR=0.501,95%CI0.148~0.854,P=0.022)是影响肺腺癌患者生存的独立危险因素(P<0.05)。随访观察两组患者的生存情况显示,治疗后BUBIB高表达组患者中位生存时间明显低于低表达组(3.475个月比5.904个月)(χ2=11.025,P=0.028),见图2。

图2 治疗后BUBIB基因高表达组和低表达组生存曲线
3 讨 论
美国癌症学会官方期刊发表的《2018年全球癌症统计数据》[10]显示,2017年全球1 800万新增癌症病例及960万癌症死亡病例中,我国新增病例数占380.4万例、死亡病例数占229.6万例,均居全球第一,其中肺癌是我国恶性肿瘤发病率最高的癌症类型。化疗是目前临床常用的治疗无法手术肺癌的手段,但个体差异较大,化疗效果往往难以预测,故探究可预测药物疗效的预测因子具有重要的临床意义。血清学标志物具有创伤小、易操作、价格低等优点,在监测肺癌化疗疗效上受到广泛关注[11]。有研究表明,β-微管蛋白、核糖核苷酸还原酶M1、切除修复交叉互补基因1可分别用于预测纺锤体抑制剂、吉西他滨、铂类等化疗药物疗效[12-14],但尚未得到临床证实。
有丝分裂是维持机体细胞正常增殖的重要生物学进程,其检测点是调节该进程的最核心的部位,大量研究发现,许多疾病(如肿瘤、高血压)的发生发展均与其检测点发生异常密切相关[15-16]。目前已发现的有丝分裂检测点蛋白有BUB1B、BUB3、有丝分裂阻滞缺陷蛋白2以及细胞分裂周期蛋白20等[17-19]。其中BUB1B在肺癌、多发性骨髓瘤、胃癌、结肠癌等肿瘤中均呈过表达,在肿瘤发生发展中具有重要作用,但在肺癌患者血清中的表达情况及其对化疗效果的预测价值目前国内外报道较少。Fu等[20]的研究显示,与良性前列腺细胞和组织相比,前列腺癌细胞系和肿瘤组织中BUB1B mRNA和蛋白表达均显著升高;体外研究表明,过表达BUB1B增强了前列腺癌细胞系的增殖、迁移和侵袭能力,而消耗BUB1B则不影响细胞功能,提示BUB1B可能对促进肺癌细胞转移和肿瘤生长具有重要作用,但具体机制尚不清楚,需进一步研究。本研究中,肺腺癌组患者血清BUB1B水平较对照组明显升高,且TNM分期越晚、肿瘤越大肺腺癌患者的血清BUB1B水平越高。
顺铂联合培美曲塞(AP方案)是治疗肺腺癌的主要化疗方案之一,中国临床肿瘤学会原发性肺癌诊疗指南(2018版)中也将AP方案作为肺腺癌患者的一线治疗方案[21]。因此,本研究选择AP方案化疗患者来考察BUB1B预测化疗效果和预后价值。BUB1B过表达与肿瘤侵袭转移以及患者预后有关[22],肺腺癌是转移性疾病,预后较差,但其肿瘤进展机制尚不清楚。Chen等[22]研究发现,敲除BUB1B蛋白基因后可显著抑制肺腺癌细胞系的锚定非依赖性生长。同种异体移植和小鼠模型研究发现,抑制BUB1B表达可抑制原发性肿瘤生长,减少了其向淋巴结的转移,从而延长肿瘤患者的生存期。BUB1B的N端是癌细胞不依赖锚定的生长和失衡抗性功能所必需的激酶结构域,抑制BUB1B表达可阻碍癌细胞的生长和转移[23]。
丁华杰等[24]研究显示,候选基因BUB1B在肺腺癌患者细胞中表达显著升高,可能与BUB1B促进肺癌细胞生长、转移有关。本研究结果显示,预测肺腺癌患者预后的最佳血清BUB1B临界值为148.05 μg/L,可预测肺腺癌患者预后。低表达组患者治疗总有效率明显高于高表达组,表明高表达BUB1B的肺腺癌患者可能对AP方案产生抵抗;Cox模型分析显示,血清BUB1B≥148.05 μg/L、伴有淋巴结转移可能是影响肺腺癌患者生存时间的独立危险因素,提示该类患者生存期可能较短。本研究存在化疗方案单一、样本量有限等不足,研究结果仍需要大样本多中心研究的进一步证实。
综上所述,晚期肺腺癌患者血清BUB1B水平较健康人群明显升高,与肺腺癌患者的生存时间和临床病理特征密切相关,可作为预测肺腺癌监测的临床病理特征和预后的生物学指标。
