等离子体对鹰嘴豆分离蛋白溶解性和乳化特性的影响
2021-05-09田金凤郑思雨贺雅玥相启森白艳红
李 可,田金凤,郑思雨,贺雅玥,相启森,白艳红※
(1. 郑州轻工业大学食品与生物工程学院,郑州 450001;2. 河南省冷链食品质量安全控制重点实验室,郑州 450001)
0 引 言
鹰嘴豆(Cicer arietinum L.)因外形似鹰嘴得名,是世界第三大消费豆类,营养含量丰富均匀,相比动物蛋白而言价格低廉、方便储藏且具有可持续性[1]。目前鹰嘴豆在市面上被称为网红豆,主要以原料进行售卖,而鹰嘴豆相关深加工产品非常少,因此,加大鹰嘴豆品质特性及功能特性研究对于鹰嘴豆资源的开发与利用具有重要意义。鹰嘴豆中蛋白质含量丰富(18%~30%),是膳食蛋白的良好来源,氨基酸组成均衡,具有较高的生物利用率及良好的消化性[2-3],在膳食添加剂及功能性食品方面应用广泛,但因其溶解性、乳化性能较差不能满足现代食品工业的需要,限制了在实际生产加工中的应用[4-5]。近几年,开发新型非热加工技术如超声波、微流化技术、等离子体等修饰蛋白质结构和改善其功能特性已成为农产品加工领域研究热点之一[6-10],然而,关于鹰嘴豆分离蛋白功能特性的改性研究仍然较少[5]。
低温等离子体(Cold Plasma,CP)通常被称为物质的第四种状态,可利用不同载气系统(空气、氮气、氩气等),经大气压射流放电、介质阻挡放电、微波放电、滑动电弧等不同方式放电产生,是一种整体呈电中性的电离气体,包括处于基本态和激发态的电子、离子和中性粒子等,活性粒子之间发生碰撞产生活性物质,进而引发各种化学反应以修饰改善食品的功能特性[9-12]。季慧等[13-14]使用低温等离子体技术对花生蛋白进行改性,其中研究发现处理后花生蛋白的α-螺旋和β-折叠含量减小,有序结构被破坏,与未处理组相比,溶解度及持水性分别提高了24.8%及79.6%[13];Sharifian等[15]利用介质阻挡放电等离子体对牛肉肌原纤维蛋白处理0、10、15、20 min后发现,短时间的处理会使蛋白质分子展开,表面疏水性增加,乳化活性及乳化稳定性在处理10 min时达到最大值,但随着时间的延长,自由巯基含量减少、羰基含量增加,起泡性能变差;Nadia等[16]发现经等离子体技术处理乳清蛋白15 min后,蛋白的二、三级结构发生改变,明显改善了乳清蛋白的起泡能力及起泡稳定性。上述研究表明,等离子体技术在修饰改善蛋白理化及加工性能方面表现出巨大潜力,且蛋白不同,作用效果存在明显差异。目前关于等离子体处理对鹰嘴豆分离蛋白结构和功能性质以及它们之间相关性的研究未有报道,因此本文利用介质阻挡放电(Dielectric Barrier Discharge,DBD)等离子体处理鹰嘴豆分离蛋白(Chickpea Protein Isolates,CPI),研究等离子体处理对CPI溶解性、乳化特性和结构的影响,并进一步分析等离子体处理后CPI结构与功能的相互联系,为拓宽豆类在食品加工中的应用前景提供理论支撑。
1 材料与方法
1.1 材料与试剂
卡布里鹰嘴豆,购于宁夏自治区固原市;金龙鱼大豆油,益海嘉里金龙鱼粮油食品有限公司;磷酸盐缓冲液(Na2HPO4/NaH2PO4)、二硫苏糖醇(DL-Dithiothreitol,DTT)、8-苯胺-1-萘磺酸(8-Anilino-1-Naphthalenesulfonic acid,ANS)、5,5'-二硫代双(2-硝基苯甲酸)(5,5'-Dithiobis-(2-Nitrobenzoic Acid),DTNB)、乙二胺四乙酸(Ethylenediaminetetraacetic Acid,EDTA)、十二烷基硫酸钠(Sodium Dodecyl Sulfate,SDS)和三羟甲基氨基甲烷(Tris)等试剂均为分析纯及以上。
1.2 仪器与设备
APM-400低温等离子体杀菌机,韩国PSM公司;JA3003N电子分析天平,上海菁海仪器有限公司;TU-1810紫外分光光度计,北京普析通用仪器设备有限公司;LE438PH计,梅特勒-托利多仪器有限公司;DF-101S磁力搅拌器,河南省予华仪器有限公司;Lab-1-50冷冻干燥机,北京博医康实验仪器有限公司;F-7000荧光光度计,日本日立公司;BIO-RAD 凝胶成像仪,美国伯乐公司;Chirascan 圆二色谱仪,英国应用光学物理公司;Regulus 8100冷场发射扫描电镜,日本日立有限公司。
1.3 方法
1.3.1 鹰嘴豆分离蛋白的制备
参考Wang等[5]方法,将鹰嘴豆在50 ℃下烘干至质量恒定,含水率为3.91%,粉碎过80目筛,将鹰嘴豆原粉与正己烷按照质量体积比1∶10混合均匀,搅拌2~3 h获得沉淀,重复上述步骤后将收集的沉淀置于通风橱12 h后得脱脂粉。将脱脂粉与去离子水按照质量体积比1∶8混合,用2 mol/L的NaOH将pH值调至9.0,在6 000 r/min下离心15 min,取上清液后用1 mol/L的HCI将pH值调至4.9,在6 000 r/min下离心15 min,获取沉淀后将pH值调至7.0,透析。将透析后的样品置于冷冻干燥机预冻3 h,后抽真空至箱体真空度达约40 Pa后,拧紧阀门,继续冷冻干燥15 h后即获得鹰嘴豆分离蛋白(Chickpea Protein Isolates,CPI)样品。
1.3.2 介质阻挡放电等离子体处理
将鹰嘴豆分离蛋白溶解在去离子水中,质量浓度为0.03 g/mL,室温搅拌2~3 h后将溶液放置在4 ℃下储存过夜(保证完全水合),利用低温等离子体设备APM-400M处理(图 1),载气为氮气(流速为350 L/min)电极温度75 ℃,电压8 kV。取20 mL溶液于等离子体设备下处理0、1、2、3、4 min,温度控制在(25±2)℃。CPI溶液经等离子体处理后,一部分溶液平衡温度后直接进行指标测定,剩余溶液冷冻干燥备用。
1.4 pH值、电导率、粒径
等离子体处理后的溶液置于4 ℃冰箱平衡20 min,保证温度均匀一致后利用pH计、电导率仪分别测定样品的pH值和电导率。利用去离子水将CPI溶液稀释至1 mg/mL,用粒度仪测定样品粒径,每个样品测量3次。
1.5 功能特性
1.5.1 溶解性
样品溶解性的测定参考Wang等[5]的方法,稍作修改,配置10 mg/mL的CPI溶液,在10 000 r/min离心15 min,将1 mL上清液加入到4 mL双缩脲试剂中,经涡旋充分混合后避光反应30 min后,用紫外分光光度计在540 nm处测定CPI溶液的吸光度。
1.5.2 乳化特性
参考Nadia等[16]的方法,利用去离子水配制0.01 g/mL的CPI溶液,加入5 mL的大豆油,在高速分散器下以10 000 r/min,分散2 min后从底部吸取50μL乳液加到0.001 g/mL,5 mL SDS溶液中,涡旋均匀后在500 nm处测得吸光度A0,乳液静置10 min后,再次从底部吸取50μL乳液加到SDS溶液中,混合均匀后在500 nm处测得吸光度A10。按公式(1)、(2)计算CPI的乳化活性指数(Emulsion Ability Index,EAI)及乳化稳定性指数(Emulsion Stability Index,ESI)
式中N为稀释倍数;C为鹰嘴豆分离蛋白质量浓度,mg/mL;ω为油体积分数,本文取20%。
1.6 结构指标
1.6.1 SDS-PAGE
制备质量分数为12%分离胶和 5%浓缩胶,将20μL、2 mg/mL的CPI溶液分别加至20μL还原液(含DTT)、非还原液(含DTT)中,100 ℃下水浴5 min。上样量为10μL,在80 V下电泳20 min,110 V电泳1.2 h,利用考马斯亮蓝R-250染色30 min,置于脱色液中脱色至背景透明,利用凝胶成像仪成像。
1.6.2 圆二色谱
利用磷酸盐缓冲液(10 mmol/L,pH值为7.0)将CPI溶液稀释至0.1 mg/mL,磷酸盐缓冲液作为空白组,光谱测量范围190~260 nm,带宽1.0 nm下对CPI进行测定,每个样品重复3次。利用CDNN软件对α-螺旋,β-折叠,β-转角和无规卷曲具体含量进行分析。
1.6.3 表面疏水性
参考Sharifian等[15]的方法,稍加修改,利用磷酸盐缓冲液(10 mmol/L,pH值为7.0)将CPI溶液稀释至1 mg/mL,而后分别稀释至0.200,0.100,0.050,0.025,0.005 mg/mL。用磷酸盐缓冲液(0.01 mol/L,pH值为7.0)配置8 mmol/L ANS荧光探针溶液,取30μL ANS溶液加至不同浓度梯度CPI溶液中,用荧光分光光度计测量荧光值。激发波长385 nm,发射波长490 nm。通过线性回归分析将荧光强度和蛋白浓度的初始斜率作为表面疏水性。
1.6.4 自由巯基
利用Tris-HCl缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸和0.004 mol/L EDTA,后用1 mol/L HCl将上述混合液调至pH值为8.0)配置2 mg/mL的CPI溶液,10 000 r/min下离心15 min,取50μL、4 mg/mL的DTNB加到5 mL的CPI上清液中,混匀避光反应15 min后,以Tris-HCl缓冲液为空白,在412 nm处测定吸光度As[5,15]。计算公式如下
式中D为溶液稀释倍数;A为As-A1所得数值;A1为CPI溶液在412 nm处的吸光度;As为CPI加入DTNB后在412 nm处的吸光度;C为鹰嘴豆分离蛋白质量浓度,mg/mL。
1.6.5 微观结构
鹰嘴豆分离蛋白经等离子体处理后,在4 ℃冰箱平衡后置于冷冻干燥机,运行18 h对样品进行冷冻干燥。将样品通过导电胶带粘附在扫描电镜样品台上,喷金处理60 s后在5 kV 电压下观察CPI的微观形貌。
1.7 数据处理
所有试验重复3次,结果用平均值±标准差表示。利用SPSS 22.0软件进行单因素方差分析(ANONA)、Pearson’s相关性分析对数据进行统计分析,采用Duncan’s检验方法作多重比较,字母不同表示差异显著(P< 0.05);利用Origin 2019软件对数据进行主成分分析。
2 结果与分析
2.1 DBD等离子体对CPI 的pH值及电导率的影响
等离子体处理对鹰嘴豆分离蛋白pH值及电导率影响如图2所示,等离子体处理后溶液的pH值明显下降,经等离子体处理4 min后,蛋白溶液的pH值由6.98降至6.58(P< 0.05)。这是由于等离子体产生的活性物质如活性氧(Reactive Oxygen Species,ROS)及活性氮(Reactive Nitrogen Species,RNS)等会直接或间接参与氧化营造酸性环境[17],如NO氧化NO2进而氧化生成HNO2、HNO3等,此外活性物质通过水分子与空气或液体中产生的H2O2反应生成H3O+,也是导致pH值降低的一个重要因素[13]。与未处理样品相比,电导率由388上升至470μS/cm(P< 0.05),电导率的上升是因为分子受到高能辐射、放电时会发生电离,在这些过程中,大量带电粒子,如离子、电子和自由基在样品系统或溶液上方的气相中被电离,导致电导率提高[18]。
2.2 DBD等离子体处理对CPI粒径的影响
图3是不同等离子体处理时间对CPI粒径的影响,由图3可以看出,随着等离子体处理时间的延长,CPI溶液的平均粒径从477 nm降至418 nm(P< 0.05),在4 min时粒径最小,这可能是因为等离子体作用于蛋白溶液的过程中,高能粒子会削弱蛋白分子胶束间的作用力,裂解大的胶束聚集体,使蛋白质间聚集度下降,粒径减小[16,18]。另外,等离子体产生的冲击波也是造成蛋白溶液粒径减小的一个原因[19]。
2.3 DBD等离子体对CPI溶解性和乳化特性的影响
溶解性是研究蛋白质功能特性的前提基础,在现代食品工业中发挥着重要作用,溶解性一方面依赖于蛋白质自身特定结构,另一方面会受到外界环境因素如pH值、温度及离子强度等的影响[18,20]。表1是等离子体处理不同时间下鹰嘴豆分离蛋白溶解性变化,随着处理时间的延长,溶解性从75.60%增加到92.90%(P< 0.05),与未处理组相比,溶解度提高了22.88%,这与Ji等[21]研究结果类似,等离子体处理1.5 min后,花生蛋白浓度从3.41 mg/mL增加到4.17 mg/mL,增加了22.28%。本研究中,鹰嘴豆分离蛋白经等离子体处理不同时间后,pH值从6.98下降到6.58(图 2a),虽然pH值趋势是下降,但相比鹰嘴豆分离蛋白的等电点(pH值为5.0)而言,等离子体处理4 min后,溶液的pH值仍是远离蛋白等电点的状态。当pH值远高于等电点时,蛋白质带足够负电荷,带电氨基酸残基的静电排斥和水合作用保证了蛋白质的溶解,本文中等离子体处理引起的pH值略微下降对溶解性的影响较小。另一方面,除了pH值,影响蛋白溶解度还有其他因素,如粒径、表面性质[19]。等离子体处理后,蛋白粒径减小(图3),这说明蛋白分子在等离子体放电过程中解聚展开,蛋白胶束表面的活性位点暴露的更多,增强了与水分子间的相互作用。鹰嘴豆蛋白电导率增加(图2b),蛋白表面极性发生改变,静电排斥和水化作用会促进蛋白质的溶解[21],此外,等离子体作用产生的活性物质在蛋白表面形成新的含氧及含氮基团也会影响蛋白溶解性[19]。
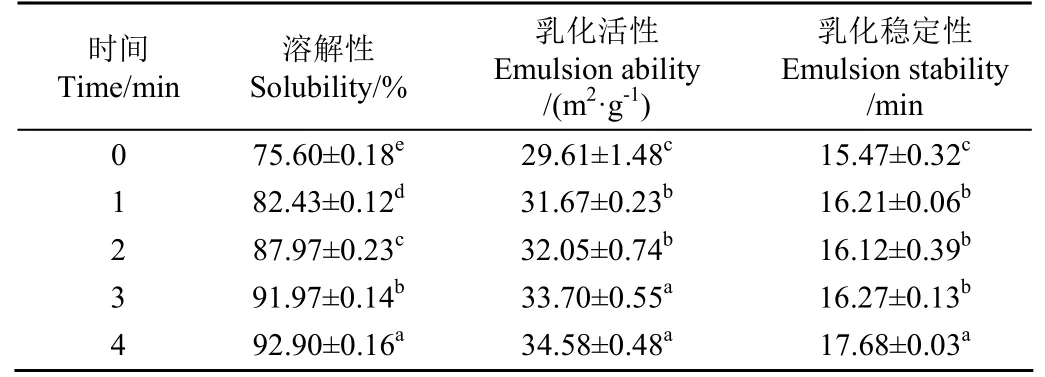
表1 DBD等离子体处理对CPI溶解性、乳化活性及乳化稳定性的影响Table 1 Effects of DBD plasma treatment on solubility,emulsifying activity and stability of CPI
乳化特性是表征蛋白质形成及稳定乳液能力的一种度量方式,在乳化过程中,蛋白质的疏水区域聚集于油相(疏水相),亲水区域聚集于水相[22]。由表2可以看出,等离子体处理4 min后,乳化活性指数从最初的29.61 m2/g增加到34.58 m2/g(P< 0.05),乳化稳定性也显著增加(P<0.05)。等离子体处理会解离蛋白质聚集体,使得粒径较小(图3)的蛋白质更容易吸附在油水界面,提高乳化活性。Sharifian等[15]研究表明,肌原纤维蛋白经等离子体处理10 min后,乳化活性及乳化稳定性都得到了明显的改善,但随着处理时间延长到20 min,乳化性能下降,表明短时间的处理可以改善蛋白的功能性质。
2.4 DBD等离子体对CPI的SDS-PAGE结果分析
鹰嘴豆分离蛋白的11S球蛋白亚基主要出现在10~14 kDa、40~41 kDa,7S球蛋白亚基主要在15~18 kDa、30~34 kDa、64~72 kDa[23-24]。由图4可以看出,在还原和非还原条件下等离子体处理后蛋白的主要条带未发生变化,说明等离子体处理并未改变蛋白质亚基的组成成分、种类[25],但从图中可以明显看出,7S和11S球蛋白亚基条带强度增加,这表明等离子体处理主要影响了CPI中7S和11S球蛋白性质,这也与蛋白溶解性增加(表1)有关。此外,与非还原相比,在还原条件下,由于DTT的加入破坏了二硫键,使蛋白质聚集体及聚合物被解聚成较小的多肽,造成条带增多[5]。
2.5 DBD等离子体对CPI二级结构的影响
表2 所示是等离子体处理不同时间对鹰嘴豆分离蛋白二级结构的影响,与对照组相比,随着处理时间的延长,α-螺旋含量从39.37%逐渐增加到42.45%,β-折叠含量从12.34%减小至10.58%,(P< 0.05),无规卷曲含量减小(P> 0.05)。β-折叠是由肽链间的氢键维持,β-折叠含量的降低可能是因为等离子体作用破坏了部分氢键,导致肽链展开,构象变得疏松,水分子更易进入蛋白质分子内部,增强了蛋白质与水分子之间的相互作用,同时β-折叠含量的降低表明分子内的疏水位点暴露[26-27],导致表面疏水性增加(图5)。松散的构象易使水分子进入蛋白质分子内部形成氢键,导致α-螺旋含量发生变化[28-29],另外CPI自身含有高含量的谷氨酸、亮氨酸等,这些氨基酸有利于α-螺旋的形成,使得CPI构象向更加有序、稳定的二级结构进行转变[29]。Dong等[30-31]研究等离子体处理玉米醇溶蛋白,认为活性物质通过氧化蛋白质,改变了蛋白质的二级结构,从而提高了玉米醇溶蛋白的水溶性。
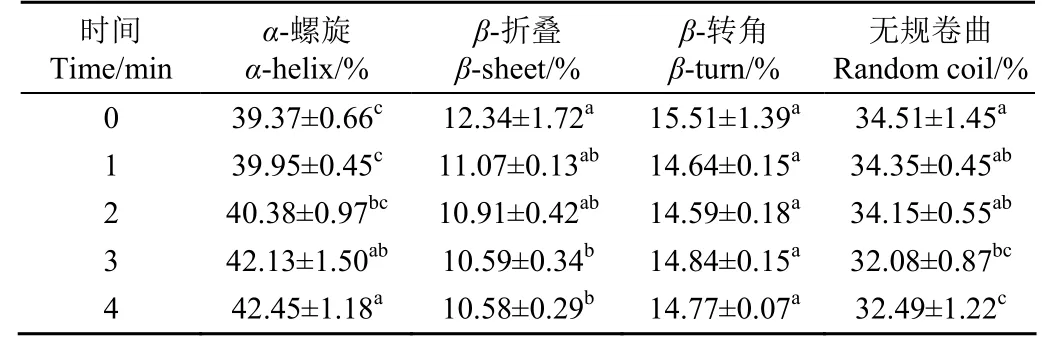
表2 DBD等离子体处理对CPI二级结构的影响Table 2 Effects of DBD plasma treatment on the secondary structure of CPI
2.6 DBD等离子体对CPI表面疏水性的影响
表面疏水性是表征蛋白质三级结构变化的重要指标,研究表明,大多数疏水性残基埋藏于蛋白质的内部,少部分则暴露在分子表面[32]。等离子体处理不同时间对蛋白表面疏水性的影响如图5所示,与空白组相比,随着处理时间的延长,表面疏水性从1 536显著增加至1 777(P< 0.05)。等离子体处理过程中产生的活性自由基会氧化蛋白质,使蛋白质聚集体或亚基结构解离[32-33],埋藏在内部的疏水基团暴露出来,更易与8-苯胺-1-萘磺酸(8-Anilino-1-Naphthalenesulfonic acid,ANS)结合增加蛋白表面疏水性[34-35]。蛋白疏水性的增加有利于蛋白分子更加牢固的吸附在油滴表面,促进蛋白乳化稳定性的提高(表 1)。另外,蛋白表面疏水性增加,并不影响蛋白溶解性的升高。等离子体处理后,蛋白质结构会发生变化,并不仅仅是埋藏在内部的疏水基团暴露出来,亲水性基团也会增加,同时粒径减小与电导率增加,促进蛋白质与水分子之间的相互作用,进而有利于溶解度的提高。Hamed等[19]研究表明等离子体处理增加了蛋白的表面疏水性,同时随着等离子时间延长,溶解性显著增加。相比表面疏水性对溶解性的作用,蛋白质粒径在促进溶解性上占主导作用[19]。Dong等[18]也发现类似结果。
2.7 DBD等离子体对CPI自由巯基的影响
自由巯基是蛋白质表达功能性质的重要活性基团,巯基和二硫键之间的转换可以用来描述蛋白质构象的变化[35-37]。由图6可以看出,与未处理相比,等离子体处理后自由巯基的含量显著增加(P< 0.05),等离子体处理改变了CPI分子粒径大小(图3),蛋白分子间作用力减弱,等离子体放电过程中产生的羟基自由基及氧自由基等高能粒子作用在蛋白质溶液表面时,蛋白分子结构变得更为松散,内部隐藏的一些巯基逐渐暴露,造成自由巯基含量的增加[37-38]。Ji等[21]等研究等离子体处理蛋白后,自由巯基先降低再升高,产生不同结果的原因可能是设备条件(时间、电压)差异及不同载气系统所产生活性氧、活性氮的差别。
2.8 DBD等离子体对CPI微观结构的影响
等离子体处理后CPI微观结构如图7所示。未处理组以片状形式存在,表面更为平整均匀,这与Wang等[5]研究结果类似。经等离子体处理后,样品虽仍以片状形式存在,但表面出现了不同程度的破碎且随着时间的增加表现出较强的松散及破裂程度,处理4 min时样品的表面破裂程度最大,等离子体对CPI微观结构的影响与上述粒径变化(图3)吻合。这是由于等离子体在放电过程中产生的电子、离子及其他高能粒子会以空气为介质传递到蛋白质分子表面,造成蛋白质聚集体解离,显著改变CPI微观形貌,使得蛋白样品表面破裂,呈现出更为松散的状态[39-42]。
2.9 DBD等离子体对CPI的相关性分析
利用Pearson分析法对等离子体处理后CPI的溶解性、乳化特性和结构之间进行相关性分析。如表3所示,各指标间存在不同的相关性。CPI的粒径与溶解性(r=-0.974,P< 0.01)和EAI(r= -0.984,P< 0.01)之间呈极显著负相关,表明平均粒径较低的CPI具有更好的溶解性和乳化活性。EAI与蛋白的α-螺旋含量、表面疏水性之间呈极显著正相关(P< 0.01),与自由巯基含量呈显著正相关(P< 0.05),这可能是由于等离子体处理后,CPI发生解折叠,蛋白结构的变化更有利于蛋白分子扩张并更加牢固的吸附在油滴表面,从而促进蛋白乳化特性的提高,同时CPI溶解性与EAI(r=0.983,P< 0.01)之间呈极显著正相关,说明蛋白溶解性的提高也有利于乳化特性的改善。由相关性分析可知,等离子体处理后CPI的结构变化与其溶解性和乳化特性的提高密切相关。
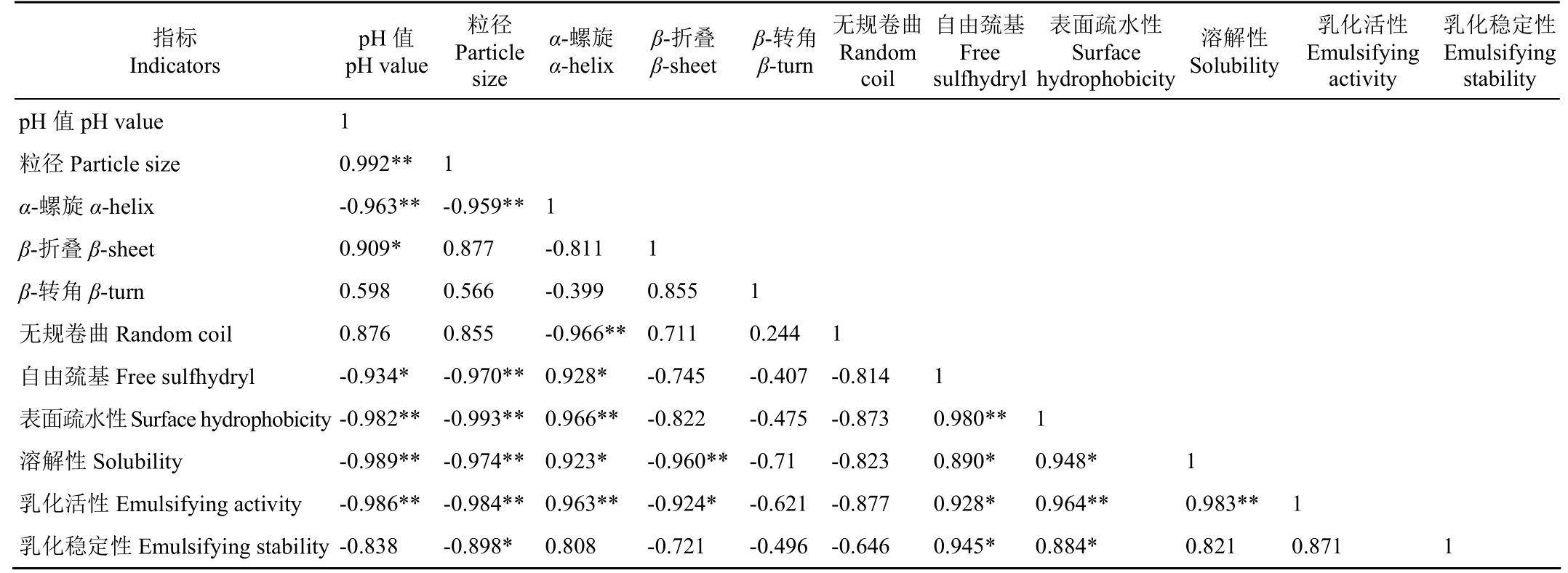
表3 DBD等离子体处理对CPI各项指标的相关性分析Table 3 Correlation analysis of CPI various indexes by DBD plasma treatment
2.10 DBD等离子体处理对CPI的主成分分析
利用主成分分析进一步分析了等离子体处理不同时间对CPI结构、溶解性和乳化特性的影响。结果如图8a所示,主成分1累计贡献率为85.98%,主要与自由巯基、表面疏水性、溶解度、乳化活性、乳化稳定性等因子有关,主成分1与以上因子呈正相关关系,主成分2累计贡献率为9.54%,主要与α-螺旋、β-转角、β-折叠、表面疏水性、自由巯基等因子有关且呈正相关。在图8b中,于主成分1平面而言,空白对照组及等离子体处理1、2 min等因子分布在主成分1左侧,等离子体处理3、4 min的因子分布在右侧,因此延长等离子体处理时间至4 min对CPI的结构、溶解性、乳化特性具有更显著的影响[43]。
3 结 论
本文应用介质阻挡放电等离子体对鹰嘴豆分离蛋白进行改性处理。研究表明:
1)等离子体释放出的高能粒子会破坏分子间的作用力,使蛋白间的聚集度下降,粒径减小,增强蛋白质与水分子的水合作用,蛋白溶解性从75.60%显著增加到92.90%(P< 0.05),与未处理组相比,溶解性提高了22.88%。
2)等离子体产生的活性物质会使蛋白质轻度氧化导致蛋白质部分解折叠,使埋藏在内部的疏水基团及更多的活性位点被暴露出来,有利于蛋白分子更加牢固的吸附在油滴表面,CPI的乳化活性指数从最初的29.61 m2/g增加到34.58 m2/g(P< 0.05),乳化稳定性也显著增加(P< 0.05)。
3)等离子体处理后,CPI的二级结构发生改变,等离子体作用破坏了部分氢键,导致肽链展开,构象变得疏松,水分子更易进入蛋白质分子内部,增强了蛋白质与水分子之间的相互作用,表面疏水性及自由巯基等三级结构的变化进一步促进蛋白功能特性的改善。
4)等离子体处理作为一种新型改性技术,在提高蛋白功能性质方面发挥重要作用,CPI经等离子体处理4 min后,溶解性及乳化特性均得到明显改善,对于开发良好性能的新型产品及指导实际生产实践具有重要意义。
