NLRP3 和Caspase-1 在颞下颌关节骨关节炎滑膜中的表达
2021-05-09李艳艳冯亚平
李艳艳, 冯亚平, 柯 金, 龙 星
(武汉大学口腔医院口腔颌面外科,湖北 武汉 430079)
颞下颌关节骨关节炎 (temporomandibular joint osteoarthritis,TMJOA)是一种以关节软骨破坏、软骨下骨退行性改变和滑膜炎症为主要病理特征的慢性疾病,会导致关节区疼痛、张口受限,甚至面部畸形,严重影响患者的日常生活[1]。 近来的研究表明,滑膜炎与关节软骨及软骨下骨的退行性病变密切相关[2-3]。 因此,研究TMJOA 患者滑膜炎性分子表达的变化也尤为重要。
NLRP3 炎症小体 (NACHT,LRR and PYD domains-containing protein 3 inflammasome)是NOD 样受体 (nucleotide-binding oligomerization domain-like receptors,NLRs)家族的重要成员,存在于细胞质中。NLRP3 炎症小体由NLRP3、 凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)和胱天蛋白酶-1(cysteinyl aspartate specific proteinase,Caspase-1)前体3 种蛋白组成。 NLRP3 受到刺激,构象发生改变而活化, 与ASC 通过热蛋白结构域连接,招募pro-Caspase-1 通过胱天蛋白募集域连接ASC和pro-Caspase-1, 产 生 活 化 的Caspase-1 p10 和Caspase-1 p20, 随后将pro-IL-1β 和pro-IL-18 剪切为活化和分泌形式的IL-1β 和IL-18,细胞因子启动或者扩增不同的下游信号通路,导致炎症的级联放大[4]。 NLRP3 炎症小体的活化在许多疾病,如IgA 肾病和类风湿关节炎(rheumatoid arthritis,RS)等的病理发展中发挥着重要的作用[5-6]。 然而,目前还不清楚在TMJOA 滑膜炎中是否涉及NLRP3/Caspase-1/IL-1β 轴的活化。 因此,本实验将对颞下颌关节滑膜细胞中的NLRP3 和Caspase-1 的表达进行研究,以期进一步阐明TMJOA 的分子机制。
1 材料和方法
1.1 材料
1.1.1取材 在患者知情同意情况下采集滑膜样本,研究方案经武汉大学口腔医院批准。 取8 例根据临床表现、 口腔检查和影像学检查确诊为TMJOA,并需要进行关节手术患者的滑膜组织,其中男性,3 例,女性,5 例,另取3 例髁突肥大患者的滑膜组织作为对照组,患者年龄均在20~55 岁。
1.1.2主要试剂 磷酸盐缓冲液 (phosphate buffer saline,PBS)、高糖培养基(Dulbecco′s modified eagle medium,DMEM)、胎牛血清(Hyclone 公司,美国);RIPA(radio immunoprecipitation assay)裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液(Biosharp 公司,中国);逆转录试剂盒、Trizol 试剂(TaKaRa 公司,日本);兔抗NLRP3 单克隆抗体、 兔抗Caspase-1 单克隆抗体和羊抗兔二抗(Abcam 公司,美国);鼠抗肌球蛋白(β-actin)多克隆抗体和羊抗鼠二抗(武汉三鹰生物技术在限公司, 中国); 增强发光法 (enhanced chemiluminescenece,ECL)显影液(上海碧云天公司,中国)。
1.2 方法
1.2.1滑膜细胞的培养 根据蔡恒星等[7]的经验方法进行滑膜细胞分离和培养,注意无菌操作。 具体步骤: 用含100 U/mL 链霉素和100 mg/L 青霉素的无菌PBS 冲洗取材组织,直至溶液澄清。 将其剪成1 mm×2 mm 大小的组织块, 置于25 mL 培养瓶的瓶底, 使其分散均匀。 用含有20%胎牛血清的DMEM 培养基润湿组织块, 于37 ℃、95%O2和5%CO2培养箱中培养。定期观察并换液,待细胞生长融合至密度达80%左右进行传代。
1.2.2实时定量聚合酶链式反应 (real-time quantitative polymerase chain reaction,RT-PCR)法测定滑膜组织中NLRP3 和Caspase-1 mRNA 的表达 取培养3 代以内的滑膜细胞,PBS 冲洗3 遍后加入Trizol试剂,置于摇床上5 min,将提取的总RNA 转移到无酶微型离心管中并检测纯度,按照逆转录试剂盒上的说明合成模板cDNA,使用SYBR Premix Ex Taq进行RT-PCR。 引物以β-actin 为内参,引物序列见表1。反应条件:①95 ℃30 s;②PCR 反应,GOTO:39(40 Cycles),60 ℃30 s;③熔解曲线,每例样品设置3 个平行复孔, 按照2-ΔΔCt法获得滑膜细胞的NLRP3 和Caspase-1 基因表达量。

表1 RT-PCR 基因引物序列表Table 1 Primer sequences used for RT-PCR
1.2.3Western blot 检测滑膜细胞中NLRP3、Caspase-1 蛋白表达 取培养3 代以内的滑膜细胞,PBS 洗涤3 次,吸干,加入RIPA 裂解液反应,迅速刮下细胞转移到预冷离心管中,以上操作均在冰上进行。 在4 ℃下14 000×g离心10 min 收集蛋白,检测蛋白浓度。 加入SDS-PAGE 蛋白上样缓冲液,振荡器上振荡均匀,在95 ℃加热装置上变性蛋白。洗净并晾干玻璃板后垂直夹紧,放置并灌胶,待胶凝固后,每孔加入20 μg 的蛋白样品,然后电泳分离蛋白。 将蛋白从胶中电转移到聚偏二氟乙烯(poly-vinylidene fluoride,PVDF)膜 上。 根 据NLRP3、Caspase-1 和β-actin 的蛋白分子量将PVDF 膜切成条带, 置于洗净并标记好的盒子里,TBST 漂洗5 min。 加入封闭缓冲液室温摇动60 min,TBST 漂洗3 次, 每次5 min。按标记加入新鲜配制的一抗, 分别是兔抗NLRP3单克隆抗体(1∶1 000)、兔抗Caspase-1 单克隆抗体(1∶100)及鼠抗β-actin 多克隆抗体(1∶500),4 ℃中轻轻摇动过夜后,TBST 漂洗3 次,每次5 min。 加入新鲜配制的二抗,室温摇动60 min,TBST 漂洗3 次,每次5 min。 加入增强发光显影液ECL 后在扫描仪中成像, 用Image J 软件分析条带上的NLRP3 和Caspase-1 蛋白的相对表达量。
1.3 统计学分析
采用SPSS 20.0 软件进行统计学分析。 数据采用均数±标准差(±s)表示,用独立样本t检验比较两组的差异,P<0.05 为差异有统计学意义。
2 结果
2.1 RT-PCR 检测结果
RT-PCR 的结果见图1。 按照2-ΔΔCt法分析,NLRP3 和Caspase-1 mRNA 在TMJOA 滑膜细胞中的表达升高,差异有统计学意义(P<0.05)。
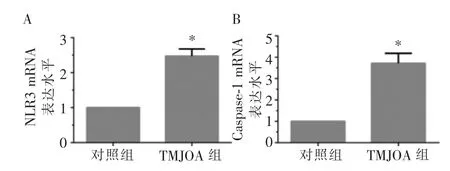
图1 RT-PCR 显示NLRP3 和Caspase-1 基因在颞下颌关节滑膜细胞中的表达量Figure 1 The gene expression level of NLRP3 and Caspase-1 in TMJ synovial cells by RT-PCR
2.2 Western blot 检测结果
Western blot 结果表明,TMJOA 滑膜细胞中NLRP3 和Caspase-1 的蛋白表达水平显著高于对照组,且差异有统计学意义(P<0.05,图2)。
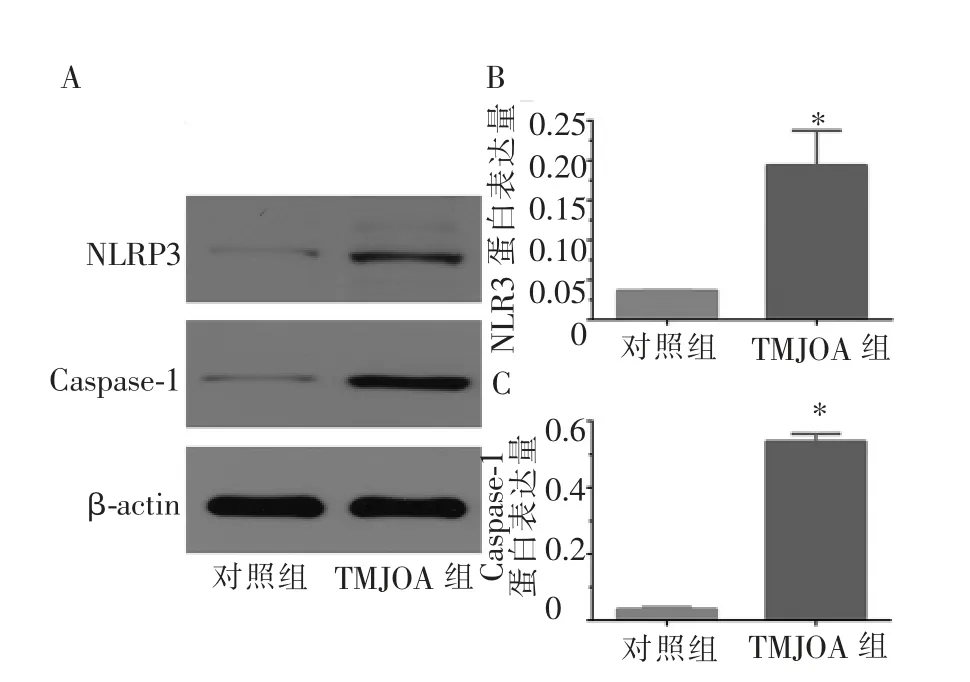
图2 Western blot 检测颞下颌关节滑膜细胞中NLRP3 和Caspase-1 的蛋白表达情况Figure 2 The protein expression of NLRP3 and Caspase-1 in TMJ synovial cells by Western blot
3 讨论
多项研究认为滑膜炎出现在TMJOA 的各个时期,并且是导致关节疼痛和下颌运动障碍的重要原因[8]。 滑膜炎产生一系列促炎细胞因子,其中IL-1β和TNF-α 是研究最为广泛的因子,在骨关节炎(osteoarthritis,OA)的滑膜、滑液、关节软骨和软骨下骨中均有升高,导致软骨分解代谢[9]。
NLRP3/Caspase-1 炎症复合体通路在固有免疫防御反应中发挥重要的作用,目前研究主要集中于免疫细胞。 本实验分别从基因和蛋白2 个方面证明在TMJOA 患者的滑膜细胞中存在NLRP3 炎症体和Caspase-1, 且两者的表达与对照组相比显著升高。 为进一步研究TMJOA 滑膜细胞中的NLRP3/Caspase-1 炎症复合体的激活和调节打下基础。
NLRP3 炎性小体的活化需要启动和激活2 个连续步骤:第一步是通过Toll 样受体(Toll-like receptors,TLRs)或者细胞因子识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)和宿主源性的危险信号(danger-associated molecular patterns,DAMPs), 激活NF-κB 信号通路, 启 动NLRP3 炎性小体和IL-1β 等前体蛋白的转录翻译;第二步是NLRP3 的激活剂触发NLRP3 发生寡聚化并活化Caspase-1, 导致IL-1β 和IL-18 的加工和释放。 同时,IL-1β 可作用于NF-κB 信号通路, 促进NLRP3 炎性小体通路的活化,从而导致正反馈级联扩大效应[10]。
目前关于NLRP3 炎性小体的激活, 普遍认同的机制包括线粒体活性氧的产生、 钾离子外排流出、溶酶体膜的破坏导致组织蛋白酶释放和细胞器的空间定位[11]。研究认为,巨噬细胞的胞外腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)激活细胞膜上的ATP-门控离子通道P2X7 嘌呤能受体,迅速打开K+通道外排K+,招募pannexin-1 半通道蛋白形成膜孔,使细胞外的NLRP3 激活剂进入细胞质内,直接激活NLRP3[12-13],进而活化Caspase-1,释放成熟的促炎因子IL-1β, 而IL-1β 可以刺激滑膜细胞释放前列腺素E2(prostaglandin E2,PGE2)快速促炎,同时抑制软骨细胞增殖, 降低蛋白多糖和胶原的合成,导致滑膜炎症和软骨的破坏[14]。以往研究得知颞下颌关节滑膜细胞包括A 型细胞和B 型细胞,A 型细胞为巨噬细胞样细胞,B 型细胞为成纤维样细胞[15]。 因此我们猜测,这种NLRP3 激活方式可能存在于TMJOA 的滑膜中并导致滑膜炎症。
另外, 研究者们发现NLRP3/Caspase-1 介导炎症反应的同时介导一种新型细胞程序性坏死—细胞焦亡(pyroptosis)[16]。胞质内激活的NLRP3 炎症体可以活化Caspase-1、 活性形式的Caspase-1 切割其底物gasdermin D(GSDMD)的N 端蛋白,释放的N端蛋白结合细胞膜并寡聚形成孔道状结构,使细胞内容物释放,引起细胞离子浓度梯度消失和细胞渗透溶胀,触发细胞焦亡[17]。细胞焦亡一方面对先天免疫防御至关重要,帮助机体应对病原体感染,另一方面炎性小体异常或过度活化与很多疾病相关。 近来许多研究认为细胞焦亡与肝组织、肺组织和滑膜组织等组织纤维化相关, 形成焦亡-慢性炎性反应-纤维化轴样病理过程。 有研究发现膝骨关节炎(knee osteoarthritis,KOA)的滑膜成纤维细胞和滑膜巨噬细胞均可在KOA 中发生细胞焦亡, 产生炎性因子,且通过转染滑膜成纤维细胞沉默GSDMD 后,可显著降低成纤维标志物的表达,提示成纤维滑膜细胞焦亡介导滑膜炎症反应并加剧纤维化[18]。 本实验发现TMJOA 患者的滑膜细胞中,NLRP3 和Caspase-1 的表达水平显著升高,而NLRP3 和Caspase-1在细胞焦亡相关通路中发挥重要的作用,这些都提示细胞焦亡很可能参与了TMJOA 的发生、发展,这将是本课题下一步的研究目标。
