胆管癌患者组织中NLRP3炎性小体的表达水平与其临床病理特征及预后的关系
2022-08-06余和斌蒙喜云
余和斌,蒙喜云,郭 勇
(重庆市长寿区人民医院肝胆外科 401220)
胆管癌是起源于胆管上皮的恶性肿瘤,可累及肝内、肝门及远端胆管树。目前,胆管癌是仅次于肝细胞癌的第二大常见肝脏恶性肿瘤,其发病率和死亡率呈逐年上升趋势,特别是大多数患者就诊时已为中晚期,5年生存率不足30%[1]。近年来研究显示,由免疫细胞触发的炎症与肿瘤形成、病情进展及预后密切相关[2]。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎性小体是驱动机体免疫炎性反应的主要机制,可激活半胱氨酸天冬氨酸蛋白酶-1(cysteinyl aspartate specific proteinase-1,caspase-1),活化的caspase-1可介导蛋白水解切割和促炎细胞因子白细胞介素(IL)-1β和IL-18的释放[3]。目前已发现NLRP3炎性小体在炎症性疾病如糖尿病、动脉粥样硬化、肝癌等疾病中明显激活[4-6],但目前在胆管癌研究较少。本研究通过检测胆管癌患者NLRP3炎性小体表达水平,探讨其与胆管癌患者临床病理特征及预后的关系,以期为胆管癌患者的临床治疗提供新的靶点和预后评估提供参考依据。
1 资料与方法
1.1 一般资料
收集2016年4月至2018年4月本院收治的行手术切除治疗的142例胆管癌患者的临床资料,其中男82例,女60例,年龄(59.4±10.4)岁;TNM分期:Ⅰ期32例,Ⅱ期35例,Ⅲ期45例,Ⅳ期30例。纳入标准:(1)经术后病理确诊;(2)诊治满足胆管癌诊治指南[7];(3)未接受过放化疗、生物治疗及相关手术治疗。排除标准:(1)存在其他胆系疾病;(2)各种急慢性感染;(3)近期使用过激素、免疫抑制剂;(4)存在其他部位恶性肿瘤。另选取40例正常胆管上皮组织作为对照,其中男22例,女18例,年龄(58.6±10.8)岁。对照组与胆管癌组在性别、年龄等方面比较,差异无统计学意义(P>0.05)。本研究经本院伦理委员会批准(AM201604102)并征得患者书面知情同意。
1.2 方法
1.2.1实时荧光定量PCR检测相关基因mRNA水平
收集研究对象组织样本,采用RNeasy Tissue Mini试剂盒(美国Qiagen公司)提取总RNA。逆转录试剂盒(上海生工公司)从1 μg总的RNA中合成逆转录cDNA。Sybr-Green和CFX96 Thermal Cycler进行实时PCR定量反应。反应条件及相关基因(NLRP3和caspase-1)引物参考既往文献[8],以GAPDH为内参,计算各组相应基因的相对表达量。
1.2.2炎性细胞因子的检测
采用ELISA法测定组织上清液IL-1β和IL-18水平,具体操作方法见武汉博士德生物公司提供的试剂盒说明书进行。
1.2.3临床资料收集
收集患者临床病理资料,包括性别、年龄、TNM分期、组织类型、肿瘤分化程度、是否发生淋巴结转移及有无脉管侵犯等。
1.2.4随访
通过复诊、电话和微信等方式进行随访,随访3年,截止时间为2021年4月,记录患者生存状况,分析NLRP3炎性小体表达与患者预后的关系。
1.3 统计学处理
2 结 果
2.1 两组NLRP3炎性小体及下游通路指标水平比较
与对照组比较,胆管癌组患者组织NLRP3炎性小体和caspase-1 mRNA、 IL-1β及IL-18水平明显升高(P<0.05),见表1。

表1 两组NLRP3炎性小体、caspase-1 mRNA及相关炎性因子水平比较
2.2 NLRP3炎性小体表达对患者长期生存状态的预测能力
通过ROC曲线分析胆管癌患者NLRP3炎性小体表达水平对患者长期生存状态的预测能力,其AUC为0.826(95%CI:0.766~0.887),确定NLRP3炎性小体的最佳截断界值为2.61,见图1。以2.61为界,将142例患者分为低表达组(84例)和高表达组(58例)。

图1 NLRP3炎性小体表达预测患者生存状态ROC曲线
2.3 NLRP3炎性小体表达与胆管癌患者临床病理关系
NLRP3炎性小体表达与患者性别、年龄、组织类型等无关(P>0.05),与TNM分期、肿瘤分化程度、淋巴结转移及脉管侵犯等有关(P<0.05),见表2。

表2 NLRP3炎性小体表达与胆管癌患者临床病理关系[n(%)]
2.4 NLRP3炎性小体表达与胆管癌预后的关系
NLRP3炎性小体高表达患者3年生存率25.86%(15/58)低于NLRP3炎性小体低表达患者55.95%(47/84),差异有统计学意义(χ2=10.95,P<0.001),见图2。
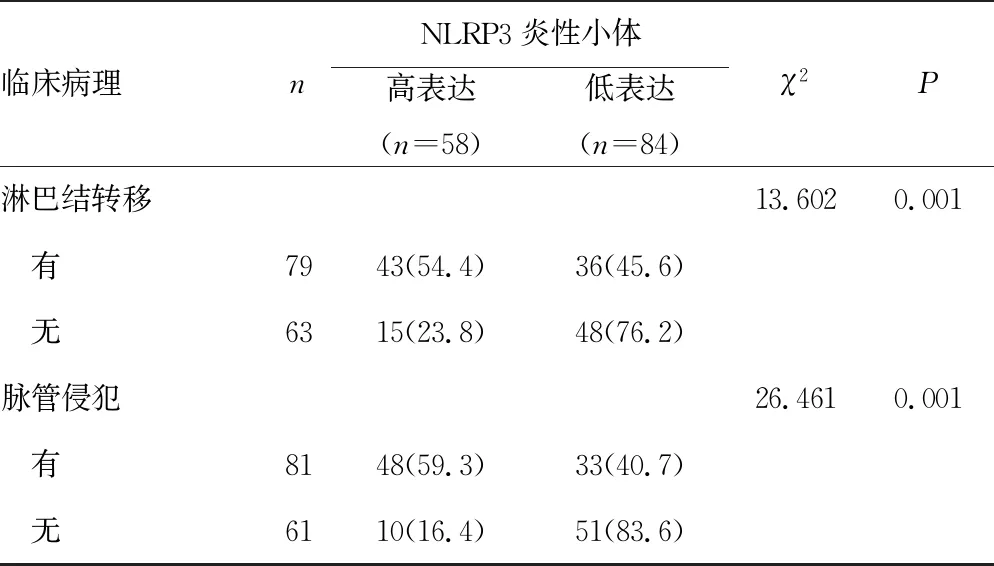
续表2 NLRP3炎性小体表达与胆管癌患者临床病理关系[n(%)]
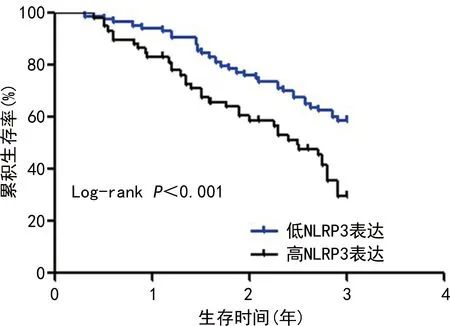
图2 Kaplan-Meier生存曲线比较
2.5 胆管癌患者预后的单因素和多因素Cox回归分析
单因素分析显示,TNM分期、分化程度、淋巴结转移、脉管侵犯及NLRP3炎性小体高表达与胆管癌患者的生存预后相关(P<0.05),见表3。多因素Cox回归分析显示,TNM分期、分化程度、淋巴结转移及NLRP3炎性小体高表达是影响胆管癌患者生存预后的独立因素(P<0.05),见表4。
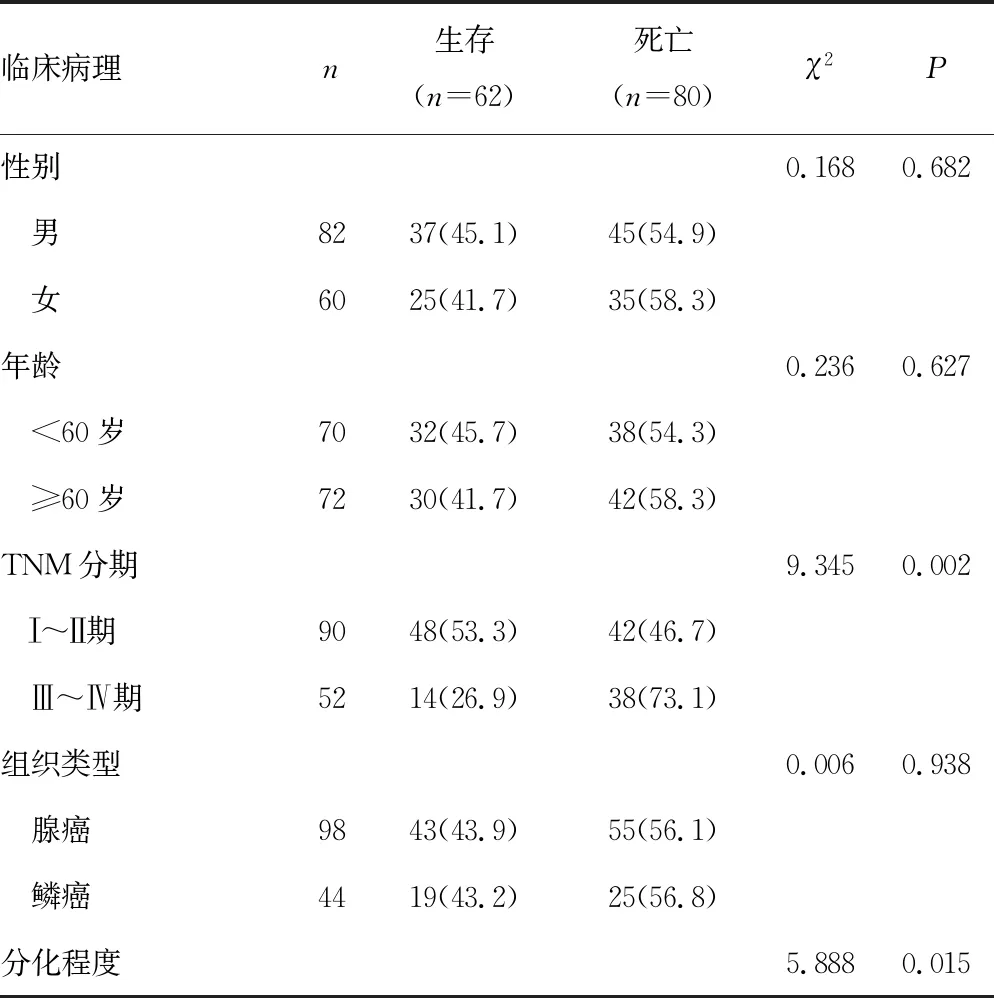
表3 胆管癌临床病理特征与预后的关系[n(%)]

续表3 胆管癌临床病理特征与预后的关系[n(%)]
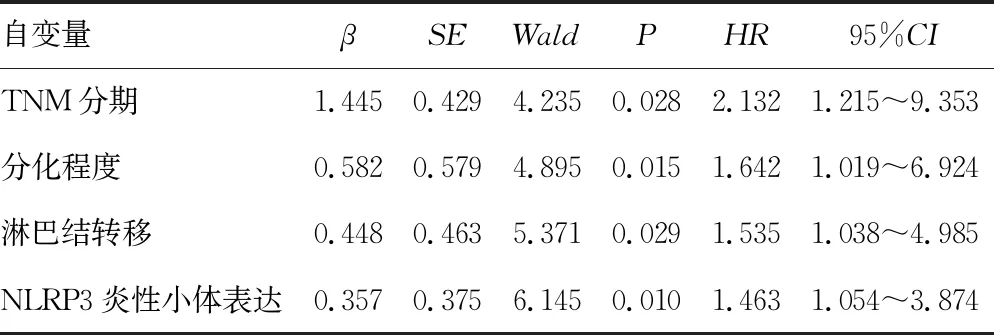
表4 Cox多因素回归分析胆管癌生存预后的影响因素
3 讨 论
胆管癌是一种预后较差的恶性肿瘤,有报道显示,即使经过根治性肝切除术,其5年总生存率也不足30%,其主要原因在于术后复发率高,同时缺乏全身有效的治疗方案[9]。因此,探寻有效的评估患者病情及预后的分子指标,对于指导胆管癌的治疗和改善预后,具有重要的临床价值。
既往研究显示,持续的炎性反应与恶性肿瘤的发生、发展密切相关[10]。NLRP3炎性小体是炎性反应激活的重要通路之一,其广泛表达于肿瘤组织和非肿瘤组织中,其激活有赖于Toll样受体磷酸化,随后激活核因子-κB(NF-κB)[11]。相关研究显示,NLRP3炎性小体除了参与恶性肿瘤的发生、发展以外,还与糖尿病、动脉粥样硬化等疾病的发生及进展相关,其可作为影响患者病情严重程度及预后的独立危险因素,同时也可能是上述炎症性疾病潜在的治疗靶点[4-5]。有研究报道,NLRP3炎性小体在正常组织中的表达水平较低,但在早期胚胎和恶性肿瘤中呈现高表达,表明NLRP3炎性小体除了炎性反应外,还可能在高等真核生物生长和恶性肿瘤细胞的增殖和分化方面,发挥重要作用[12]。本研究结果显示,胆管癌组织NLRP3炎性小体及相关下游通路指标表达水平明显高于对照组,提示NLRP3炎性小体可能参与了胆管癌的发生过程,这与相关NLRP3炎性小体在肝癌中的研究结果一致。
NLRP3炎性小体相关通路的激活可能参与多种肿瘤的发生及进展[13]。前期有研究发现,乳腺癌患者及动物模型中NLRP3炎性小体表达水平明显上调,并且其高表达与乳腺癌转移和生存期相关[14]。其机制主要是NLRP3炎性小体激活下游IL-1β,调控基质金属蛋白酶1(MMP1)、MMP3和MMP10的表达,同时IL-1β可激活NF-κB相关信号,招募单核细胞进入肿瘤局部微环境,促进肿瘤细胞侵袭和转移[15]。而敲除或干扰NLRP3炎性小体表达,可明显抑制肿瘤细胞的增殖和转移,通过抑制NLRP3炎性小体相关通路,可能成为乳腺癌治疗的重要靶点[16]。NLRP3炎性小体还可介导IL-18的分泌,通过以下途径抑制肿瘤的发生及发展[17]:(1)诱导和增强NK细胞对小鼠肝脏及结肠肿瘤细胞的杀伤活性;(2)促进IL-22结合蛋白的下调,从而抑制转录因子STAT3的过度活化和抗凋亡及增殖相关分子的表达。本研究结果发现,NLRP3炎性小体表达与胆管癌临床病理分期、淋巴结转移、分化程度和脉管侵犯有关,表明NLRP3炎性小体可能在胆管癌的发生和发展中发挥重要的生物学作用。进一步研究发现,NLRP3炎性小体与胆管癌患者临床预后有关,NLRP3炎性小体高表达的胆管癌患者总生存率较低,多因素Cox回归分析显示,NLRP3炎性小体高表达是影响胆管癌患者生存预后的独立因素。
综上所述,NLRP3炎性小体在胆管癌患者中呈高表达,其可能与促进胆管癌的病理进程及多项临床病理特征相关,高表达NLRP3炎性小体预示更差的临床预后和更短的生存期。通过干预NLRP3炎性小体,有望成为胆管癌的潜在治疗靶点,但具体作用机制还有待于进一步研究。
