蟾毒灵对低氧/复氧心肌细胞损伤保护作用及机制
2021-05-08翟小菊李松林马光王国良惠学志
翟小菊 李松林 马光 王国良 惠学志
[摘要] 目的 研究蟾毒灵对低氧/复氧(H/R)心肌细胞损伤的影响,并初步探究其作用机制。方法 体外建立H/R心肌细胞模型,并采用不同浓度(0.1、1.0、10.0 μmol/L)的蟾毒灵处理。采用CCK-8法测定细胞活力,酶标法检测超氧化物歧化酶(SOD)和丙二醛(MDA)的含量,流式细胞术检测心肌细胞凋亡率和活性氧(ROS)水平,Western blot检测剪切的含半胱氨酸的天冬氨酸蛋白水解酶3和9(Cleaved Caspase-3,Cleaved Caspase-9)蛋白水平。结果 与空白对照组比较,H/R组心肌细胞活力、SOD含量明显降低,ROS水平、MDA含量、细胞凋亡率、Cleaved Caspase-3和Cleaved Caspase-9蛋白表达升高(F=129.978~330.050,P<0.05)。蟾毒灵可明显改善H/R引起的上述指标变化。结论 蟾毒灵能够改善H/R引起的心肌细胞损伤,其作用机制可能与抑制氧化应激和细胞凋亡有关。
[关键词] 蟾酥碱;肌细胞,心脏;心肌再灌注损伤;活性氧;细胞凋亡
[中图分类号] R996.3;R542.2[文献标志码] A[文章编号] 2096-5532(2021)01-0115-05
[ABSTRACT]ObjectiveTo investigate the effect of bufalin on hypoxia/reoxygenation (H/R)-induced cardiomyocyte injury and its mechanism of action. MethodsAn H/R cardiomyocyte model was established in vitro and cardiomyocytes were treated with bufalin at different concentrations (0.1, 1.0, and 10.0 μmol/L). CCK-8 assay was used to determine cell viability; ELISA was used to measure the content of superoxide dismutase (SOD) and malondialdehyde (MDA); flow cytometry was used to measure cardiomyocyte apoptosis and reactive oxygen species (ROS) level; Western blot was used to measure the levels of cleaved cysteine-containing aspartate proteolytic enzymes 3 and 9 (cleaved caspase-3 and cleaved caspase-9). ResultsCompared with the blank control group, the H/R group had significant reductions in cardiomyocyte viability and SOD content and significant increases in ROS level, MDA content, apoptosis rate, and protein expression of cleaved caspase-3 and cleaved caspase-9 (F=129.978-330.050,P<0.05). Bufalin significantly improved the above changes in these indices caused by H/R. ConclusionBufalin can improve cardiomyocyte injury caused by H/R, possibly by inhibiting oxidative stress and cell apoptosis.
[KEY WORDS]Bufotenin; myocytes, cardiac; myocardial reperfusion injury; reactive oxygen species; apoptosis
急性心肌梗死是冠状动脉持续性缺血低氧引起的心肌坏死,当冠状动脉血运重建时可能诱发缺血/再灌注损伤[1-2]。如何减少缺血/再灌注造成的心肌细胞损伤一直以来是心血管疾病臨床和基础研究的重点。蟾毒灵是一种从传统中药蟾酥中提取的中药单体,具有抗炎、镇痛、强心、抗肿瘤等多种临床功效[3-4]。有研究显示,蟾酥能够改善缺血心肌细胞的能量代谢,在一定浓度范围内呈浓度依赖性地抑制大鼠心肌细胞收缩,减轻心肌损伤,对心肌具有保护作用[5-6]。然而,蟾毒灵在心肌缺血/再灌注损伤中是否发挥作用的研究鲜有报道。因此,本实验通过体外构建低氧/复氧(H/R)心肌细胞损伤模型,观察蟾毒灵对H/R损伤心肌细胞的影响及机制,为利用蟾毒灵防治心肌H/R损伤提供实验依据。
1 材料与方法
1.1 实验材料
大鼠心肌细胞株H9c2购自中国科学院上海生命科学学院细胞资源中心;蟾毒灵(纯度≥98%)购自烟台靶点药物研究有限公司;DMEM培养基、胎牛血清购自美国Gibco公司;CCK-8细胞活力检测试剂盒购自北京旷博生物技术有限公司;活性氧(ROS)、超氧化物歧化酶(SOD)及丙二醛(MDA)含量检测试剂盒均购自南京建成生物工程研究所; Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒购自日本TaKaRa公司;Western blot检测所需试剂均购自上海碧云天生物技术研究所;剪切的含半胱氨酸的天冬氨酸蛋白水解酶3和9(Cleaved Caspase-3,Cleaved Caspase-9)抗体购自美国Santa Cruz公司;β-actin抗体和辣根过氧化物酶标记的二抗购自美国CST公司。
1.2 实验方法
1.2.1 H/R心肌细胞模型的构建 在含体积分数0.10胎牛血清的DMEM培养基中培养心肌细胞H9c2,放置在体积分数0.05 CO2、0.95空气、37 ℃恒温培养箱中培养。参照文献方法构建H/R心肌细胞模型[7],待心肌细胞生长达60%左右融合时,除去旧培养液,加入不含血清的新鲜DMEM培养液,将心肌细胞放置在体积分数0.95 N2和0.05 CO2培养箱中低氧处理12 h,取出细胞,弃去旧培养液,更换成含体积分数0.10胎牛血清的DMEM培养液,再将细胞放置在体积分数0.05 CO2、0.95空气的培养箱中复氧处理4 h。
1.2.2 实验分组 心肌细胞接种到6孔板中,将细胞随机分为5组:空白对照组(A组),未经任何处理正常培养的心肌细胞;H/R组(B组),按照上述1.2.1方法对心肌细胞进行H/R处理;低浓度蟾毒灵组(C组),以0.1 μmol/L蟾毒灵预处理心肌细胞12 h再行H/R处理;中浓度蟾毒灵组(D组),以1.0 μmol/L蟾毒灵预处理心肌细胞12 h再行H/R处理;高浓度蟾毒灵组(E组),以10.0 μmol/L蟾毒灵预处理心肌细胞12 h再行H/R处理。蟾毒灵处理浓度选择依据文献报道及前期预实验结果[8]。
1.2.3 CCK-8检测心肌细胞活力 将心肌细胞以每孔1×103个接种于96孔板中,置37 ℃培养箱常规培养48 h,按照上述1.2.2方法分组处理心肌细胞,分别向每孔细胞中添加10 μL CCK-8试剂和100 μL无血清培养液,于37 ℃培养箱孵育2 h,采用酶标仪测定450 nm波长处各孔心肌细胞光密度值(OD值)。计算各组心肌细胞活力(%)=(实验组OD值/对照组OD值)×100%。
1.2.4 酶标法检测细胞内SOD和MDA含量 各组心肌细胞处理后,弃去培养液分别收集细胞,使用磷酸缓冲液洗涤细胞,通过超声破碎仪破碎细胞,以3 500 r/min低温离心10 min,收集上清,分别按照试剂盒说明书进行处理。采用多功能酶标仪测定各组心肌细胞内SOD和MDA含量。
1.2.5 流式细胞术检测各组心肌细胞凋亡率 各处理组心肌细胞以胰蛋白酶消化后,离心收集细胞,用预冷的磷酸缓冲液洗涤细胞。按照Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒使用说明书进行操作,加入1×Binding buffer重悬细胞100 μL,再向细胞悬液中加入Annexin Ⅴ-FITC和PI各5 μL,轻轻混匀,室温下避光孵育15 min。使用流式细胞仪测定各组心肌细胞凋亡率。
1.2.6 流式细胞术检测ROS水平 将荧光探针DCFH-DA以不含血清的培养液稀释。各处理组心肌细胞除去培养液,分别加入稀释的DCFH-DA,置37 ℃培养箱孵育30 min,用不含血清的培养液洗涤细胞3次,除去DCFH-DA。收集各组细胞上流式细胞仪使用488 nm激发波长和525 nm发射波长检测荧光强度。
1.2.7 Western blot检测各组心肌细胞中Cleaved Caspase-3和-9蛋白表达水平 分别收集各组处理后的心肌细胞,向细胞中加入RIPA裂解液,冰上提取总蛋白。以BCA蛋白浓度测定试剂盒对提取蛋白进行定量,调整蛋白浓度,取等量蛋白加入到各上样孔中,采用SDS-PAGE凝胶进行电泳,电泳结束后将各组蛋白采用半干法转移至PVDF膜上。将PVDF膜放置于50 g/L脱脂奶粉封闭液中孵育2 h,取出膜使用TBST洗涤3次,每次10 min,再加入稀释的相应一抗,Cleaved Caspase-3和-9一抗均为1∶800稀释,4 ℃过夜孵育。以TBST洗涤3次,每次10 min,再加入1∶2 000稀释的辣根过氧化酶标记的二抗,室温孵育1 h。以TBST洗涤3次,每次10 min,在暗室中加入ECL化学发光液进行显影,曝光,采用凝胶成像仪拍照。以β-actin为内参照,采用Quantity One图像分析软件统计各组心肌细胞中Cleaved Caspase-3和-9蛋白的相对表达水平。
1.3 统计学处理
采用SPSS 21.0软件进行统计学处理,计量资料数据以±s表示,多组间差异比较采用单因素方差分析,两两组间差异比较采用SNK-q检验分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组心肌细胞活力比较
CCK-8检测结果显示,A~E组心肌细胞活力分别为(100.00±5.01)%、(39.84±2.12)%、(49.28±3.44)%、(64.71±4.81)%和(87.01±4.69)%。与A组比較,B组心肌细胞活力显著下降(F=330.050,q=43.377,P<0.05);与B组相比较,C、D、E组心肌细胞活力有不同程度的升高(q=6.804~34.011,P<0.05)。提示随蟾毒灵浓度的增加心肌细胞活力逐渐升高。
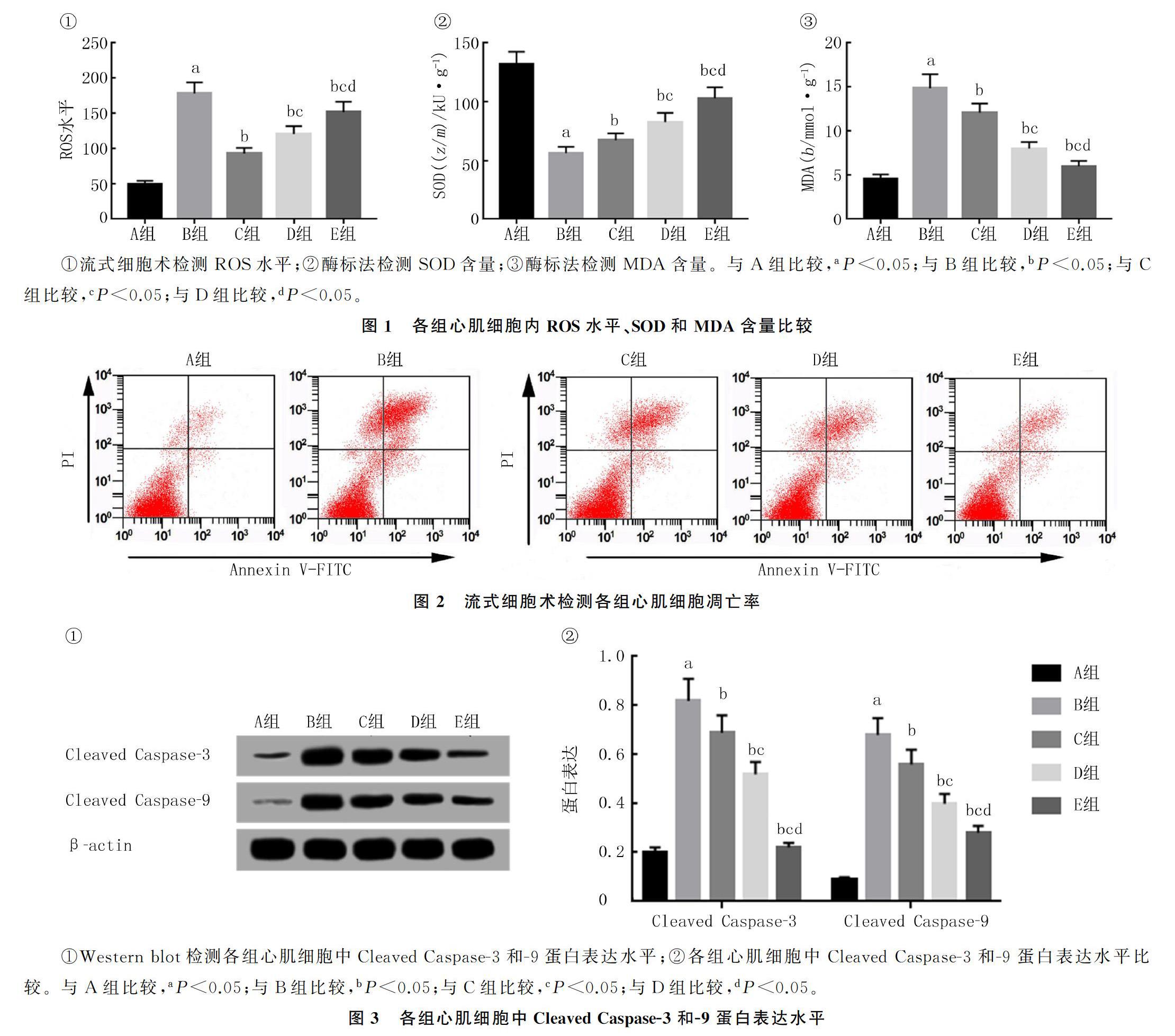
2.2 各组心肌细胞内ROS水平、SOD和MDA含量比较
酶标法和流式细胞术检测结果显示,与A组比较,B组心肌细胞内SOD含量降低(F=129.978,q=28.673,P<0.05),ROS水平和MDA含量升高(F=171.502、178.726,q=33.623、31.443,P<0.05);与B组比较,C、D、E组心肌细胞内SOD含量随药物浓度的增加而增加(q=4.144~17.689,P<0.05),ROS水平和MDA含量随药物浓度的增加而降低(q=7.893~27.065,P<0.05)。见图1。
2.3 各组心肌细胞凋亡率比较
流式细胞术检测结果显示,A~E组心肌细胞凋亡率分别为(3.81±0.66)%、(35.69±5.35)%、(27.04±3.29)%、(18.48±2.84)%和(9.26±1.15)%。与A组比较,B组心肌细胞凋亡率显著升高(F=152.747,q=30.467,P<0.05);与B组比较,C、D、E组心肌细胞凋亡率随药物浓度的增加逐渐降低(q=8.267~25.259,P<0.05)。见图2。
2.4 各组心肌细胞中Cleaved Caspase-3和-9蛋白表达水平比较
Western blot检测结果显示,与A组比较,B组心肌细胞中Cleaved Caspase-3和-9蛋白表达水平均明显上调(F=211.749、217.378,q=32.577、37.566,P<0.05);与B组比较,C、D、E组心肌细胞中Cleaved Caspase-3和-9蛋白表达水平随药物浓度的增加逐渐下调(q=6.831~25.469,P<0.05)。见图3。
3 讨论
急性心肌梗死是常见的心血管疾病,美国每年约有150万人发病[9]。近年来,我国急性心肌梗死的发病率呈明显上升趋势,严重危害着人类的健康和生命[10]。临床上常通过血运重建的方式缩小梗死面积,挽救心肌,但血运重建会导致缺血/再灌注损伤的发生。目前关于心肌缺血/再灌注损伤的发生机制尚未彻底阐明,认为可能与氧自由基的作用、细胞凋亡过程紊乱、细胞内钙超载和白细胞的激活等相关[11-14]。研究证实,细胞凋亡过程的紊乱是病理性的,而且与Caspase基因有关[15]。在目前用于心肌缺血/再灌注损伤的新型治疗剂中,各种天然植物化学物质可通过各种途径对心肌损伤起保护作用[16-17]。研究已证实,蟾酥提取物对心力衰竭、缺血性心肌病和高血压等心血管疾病的治疗具有重要作用[18-20]。作为蟾酥中的有效化学物质,蟾毒灵具有多种生物活性。本实验通过建立H/R心肌细胞损伤模型,探究蟾毒灵对心肌细胞损伤的影响及机制。
在预实验中依据文献报道筛选蟾毒灵的作用浓度[8],研究结果显示,当蟾毒灵浓度≤10.0 μmol/L时,能够促进心肌细胞增殖活性;当蟾毒灵浓度>30.0 μmol/L时,则抑制心肌细胞增殖活性。因此,本实验根据预实验结果选择0.1、1.0、10.0 μmol/L为实验加药浓度。本文结果表明,H/R损伤显著降低了心肌细胞的活力,而蟾毒灵明显逆转了H/R诱导的细胞活力降低。越来越多的研究结果已经证实,氧化应激在心肌缺血/再灌注损伤中起关键作用[21-23]。心肌细胞中的氧化剂和抗氧化剂失衡有利于ROS积累,导致细胞损伤,引起氧化应激[24]。已证明,在心肌缺血/再灌注损伤期间ROS水平增加,内源性自由基清除酶如SOD活性降低[25-27]。众所周知,活性醛如MDA是氧化应激最常见的产物和毒性标志物之一。心肌缺血/再灌注损伤促进氧化应激,引起活性醛积累,导致心脏损伤[28]。因此,通过检测心肌细胞中ROS水平、SOD活性以及MDA含量能够显示心肌细胞的氧化损伤程度。本实验酶标法检测结果显示,蟾毒灵处理的心肌细胞内SOD活性增加,ROS和MDA含量减少,且具有浓度依赖关系。这些结果提示,蟾毒灵对H/R条件下心肌细胞氧化应激损伤具有保护作用。
心肌细胞凋亡过程的紊乱被认为是心肌缺血/再灌注损伤的主要病理生理机制之一,并且被认为是导致心肌缺血/再灌注损伤后细胞死亡的重要原因[29]。本研究流式细胞术检测显示,蟾毒灵处理组的心肌细胞凋亡率明显低于H/R处理组,且随着蟾毒灵浓度的升高,心肌细胞凋亡率逐渐降低,表明蟾毒灵能够呈浓度依赖性地抑制H/R诱导的心肌细胞凋亡。此外,本文Western blot检测显示,蟾毒灵处理组心肌细胞中Cleaved Caspase-3和-9蛋白表达水平明显低于H/R处理组。Caspase-3和-9作为半胱氨酸天冬氨酸特异性蛋白酶家族成员,在细胞凋亡中起关键作用。特定位点的切割将激活Caspase-3和-9并促进细胞凋亡[30]。本文结果提示,蟾毒灵可能通过下调Cleaved Caspase-3和-9的蛋白表达抑制心肌细胞凋亡,对H/R心肌细胞损伤起保护作用。
总之,本研究的结果揭示了蟾毒灵对H/R损伤心肌细胞具有保护作用,其作用机制与降低氧化应激及细胞凋亡有关。初步证实蟾毒灵的心肌保护作用和潜在机制,这些结果为体内作用进一步评估提供了证据,这可能有助于开发新的治疗急性心肌梗死的方法。本实验初步探究蟾毒灵是否对H/R心肌细胞起保护作用,其作用效果在何种水平尚未可知,后期实验将设置已知有效药物的阳性对照组,以更深入明确其作用的分子机制。此外,为更充分了解蟾毒灵作用,需增加H/R后蟾毒灵不同浓度和不同时间点对细胞作用,阐述蟾毒灵是否在发病后有一定的抑制氧化、凋亡和促进修复的作用。
[参考文献]
[1]HEUSCH G, GERSH B J. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge[J]. European Heart Journal, 2017,38(11):774-784.
[2]NERI M, RIEZZO I, PASCALE N, et al. Ischemia/reperfusion injury following acute myocardial infarction: a critical issue for clinicians and forensic pathologists[J]. Mediators of Inflammation, 2017,2017:7018393.
[3]袁佳妮,李瑶,杨倩,等. 蟾酥类制剂的研究进展[J]. 陕西中医, 2018,39(9):1316-1318.
[4]陈进宝,殷佩浩. 蟾毒灵抗肿瘤作用分子机制的研究進展[J]. 河北中医, 2019,41(1):140-145.
[5]姜艳,朱会超,任煜,等. 蟾酥治疗心血管疾病的药理研究进展[J]. 天津中医药大学学报, 2012,31(3):187-189.
[6]SONG T, CHU X, ZHANG X, et al. Bufalin, a bufanolide steroid from the parotoid glands of the Chinese toad, inhibits L-type Ca2+ channels and contractility in rat ventricular myocytes[J]. Fundamental & Clinical Pharmacology, 2017,31(3):340-346.
[7]劉飞,付微,乔陆明,等. 快速建立心肌细胞缺氧/复氧损伤模型的方法[J]. 牡丹江医学院学报, 2017,38(2):1-5.
[8]宋涛. 蟾酥中有效成分蟾毒灵的含量测定及其对心肌细胞钙信号的影响[D]. 石家庄:河北医科大学, 2018.
[9]REYNOLDS K, GO A S, LEONG T K, et al. Trends in incidence of hospitalized acute myocardial infarction in the cardiovascular research network (CVRN)[J]. The American Journal of Medicine, 2017,130(3):317-327.
[10]WANG L C, ZHOU Y, QIAN C, et al. Clinical characteristics and improvement of the guideline-based management of acute myocardial infarction in China: a national retrospective analysis[J]. Oncotarget, 2017,8(28):46540-46548.
[11]LI W Y, LI W, LENG Y, et al. Ferroptosis is involved in diabetes myocardial ischemia/reperfusion injury through endoplasmic Reticulum stress[J]. DNA and Cell Biology, 2020,39(2):210-225.
[12]ZHAO Z G, TANG Z Z, ZHANG W K, et al. Inactivated pseudomonas aeruginosa protects against myocardial ischemia reperfusion injury via Nrf2 and HO-1[J]. Experimental and Therapeutic Medicine, 2020,19(5):3362-3368.
[13]CONKLIN D J, GUO Y, NYSTORIAK M A, et al. TRPA1 channel contributes to myocardial ischemia-reperfusion injury[J]. American Journal of Physiology. Heart and Circulatory Physiology, 2019,316(4):H889-H899.
[14]BORGES J P, DA SILVA VERDOORN K. Cardiac ischemia/reperfusion injury: the beneficial effects of exercise[J]. Advances in Experimental Medicine and Biology, 2017,999:155-179.
[15]ZHOU H, MA Q, ZHU P J, et al. Protective role of melatonin in cardiac ischemia-reperfusion injury: from pathogenesis to targeted therapy[J]. Journal of Pineal Research, 2018,64(3):e12471-e12491.
[16]SHANMUGAM K, RAVINDRAN S, KURIAN G A, et al. Fisetin confers cardioprotection against myocardial ischemia reperfusion injury by suppressing mitochondrial oxidative stress and mitochondrial dysfunction and inhibiting glycogen synthase kinase 3β activity[J]. Oxidative Medicine and Cellular Longevity, 2018,2018:9173436.
[17]杨秀娟,李硕,杨志军,等. 红芪不同提取物对阿霉素致大鼠心肌损伤的保护作用[J]. 中国临床药理学杂志, 2019,35(10):981-984.
[18]REN W, HAN L Y, LUO M Y, et al. Multi-component identification and target cell-based screening of potential bioactive compounds in toad venom by UPLC coupled with high-resolution LTQ-Orbitrap MS and high-sensitivity Qtrap MS[J]. Analytical and Bioanalytical Chemistry, 2018,410(18):4419-4435.
[19]LI M, WANG X J, QIU Y L, et al. Safety reassessment of cinobufotalin injection: new findings into cardiotoxicity[J]. Toxicology Research, 2020,9(4):390-398.
[20]周文莉,祝宇龙,李龙飞,等. HPLC法同时测定华佗救心丸中8种蟾蜍二烯内酯[J]. 中成药, 2020,42(5):1135-1138.
[21]赵一灿,张丽华,赵文,等. 芦丁对大鼠心肌缺血再灌注损伤的保护作用[J]. 郑州大学学报(医学版), 2017,52(5):562-566.
[22]FU W W, XU H L, YU X F, et al. 20(S)-Ginsenoside Rg2 attenuates myocardial ischemia/reperfusion injury by reducing oxidative stress and inflammation: role of SIRT1[J]. RSC Advances, 2018,8(42):23947-23962.
[23]SUN T, DING W, XU T, et al. Parkin regulates programmed necrosis and myocardial ischemia/reperfusion injury by targeting cyclophilin-D[J]. Antioxidants & Redox Signaling, 2019,31(16):1177-1193.
[24]CADENAS S. ROS and redox signaling in myocardial ischemia-reperfusion injury and cardioprotection[J]. Free Radical Biology and Medicine, 2018, 117:76-89.
[25]WANG N, SONG G H, YANG Y, et al. Inactivated Lactobacillus promotes protection against myocardial ischemia-reperfusion injury through NF-κB pathway[J]. Bioscience Reports, 2017,37(6):BSR20171025.
[26]XU G P, ZHAO X, FU J, et al. Resveratrol increase myocardial Nrf2 expression in type 2 diabetic rats and alleviate myocardial ischemia/reperfusion injury (MIRI)[J]. Annals of Palliative Medicine, 2019,8(5):565-575.
[27]WU F B, YE B H, WU X D, et al. Paeoniflorin on rat myocardial ischemia reperfusion injury of protection and mechanism research[J]. Pharmacology, 2020, 105(5-6):281-288.
[28]YU Liming, GONG Bing, DUAN Weixun, et al. Melatonin ameliorates myocardial ischemia/reperfusion injury in type 1 diabetic rats by preserving mitochondrial function:role of AMPK-PGC-1α-SIRT3 signaling[J]. Scientific Reports, 2017,7:41337-41349.
[29]岳瑩,吕风华,陈玉磊,等. miR-499对缺氧/复氧诱导的心肌细胞凋亡的影响[J]. 郑州大学学报(医学版), 2018,53(4):503-507.
[30]MITUPATUM T, AREE K, KITTISENACHAI S, et al. mRNA expression of bax, bcl-2, p53, cathepsin B, caspase-3 and caspase-9 in the HepG2 cell line following induction by a novel monoclonal ab Hep88 MAb: cross-talk for paraptosis and apoptosis[J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2016,17(2):703-712.
(本文编辑 于国艺)
