消瘿方对甲状腺FRTL细胞增殖与凋亡的影响
2021-05-08卢江昆叶仁静沈洁袁绍峰孔祥东
卢江昆 叶仁静 沈洁 袁绍峰 孔祥东


[摘要]目的探討消瘿方对甲状腺FRTL细胞增殖与凋亡影响及其机制。方法取4周龄SD大鼠15只,随机分为低浓度、中浓度、高浓度消瘿方组和阳性药组、空白组,每组3只。消瘿方低、中、高浓度组分别给予7.47、14.94、29.88 g/kg消瘿方中药复方药液,阳性药组给予左甲状腺素钠片(0.18 mg/kg),空白组给予蒸馏水,连续灌胃5 d,腹主动脉取血,分离血清。体外培养大鼠甲状腺FRTL细胞,分别应用各组血清进行干预。MTT法检测含药血清对FRTL细胞增殖率的影响,Hoechst 33258荧光染色法检测细胞凋亡形态,Western blotting和RT-PCR法检测凋亡因子Bax、Bcl-2、Caspase-3蛋白和基因表达。结果高浓度消瘿方含药血清干预后,FRTL细胞增殖率显著下降(F=6.71、5.85,P<0.05);细胞密度下降,细胞排列散乱、细胞核碎裂、细胞透亮,呈现典型凋亡形态学特征;促凋亡因子Bax蛋白和基因表达上调,而抗凋亡因子Bcl-2蛋白和基因表达下调,促/抗凋亡因子bax/bcl-2间的平衡被打破,凋亡执行因子Caspase-3蛋白和基因表达显著上调,差异有显著性(F=9.97~63.20,P<0.01)。结论消瘿方能够抑制甲状腺FRTL细胞增殖,促进其凋亡,其机制可能与促/抗凋亡因子bax/bcl-2间平衡破坏、caspase-3表达上调有关。
[关键词]消瘿方;甲状腺;FRTL细胞;凋亡因子;细胞增殖;细胞凋亡
[中图分类号]R259[文献标志码]A[文章编号]2096-5532(2021)01-0105-05
[ABSTRACT]ObjectiveTo investigate the effect of Xiaoying prescription on the proliferation and apoptosis of thyroid FRTL cells and related mechanism. MethodsA total of 15 Sprague-Dawley rats, aged 4 weeks, were randomly divided into blank group, positive drug group, and low-, medium-, and high-concentration Xiaoying prescription groups, with 3 rats in each group. The rats in the low-, medium-, and high-concentration Xiaoying prescription groups were given the solution of Xiaoying prescription at a dose of 7.47, 14.94, and 29.88 g/kg, respectively, those in the positive drug group were given levothyroxine sodium tablets (0.18 mg/kg), and those in the blank group were given distilled water, by gavage for 5 consecutive days. Blood samples were collected from the abdominal aorta and serum was separated. Rat thyroid FRTL cells were cultured in vitro, and the serum containing each drug was used for intervention. MTT assay was used to observe the effect of the serum containing drug on the proliferation rate of FRTL cells, Hoechst 33258 fluorescence staining was used to observe apoptotic morphology, and Western blotting and RT-PCR were used to measure the protein and mRNA expression of the apoptotic factors Bax, Bcl-2, and Caspase-3. ResultsThere was a significant reduction in the proliferation rate of FRTL cells after intervention with the serum containing high-concentration Xiaoying prescription (F=6.71,5.85;P<0.05), with the typical apoptotic morphological features of reduced cell density, scattered arrangement, nucleus fragmentation, and translucent cells. The protein and mRNA expression of the pro-apoptotic factor Bax was upregulated, while the protein and mRNA expression of the anti-apoptotic factor Bcl-2 was downregulated, and the ba-lance between the pro-apoptotic factor bax and the anti-apoptotic factor bcl-2 was broken; there were significant increases in the protein and mRNA expression of the apoptosis execution factor caspase-3 (F=9.97-63.20,P<0.01). ConclusionXiaoying prescription can inhibit the proliferation and promote the apoptosis of thyroid FRTL cells, possibly by breaking the balance between the pro-apoptotic factor bax and the anti-apoptotic factor bcl-2 and upregulating the expression of caspase-3.
[KEY WORDS]Xiaoying recipe; thyroid gland; thyroid FRTL cells; apoptotic factor; cell proliferation; apoptosis
甲状腺结节是最常见的内分泌疾病之一,发病率高达6%~7%,以良性结节多见[1-2]。已有研究显示,甲状腺结节的发生是遗传、免疫紊乱、激素失调等多种原因共同触发而导致甲状腺结构及功能异常,其中甲状腺细胞的增殖与凋亡平衡破坏在疾病的发生过程中起重要作用[3-4]。西医治疗甲状腺结节常出现结节复发、骨质疏松、甲状腺功能下降等副作用[5-6],而中医药具有毒小效优、多环节、多途径治疗特点,在防治甲状腺结节、改善症状、调节机体免疫等方面优势明显[7]。消瘿方以“益气养阴、祛痰散结”为治则,为中药治疗“瘿病”代表性方剂,临床常用该方加减治疗甲状腺疾病。本研究旨在探讨消瘿方对甲状腺FRTL细胞增殖与凋亡的影响,为中医药治疗甲状腺结节提供基础理论支撑。
1材料与方法
1.1实验材料
1.1.1实验动物SPF级4周龄SD大鼠15只,雌雄不拘,体质量200~220 g,由上海斯莱克动物有限公司提供。
1.1.2药物消瘿方组方:黄芪30 g,玄参15 g,党参15 g,白芍15 g,北沙参15 g,制香附15 g,浙贝母15 g,夏枯草10 g,当归10 g,柴胡10 g,海浮石10 g,白芥子6 g,原藥材均购自上海群力中草药店。全方加8倍体积水煎煮2次,并浓缩至人临床等效剂量的0.5、1.0、2.0倍剂量。左甲状腺素钠片购自默克雪兰诺有限公司,规格每粒50 μg。
1.1.3主要试剂与仪器大鼠甲状腺FRTL细胞株(武汉普诺赛);DMEM培养基(美国Gibco);bax、bcl-2、caspase-3多克隆抗体(英国Abcam);GAPDH单克隆抗体(美国CST);HRP-IgG二抗(武汉博士德);MTT粉末、Hoechst 33258染液(上海碧云天);RIPA、Trizol(北京中杉金桥);CO2培养箱、酶标仪(美国Thermo);超微量核酸蛋白测定仪(英国BioDrop);凝胶成像分析系统、实时荧光定量PCR仪(美国Bio-Rad)。
1.2实验方法
1.2.1含药血清的制备SD大鼠随机分为空白组、低浓度消瘿方组、中浓度消瘿方组、高浓度消瘿方组和阳性药组,每组3只。低、中、高浓度消瘿方组分别给予7.47、14.94、29.88 g/kg的中药复方煎液(相当于临床等效剂量的0.5、1.0、2.0倍),阳性药组给予0.18 mg/kg(临床等效剂量)左甲状腺素钠片水溶液,空白组则给予等量蒸馏水。各组均于每天上、下午固定时间灌胃给药1次,连续灌胃5 d。第6天上午灌胃完成后1 h麻醉大鼠,腹主动脉取血,室温静置2 h,以3 000 r/min离心10 min,分离血清,56 ℃水浴灭活30 min,分装、保存备用,使用前用0.22 μm微孔滤膜过滤。
1.2.2细胞培养取大鼠甲状腺FRTL细胞株,用含体积分数0.10胎牛血清的DMEM培养基,于37 ℃、含体积分数0.05 CO2饱和湿度下培养,待细胞基本长满培养瓶底部(2~3 d)时消化传代,取对数生长期细胞,随机分为5组。 空白对照组(A组):加入空白组血清;低浓度消瘿方组(B组):加入低浓度消瘿方组含药血清;中浓度消瘿方组(C组):加入中浓度消瘿方组含药血清;高浓度消瘿方组(D组):加入高浓度消瘿方组含药血清;左甲状腺素钠组(E组):加入阳性药组含药血清。
1.3检测指标及方法
1.3.1MTT法检测细胞增殖率采用胰蛋白酶消化并调整细胞密度,以每孔5 000个细胞接种于96孔板中,待细胞完全贴壁后,弃去培养液,各组分别加入对应的含药或者正常血清。每组设6个复孔,同时设置空白孔。分别于培养箱中培养24、48 h,加入MTT液避光孵育4 h,然后加入DMSO液,室温下振荡10 min,酶标仪测定450 nm波长处各孔的吸光度(A)值,计算细胞增殖率。增殖率(%)=(A含药血清-A空白孔)/(A空白血清-A空白孔)×100%。
1.3.2Hoechst染色法检测细胞凋亡情况调整细胞密度,加入含药或者正常血清后继续培养24 h。取出96孔板,弃去培养液,加入PBS液洗涤3次,然后每孔加入Hoechst 33258染液100 μL,37 ℃避光孵育30 min;孵育完成后,弃去孔内染液,PBS液洗涤3次后,倒置荧光显微镜下观察各组细胞的凋亡形态。
1.3.3Western blotting法检测凋亡相关蛋白表达收集含药或者正常血清培养24 h后的细胞,加入裂解液冰上裂解20 min,以4 ℃、12 000 r/min离心10 min后取上清液,应用超微量核酸蛋白测定仪测定细胞总蛋白含量。制备分离胶和浓缩胶,蛋白上样、电泳、转膜、脱脂奶粉封闭后,加入稀释后的一抗(1∶1 000稀释),4 ℃孵育过夜。洗涤条带,加入二抗(1∶500稀释)室温下孵育4 h,洗涤,化学发光法显影。用Image-Pro Plus软件分析各条带的灰度值,以GAPDH为内参照,计算目的蛋白Bax、Bcl-2和Caspase-3的相对表达水平。
1.3.4RT-PCR法检测凋亡相关基因表达收集含药或者正常血清培养24 h细胞于EP管内,加入1 mL Trizol试剂提取细胞总RNA,检测含量合格后逆转录合成cDNA(按反转录试剂盒要求操作),采用PCR扩增目的基因产物,以β-actin基因为内参照。引物由深圳华大基因公司合成,序列见表1。用2-△△CT法对细胞目的基因bax、bcl-2、caspase-3水平进行定量分析。
以上指标检测各组均用3份血清进行3次独立重复实验。
1.4统计学处理
采用SPSS 21.0软件进行数据分析,计量资料结果用±s表示,多组间比较用单因素或析因设计资料的多因素方差分析,两组间比较用Dunnet-t检验。P<0.05表示差异有统计学意义。
2结果
2.1各组FRTL细胞增殖率比较
析因设计资料的多因素方差分析显示,不同处理方式对FRTL细胞增殖率影响差异有显著意义(F=12.40,P<0.01),而相同处理方式不同时间处理对FRTL细胞增殖率没有显著影响(P>0.05),且处理方式和处理时间无交互效应(P>0.05)。与空白对照组比较,高浓度消瘿方含药血清培养能显著降低FRTL细胞的增殖率(F=6.71、5.85,P<0.05)。与阳性药左甲状腺素钠组比较,高浓度消瘿方含药血清培养后FRTL细胞增殖率差异无显著性(P>0.05)。见表2。
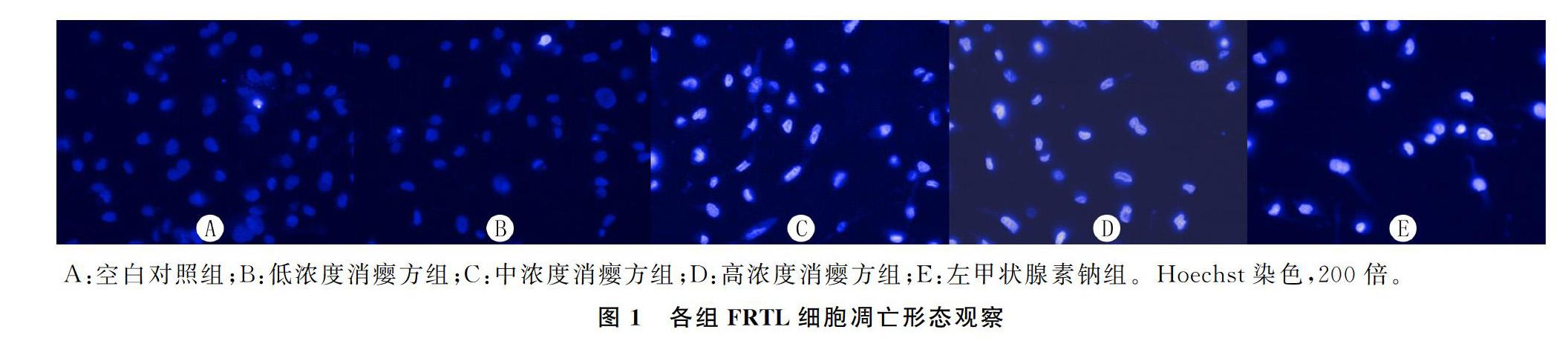
2.2各组FRTL细胞凋亡形态观察
空白对照组FRTL细胞密集、分布均匀,细胞形态正常,荧光呈暗蓝色,无明显的凋亡特征;中、低浓度消瘿方组FRTL细胞数量稍有减少,但细胞形态、密度及荧光颜色与空白对照组比较差异不明显;高浓度消瘿方组及左甲状腺素钠组FRTL细胞数目明显减少,排列散乱无规则,部分细胞核碎裂,细胞透亮,荧光颜色明显,呈现典型的凋亡形态学特征。见图1。
2.3各组FRTL细胞凋亡相关蛋白表达比较
与空白对照组比较,中、高浓度消瘿方含药血清培养能显著增加FRTL细胞促凋亡因子Bax蛋白的表达(F=9.97,P<0.01),降低抗凋亡因子Bcl-2蛋白的表达(F=14.73,P<0.01),升高Bax/Bcl-2比值(F=63.20,P<0.01),上调凋亡执行蛋白Caspase-3的表达(F=53.82,P<0.01)。与左甲状腺素钠组相比较,高浓度消瘿方含药血清培养后FRTL细胞凋亡相关蛋白表达差异无显著性(P>0.05),而中浓度消瘿方含药血清培养后Bax/Bcl-2比值和凋亡执行蛋白Caspase-3表达降低(P<0.01)。与中浓度消瘿方组比较,高浓度消瘿方组Bax/Bcl-2比值和凋亡执行蛋白Caspase-3的表达增高(P<0.01)。见图2和表3。
2.4各组FRTL细胞凋亡相关基因表达比较
与空白对照组比较,中、高浓度消瘿方含药血清培养能显著增加FRTL细胞促凋亡因子Bax基因表达(F=15.52,P<0.01),降低抗凋亡因子bcl-2基因的表达(F=12.83,P<0.01),升高基因bax/bcl-2比值(F=45.89,P<0.01),上调凋亡执行蛋白caspase-3基因的表达(F=21.91,P<0.01)。与左甲状腺素钠组比较,高浓度消瘿方含药血清培养后FRTL细胞凋亡相关基因表达差异无显著意义(P>0.05),而中浓度消瘿方含药血清培养后FRTL细胞基因bax/bcl-2比值降低(P<0.01)。与中浓度消瘿方组相比较,高浓度消瘿方含药血清培养后FRTL细胞基因bax/bcl-2比值显著增高,差异有显著性(P<0.01)。见表4。
3讨论
甲状腺结节属中医“瘿病”范畴,病始在肝,肝气郁滞而化火,灼伤津液而生痰,痰浊内阻,瘀阻脉络,以致气机逆乱,气血通行不畅,集结于颈部,导致此病发生[8]。其中医病机关键是脏腑功能紊乱,气血阴虚失和,气滞、痰凝等有形之邪蕴结于局部而成瘿肿,治当以“益气养阴、祛痰散结”为法。
消瘿方由黄芪、玄参、党参、白芍、北沙参、制香附、浙贝母、夏枯草、柴胡、当归、海浮石、白芥子等药组成。方中以黃芪为君药,益气固表,消肿生肌,并能调节机体免疫及激素平衡;玄参、党参、白芍、北沙参为臣药,助黄芪益气消肿之功效;制香附、浙贝母、夏枯草、柴胡、当归、海浮石及白芥子为佐使药,以行气活血、消肿散瘀、养阴化痰、软坚散结。诸药合用,共奏益气养阴、祛痰散结兼扶正之功。临床研究证实,消瘿方治疗甲状腺结节、桥本甲状腺炎等甲状腺疾病疗效显著[9-11]。
甲状腺细胞的正常增殖与凋亡是维持甲状腺功能的基础,细胞增殖速度过快以及细胞凋亡功能降低均参与了甲状腺结节的形成过程[12]。恢复甲状腺细胞增殖与凋亡的平衡,是治疗该疾病的重要策略[13-14]。本实验采用MTT法观察消瘿方对甲状腺FRTL细胞增殖的影响,结果显示,高浓度消瘿方刺激的含药血清能有效抑制FRTL细胞增殖;但其抑制FRTL细胞增殖效果不呈时间依赖性,因此后续研究中将干预时间设定为24 h。本文应用Hoechst 33258荧光染色法观察细胞凋亡形态,结果显示,高浓度的消瘿方含药血清能导致FRTL细胞数量下降,分布散乱,细胞核碎裂、固缩、透亮,呈现明显的凋亡特征。
Bcl-2家族是目前公认与凋亡密切相关的基因,包括bax、bad等促凋亡因子和bcl-2、bcl-xl等抗凋亡因子基因,其中bax和bcl-2的相对表达水平高低直接决定细胞对凋亡刺激的反应程度[15-16]。抗凋亡因子bcl-2主要是通过抗氧化或抑制氧自由基产生来阻止细胞凋亡,促凋亡因子bax则是通过线粒体途径形成同源二聚体而诱导细胞凋亡,bax/bcl-2间的平衡决定细胞凋亡是否发生[17-20]。研究显示,在甲状腺结节疾病状态下,抗凋亡的bcl-2表达增加而促凋亡的bax下降,导致bax/bcl-2比值异常,凋亡相对不足[21-23]。
Caspase家族是一组存在于细胞质中具有特定结构的蛋白酶,该家族相关蛋白的激活能诱发细胞凋亡,而Caspase家族成员的活性受到Bcl-2家族系列因子的调控[16,24]。其中,Caspase-3是Caspase家族中最关键的成员之一,是细胞凋亡过程中最关键的执行者[26]。本文研究结果显示,消瘿方含药血清能有效增加促凋亡因子bax表达而降低抗凋亡因子bcl-2表达,打破促/抗凋亡因子bax/bcl-2间的平衡,同时上调caspase-3表达,从而诱导甲状腺FRTL细胞凋亡。
综上所述,以“益气养阴、祛痰散结”为治则的消瘿方能抑制甲状腺FRTL细胞增殖,促进其凋亡,其机制可能与破坏促/抗凋亡因子bax/bcl-2间平衡、上调caspase-3表达有关。本研究从细胞层面明确了消瘿方对甲状腺疾病的治疗作用,为该方的临床应用提供了实验依据。下一步拟对该方进行拆解,筛选并明确其发挥疗效的有效成分。
[参考文献]
[1]KARKADA M, COSTA A F, IMRAN S A, et al. Incomplete thyroid ultrasound reports for patients with thyroid nodules: implications regarding risk assessment and management[J]. AJR: American Journal of Roentgenology, 2018,211(6):1348-1353.
[2]朱精强,苏安平. 甲状腺结节手术治疗的合理选择[J]. 中国实用外科杂志, 2015,35(6):635-639.
[3]XU W M, HUO L L, CHEN Z X, et al. The relationship of TPOAb and TGAb with risk of thyroid nodules: a large epidemiological study[J]. International Journal of Environmental Research and Public Health, 2017,14(7):E723.
[4]BARTOLAZZI A, BELLOTTI C, SCIACCHITANO S. Methodology and technical requirements of the galectin-3 test for the preoperative characterization of thyroid nodules[J]. Applied Immunohistochemistry & Molecular Morphology: AIMM, 2012,20(1):2-7.
[5]袁艳倩. 甲状腺结节的中医证候学研究[D]. 北京:北京中医药大学, 2017.
[6]陈玲,郭盼盼,万会娜,等. 中医药治疗甲状腺结节的研究进展[J]. 河北中医, 2019,41(12):1914-1920.
[7]刘志萍,白玉昊,孙莉. 良性甲状腺结节中西医研究的现状与展望[J]. 中医临床研究, 2018,10(3):123-129.
[8]支穎川. 从中医体质学论甲状腺结节的治疗[J]. 环球中医药, 2015,8(5):586-587.
[9]李姗. 消瘿方治疗气阴两虚型桥本甲状腺炎及对甲状腺自身抗体水平的影响[J]. 陕西中医, 2017,38(11):1581-1582.
[10]裴琴. 散结消瘿方治疗甲状腺结节疗效观察[J]. 实用中医药杂志, 2019,35(9):1057-1058.
[11]贡翊斐,王小平,沈睿,等. 消瘿方对微波消融术后甲状腺结节的影响[J]. 现代中西医结合杂志, 2018,27(33):3649-3652.
[12]LIU F Z, LOU K X, ZHAO X T, et al. miR-214 regulates papillary thyroid carcinoma cell proliferation and metastasis by targeting PSMD10[J]. International Journal of Molecular Medicine, 2018,42(6):3027-3036.
[13]LEE H J, LEE W K, KANG C W, et al. A selective cyclin-dependent kinase 4,6 dual inhibitor,Ribociclib (LEE011) inhibits cell proliferation and induces apoptosis in aggressive thyroid cancer[J]. Cancer Letters, 2018,417:131-140.
[14]CARVALHO D O, FREITAS J, NOGUEIRA P, et al. Xanthohumol inhibits cell proliferation and induces apoptosis in human thyroid cells[J]. Food and Chemical Toxicology: an International Journal Published for the British Industrial Biological Research Association, 2018,121:450-457.
[15]张勤丽,牛侨. 细胞凋亡机制概述[J]. 环境与职业医学, 2007,24(1):102-107.
[16]DERAKHSHAN A, CHEN Z, VAN WAES C. Therapeutic small molecules target inhibitor of apoptosis proteins in cancers with deregulation of extrinsic and intrinsic cell death pathways[J]. Clinical Cancer Research: an Official Journal of the Ame-rican Association for Cancer Research, 2017,23(6):1379-1387.
[17]NAVEENKUMAR S K, HEMSHEKHAR M, SUNDARAM M S, et al. Cell-free methemoglobin drives platelets to apoptosis via mitochondrial ROS-mediated activation of JNK and p38 MAP kinase[J]. Biochemical and Biophysical Research Communications, 2017,491(1):183-191.
[18]LI D G, WANG K L, ZHANG W, et al. Expression of bax/bcl-2, TGF-β1, and type Ⅲ collagen fiber in congenital muscular torticollis[J]. Medical Science Monitor, 2018,24:7869-7874.
[19]李金贵,刘川,万华,等. 白藜芦醇诱导前列腺癌细胞凋亡的实验研究[J]. 遵义医学院学报, 2018,41(3):272-276.
[20]王利娟,谷丽娟,孙颖川. miR-92a对宫颈癌细胞增殖凋亡影响及其机制[J]. 青岛大学学报(医学版), 2019,55(4):406-410.
[21]ALVA-SNCHEZ C, SNCHEZ-HUERTA K, ARROYO-HELGUERA O, et al. The maintenance of hippocampal pyramidal neuron populations is dependent on the modulation of specific cell cycle regulators by thyroid hormones[J]. Brain Research, 2009,1271:27-35.
[22]BARTOLAZZI A, SCIACCHITANO S, DALESSANDRIA C. Galectin-3: the impact on the clinical management of patients with thyroid nodules and future perspectives[J]. International Journal of Molecular Sciences, 2018,19(2):E445.
[23]VIACAVA P, BOCCI G, TONACCHERA M, et al. Markers of cell proliferation, apoptosis, and angiogenesis in thyroid adenomas: a comparative immunohistochemical and genetic investigation of functioning and nonfunctioning nodules[J]. Thyroid: Official Journal of the American Thyroid Association, 2007,17(3):191-197.
[24]岳原亦,張扬,张一奇. Caspase家族与细胞凋亡[J]. 中国医疗前沿, 2011,6(6):25-26.
[25]冯健愉,朱玉山,陈佺,等. Bcl-2家族蛋白的生理功能及结构基础[J]. 中国细胞生物学学报, 2019,41(8):1477-1489.
[26]赵瑞杰,李引乾,王会,等. Caspase家族与细胞凋亡的关系[J]. 中国畜牧杂志, 2010,46(17):73-78.
(本文编辑 黄建乡)
