鞘内注射ETAR拮抗药对大鼠骨癌疼痛改善情况及其对ERK通路的影响
2021-05-08何远山伊国恩李泽清
何远山,苏 宏,伊国恩,张 敏,徐 鹏,李泽清
骨癌痛(bone cancer pain,BCP)主要是由原发性恶性肿瘤,如乳腺癌、骨癌、肺癌等中晚期继发性骨转移引起,常引起剧烈疼痛反应[1]。目前,恶性肿瘤发病率不断上升,随之引起的骨癌痛病例数不断增加,严重影响人们的生活质量[2,3]。BCP发病机制十分复杂,目前尚未完全阐明,且尚无特异性根治手段,临床约45%的BCP患者疼痛无法有效控制,因此明确BCP发病机制有助于制定有效的防治措施。内皮素A受体(endothelin A receptor,ETAR)属于特异性G蛋白偶联受体,分布于中枢神经系统细胞跨膜区。研究显示,内皮素1(endothelin-1,ET-1)可通过激活ETAR参与调控炎症痛及神经病理性疼痛,说明阻断ETAR可选择性减少传入初级伤害感受器,进而减轻疼痛作用[4]。研究认为,BCP与神经病理性疼痛机制具有相似之处[5],但关于ET-1及其受体在BCP中的变化尚不清楚。为此,本研究通过建立BCP大鼠模型,观察鞘内注射ETAR拮抗药对BCP大鼠疼痛的影响,并初步探讨其调控机制,为临床BCP的治疗提供理论参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雌性SD大鼠,3周龄5只,体质量(60±6) g,7周龄60只体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证号【SCXK(京)2019-0009】;饲养于12 h/12 h明暗交替、恒温恒湿环境下,自由饮水和摄食,动物实验过程符合减少、替代和优化3R原则。
1.1.2 主要试剂和仪器 Walker256乳腺癌肉瘤细胞株,购自中国医学科学院药物研究所。ETAR受体拮抗药BQ123(美国Calbiochem公司),RT-qPCR试剂盒(北京全式金生物技术有限公司),BCA蛋白定量分析试剂盒(美国Thermo公司),兔抗大鼠ET1、ETAR、细胞外调节蛋白激酶1/2(extracellular regulatory protein kinase,ERK1/2)、磷酸化ERK1/2(phosphorylated ERK1/2,p-ERK1/2)多抗(一抗,美国Abcam公司),辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗(美国Santa Cruz公司),Von Frey电子痛阈测量仪(美国IITC公司),医学X线摄像系统(荷兰Philips公司),Image J图像分析软件(日本尼康公司)。
1.2 方法
1.2.1 BCP模型制备 取对数期生长Walker256细胞,调整细胞密度为1×106/ml接种至3周龄大鼠腹腔,1 ml/只,常规饲养7 d,收集腹水,1000 r/min离心5 min,取沉淀,经Hank液洗涤、去除红细胞,并用生理盐水调整细胞密度为1×108/ml备用。参照文献[6]建立骨癌痛BCP大鼠模型:腹腔注射戊巴比妥那麻醉,左后肢剃毛消毒,切开皮肤,钝性分离肌肉组织,用牙科探针在胫骨干骺端平台处打孔,避开髌韧带,采用微量注射器,注入10 μl Walker256细胞混悬液,拔出针头后用医用胶水封堵针孔,缝合并消毒伤口,分笼饲养,自由饮水和进食。
1.2.2 鞘内置管术 取60只成年雌性大鼠,腹腔注射戊巴比妥那麻醉,沿L5~6间隙作水平皮肤切口,将无菌导管经棘突间隙向头端置入约2.5 cm,并做皮下隧道,将导管封闭后固定于颈背,缝合伤口,大鼠清醒后,经导管注入2%利多卡因10 μl,30 s内出现双后肢麻痹则判定置管成功,分笼饲养,置管后3 d内腹腔注射20万U青霉素预防感染。
1.2.3 分组及干预 置管成功大鼠,随机分为假手术(sham)组、假手术+生理盐水(sham+NS)组、BCP组、BCP+ETAR拮抗药(BCP+BQ123)组。BCP组、BCP+BQ123组建立BCP大鼠模型,sham组、sham+NS同法注射等量生理盐水。造模第14天,评估机械性缩足反射阈值(pain withdrawal threshold,PWT)较注射CFA前显著降低提示建模成功,否则剔除。
取建模成功BCP组13只,BCP+BQ123组、sham组、sham+BQ123组各14只,于建模后第14天,BCP+BQ123组、sham+BQ123组分别鞘内注射30 μmol的BQ123 7 μl,BCP组、sham组鞘内注射7 μl生理盐水,以小鼠出现甩尾反应为注射成功。
1.2.4 疼痛行为学检测 鞘内注射前即刻,注射后0.5、1.0、1.5、2.0、2.5、3.0 h分别评估各组大鼠疼痛行为学。参照文献[7]应用Von Frey痛阈测量仪检测患肢PWT值:安静环境适应20 min左右,刺激针垂直刺激跖部,序贯增加刺激强度,每种强度检测5次,每两次间隔30 s,记录使大鼠产生抬足反射的最小刺激强度作为PWT。参照文献[8],将小鼠置于60 cm×30 cm×10 cm透明玻璃箱,记录2 min内大鼠出现自发抬足次数(number of spontaneous flinches,NSF),记录5次平均值,每次间隔15 min。
1.2.5 胫骨X射线检查 建模第14天,末次评估大鼠疼痛行为学后,戊巴比妥那腹腔注射麻醉大鼠,固定患肢,采用医学X线摄像系统(射线强度50 kV,时间90 s)对大鼠胫骨拍片,分析X线片提示的骨质破坏情况。
1.2.6 脊髓ET1、ETAR、ERK1/2 mRNA表达量检测 X线片拍摄结束后处死各组大鼠,取L4~6节段脊髓,-80 ℃保存。取50 mg脊髓组织,组织剪剪碎后,采用Trizol法提取脊髓组织总RNA,反转录合成cDNA,并以之为模板进行实时荧光定量PCR(real-time quantitative PCR,RT-qPCR),按照试剂盒说明书设定反应体系,并按照反应条件:94℃预变性5 min;(94 ℃变性20 s,58 ℃退火45 s,72 ℃延伸60 s)40个循环扩增。以β-actin为管家基因,2-ΔΔCT为目的基因的相对表达强度。引物序列:ET1: F:5′-ACGCTAGCTGATGCTAGCTAG-3′,R:5′-ATACCATGGCTGATGCTGATC-3′;ETAR:F:5′-CCATGCACTAGCGTAGCA-3′,R:5′-GCTAGTCGATGCTGACCT-3′;ERK1/2:F:5′-TAGCTCGTAGCTGATAGCT-3′,R:5′-CCGATGCTGATGCTGATGC-3′;β-actin:F:5′-CCTAGCTAGCCTAGCTGATGC-3′, R:5′-GCTGATCCTGATGTCGTAGTC-3′。
1.2.7 脊髓ET1、ETAR、ERK1/2、p-ERK1/2蛋白表达量检测 取50 mg脊髓组织,加入液氮进行研磨,转至离心管中,加入0.5 ml细胞裂解液,于冰上孵育20 min,12 000 r/min离心15 min(离心半径12 cm),取上清液,进行BCA蛋白定量;取50 μg待测蛋白,加入等量上样缓冲液后,沸水浴10 min变性,再次离心后取上清液,进行SDS-PAGE电泳分离,将分离胶蛋白转移至硝酸纤维素膜上,然后将膜放入封闭液中室温封闭2 h,加入稀释一抗(1∶500),4 ℃摇床孵育过夜,PBST洗涤3次×10 min,加入稀释二抗(1∶5000),室温孵育2 h,洗涤后暗室曝光和显影,条带拍照后采用Image J软件进行灰度值分析,以目的蛋白ET1、ETAR、ERK1/2、p-ERK1/2灰度值与β-actin灰度值比值表示蛋白相对表达量。
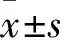
2 结 果
2.1 注射不同时间点机械痛阈值变化 与sham组、sham+BQ123组比较,注射前BCP组、BCP+BQ123组的PWT均降低(P<0.05),鞘内注射后0.5~3.0 h,BCP组保持不变,BCP+BQ123组先升高后降低,于1.5 h达到最高,3.0 h恢复至注射前水平(P<0.05,表1)。

表1 4组骨癌疼痛大鼠注射治疗前后PWT值比较
2.2 注射不同时间点自发抬足次数变化 与sham组、sham+BQ123组比较,注射前BCP组、BCP+BQ123组的NSF均增多(P<0.05),鞘内注射后0.5~3.0 h,BCP组保持不变,BCP+BQ123组先减少后增多,于1.5 h达到最少,3.0 h恢复至注射前水平(P<0.05,表2)。
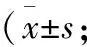
表2 4组骨癌疼痛大鼠注射治疗前后NSF值比较 次)
2.3 胫骨骨质变化观察 胫骨骨质X线摄像显示,sham组和sham+BQ123组胫骨骨质密度均匀、骨皮质连续无缺失(图1A);BCP组注射后14 d出现大范围骨破坏、骨皮质缺损严重(图1C);BCP+BQ123组股骨远端见较小骨破坏病灶,部分皮质缺损(图1B)。
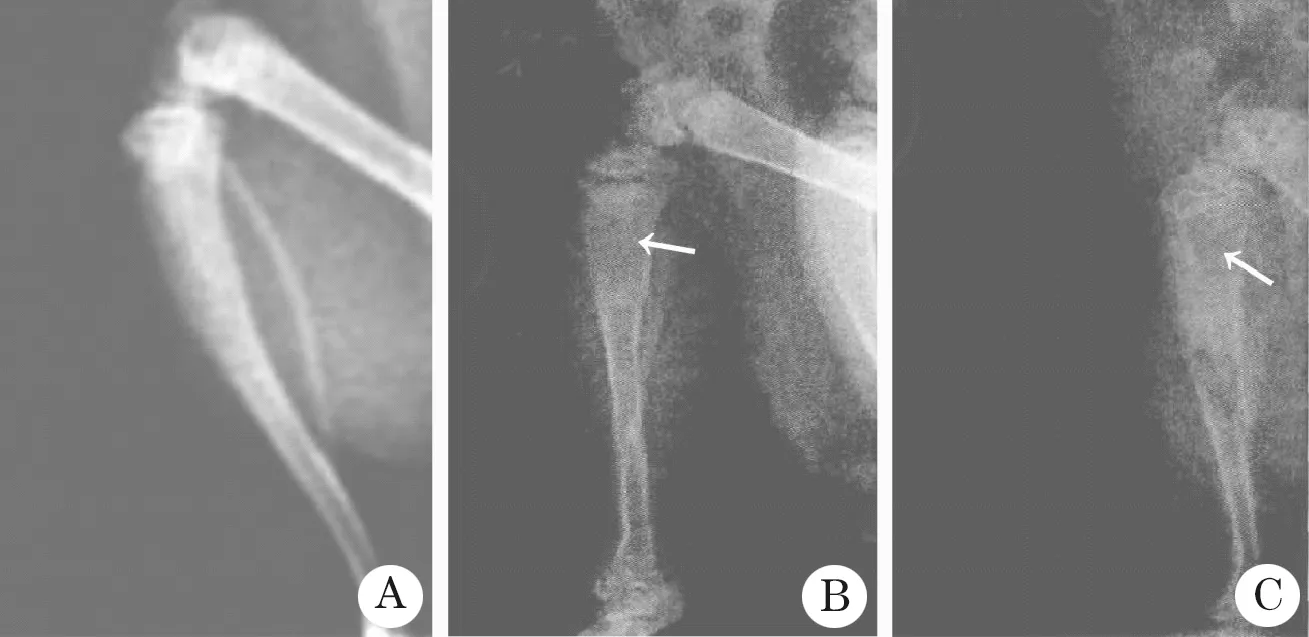
图1 大鼠胫骨癌建模后14 d X线片
2.4 脊髓ET1、ETAR、ERK1/2 mRNA表达量比较 脊髓ET1、ETAR mRNA相对表达量组间比较,差异有统计学意义(P<0.05);ERK1/2 mRNA相对表达量组间比较,差异无统计学意义(P<0.05)。与sham组、sham+BQ123组比较,BCP组、BCP+BQ123组脊髓ET1、ETAR mRNA相对表达量均升高,且BCP+BQ123组低于BCP组,差异有统计学意义(P<0.05,表3)。
2.5 脊髓ET1、ETAR、ERK1/2、p-ERK1/2蛋白表达量比较 脊髓ET1、ETAR、p-ERK1/2蛋白相对表达量组间比较,差异有统计学意义(P<0.05);ERK1/2蛋白相对表达量组间比较,差异无统计学意义(P<0.05)。与sham组、sham+BQ123组比较,BCP组、BCP+BQ123组脊髓ET1、ETAR、p-ERK1/2蛋白相对表达量均升高,且BCP+BQ123组低于BCP组,差异有统计学意义(P<0.05)。见图2和表4。

表3 4组骨癌疼痛大鼠脊髓ET1、ETAR、ERK1/2 mRNA相对表达量比较
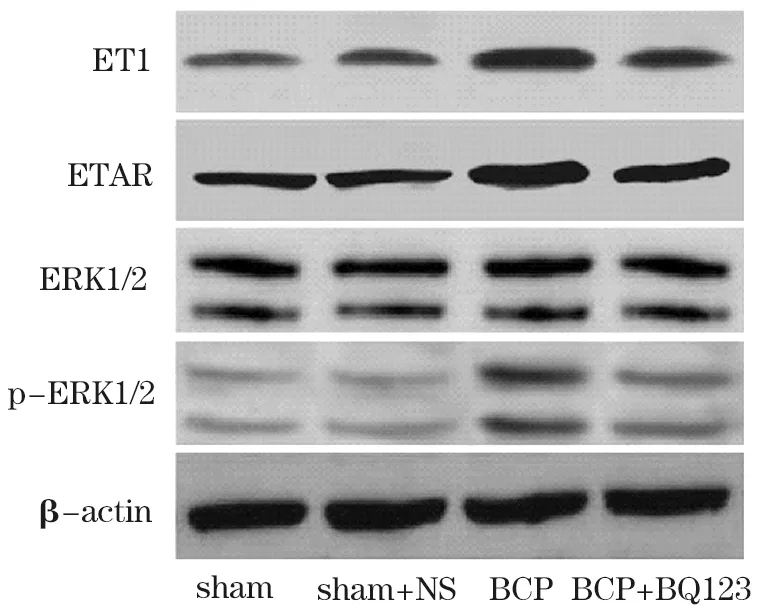
图2 骨癌大鼠脊髓ET1、ETAR、ERK1/2、p-ERK1/2蛋白免疫印迹

表4 4组骨癌疼痛大鼠脊髓ET1、ETAR、ERK1/2蛋白相对表达量比较
3 讨 论
临床调查显示,骨癌患者及1/3恶性肿瘤骨转移患者均会发生BCP,癌细胞侵袭骨骼及周围组织,可导致剧烈疼痛,并伴随脊柱稳定性降低、骨折等严重并发症,对患者身心均造成巨大影响[8]。目前,临床常应用非甾体类抗生素、双磷酸盐等药物控制疼痛反应,但效果多不理想,且不良反应明显[9,10]。因此,寻找有效的治疗靶点对BCP的防治有重要临床意义。BCP发病机制复杂,其发病特征与神经病理性疼痛相似。神经调质ET-1及其受体(ERAR、ERBR)广泛表达于中枢神经系统,动物学研究显示,神经病理性疼痛模型大鼠中枢神经系统中ERAR、ERBR基因处于过表达状态,提示ET-1可通过调控其受体参与疼痛的发生[11],因此,ERAR可能成为BCP新的治疗靶点。
本研究通过股骨骨髓腔接种鼠源Walker456乳腺癌细胞建立BCP模型,第14天大鼠表现为PWT降低和NSF增多,X线片显示大范围骨破坏、骨皮质缺损严重,提示BCP建模成功。本研究鞘内注射ERAR拮抗药干预后,BCP+BQ123组的PWT先升高后降低,NSF先减少后增多,PWT和NSF均于1.5 h达到最高和最少,3.0 h恢复至注射前水平,且X线片显示骨破坏病灶及皮质缺损程度较BCP组减轻,提示鞘内注射ETAR拮抗药可有效改善BCP大鼠的疼痛反应。ET-1属于氨基酸多肽链,通过自分泌或旁分泌方式,与其受体结合发挥作用,ERAR是位于细胞跨膜区的ET-1受体之一,两者广泛表达于中枢及外周神经系统,在神经病理性疼痛反应中发挥重要调控作用[12]。ET-1在外周神经系统中具有致痛作用,Tang等[13]应用ET-1诱发骨转移癌痛小鼠模型,且注射ETAR拮抗药BQ123后可逆转疼痛行为,与本研究结果相似。骨癌或恶性肿瘤骨转移发生过程中,肿瘤组织通过分泌转化生长因子、肿瘤坏死因子α、内皮素等刺激性神经化学因子,激活和敏化相应受体后,将各种有害刺激通过受体转化为电化学信号,传入神经元,从而导致中枢敏化、痛阈降低等[14]。
此外,本研究发现,BCP组脊髓中ET1、ETAR mRNA和蛋白及p-ERK1/2蛋白表达量均升高,提示BCP疼痛反应与脊髓ET-1及ETAR上调有关,进一步鞘内注射ERAR拮抗药后,脊髓ET1、ETAR mRNA和蛋白及p-ERK1/2蛋白表达降低,说明ETAR拮抗药可能通过抑制脊髓ERK通路发挥抑制疼痛反应的作用。ERK信号通路是调节神经元及突触可塑性的重要通路。近年来研究发现,该信号通路在BCP发生和发展过程中发挥重要调控作用,BCP发生后该信号通路处于激活状态,而抑制该信号通路可减轻BCP疼痛反应[15]。Shenoy等[16]研究发现,生长抑素受体激动剂J-2156可通过抑制脊髓组织中ERK磷酸化水平而缓解BCP大鼠疼痛反应;Nakamura等[17]发现,过量μ-阿片受体激动剂可增加BCP小鼠ERK磷酸化水平,抑制ERK磷酸化水平可抵抗BCP小鼠疼痛效应。上述研究均说明,ERK信号通路在BCP发生及维持期间被激活。本研究鞘内注射ERAR拮抗药后,ETAR基因和蛋白表达水平及ERK1/2磷酸化水平均被抑制,疼痛行为学得以改善,说明ETAR拮抗药可能通过抑制ERK1/2磷酸化水平,抑制伤害性刺激信号的传导,阻断其传入初级神经元,从而降低中枢和外周敏化,发挥镇痛作用。
综上所述,BCP疼痛反应与脊髓ET-1及ETAR有关,鞘内注射ETAR拮抗药可有效改善BCP大鼠的疼痛反应,可能通过抑制脊髓ERK通路发挥调控作用。在进一步的研究中应设计挽回实验,证实ERAR拮抗药与ERK信号通路的因果关系,为临床中BCP的治疗提供可靠靶点。
