帕博利珠单抗联合卡铂、白蛋白紫杉醇治疗晚期非小细胞肺癌的疗效及安全性
2021-05-08陈维英净卫娟辛玉珍杨秀丽刘世珍
陈维英,净卫娟,辛玉珍,杨秀丽,刘世珍
1 青海红十字医院,西宁810000;2 青海省心脑血管病专科医院
卡铂是晚期非小细胞肺癌(NSCLC)常用的一线化疗药物,该药物往往联合贝伐珠单抗成为Ⅳ期NSCLC 的一种有效治疗方案[1]。随着临床肿瘤治疗技术的不断进步,人们发现以免疫检查点抑制剂为代表的肿瘤免疫治疗也可在NSCLC 的治疗中显示较好疗效,即便是已有多发转移和耐药的人群也能从中获益,其中代表性药物如帕博利珠单抗和阿特珠单抗已被美国食品药品管理局(FDA)批准可用于治疗晚期转移性NSCLC[2]。紫杉醇类药物为恶性肿瘤治疗的常用化疗药物,其中的白蛋白结合型紫杉醇是半合成紫杉醇类特殊靶向制剂,对肝癌、乳腺癌、卵巢癌等实体肿瘤显示出较好的疗效和安全性[3]。目前,帕博利珠单抗联合卡铂、白蛋白紫杉醇治疗晚期NSCLC 的报道较少,本研究回顾性分析该联合方案治疗78 例Ⅳ期NSCLC 患者的疗效和安全性,旨在为临床推广应用提供参考依据。
1 资料与方法
1.1 临床资料 2018 年11 月—2019 年7 月在青海红十字医院住院治疗Ⅳ期NSCLC 患者78 例,男53例、女25 例,年龄62~83(73.27 ± 4.89)岁;患者均经病理学或细胞学确定诊断,临床分型为腺癌43例、鳞癌19 例、大细胞癌9 例、肉瘤样癌7 例。美国东部肿瘤协作组(ECOG)评分0 分49 例,1 分29 例;吸烟31例,不吸烟47例;PD-L1表达阳性20例,表达阴性58例。纳入标准:①年龄≥60岁;②入院前未接受任何抗肿瘤治疗;③UCC 肺癌TNM 分期评定为临床Ⅳ期;④ECOG 评分0~1 分,预期生存期超过3 个月;⑤根据实体瘤疗效评估标准(RECIST)1.1,至少有一个可测量病灶;⑥无表皮生长因子受体、间变淋巴瘤激酶基因突变;⑦存在适宜的器官功能,治疗前2 周内未接受输血或造血刺激因子治疗,中性粒细胞≥1.5×109/L、血小板≥100×109/L、血红蛋白≥100 g/L、血清白蛋白≥30 g/L、总胆红素≤1.5×最高上限值、谷丙转氨酶和谷草转氨酶≤2.5×最高上限值、血肌酐≤1.5×最高上限值、肌酐清除率≥50 mL/min;⑧可提供切片进行PD-L1 检测;⑨能耐受本研究中的化疗药物。排除标准:①首次给药前5 年内已诊断为其他恶性肿瘤,不包括可治愈的宫颈原位癌、皮肤基底细胞癌或鳞状细胞癌,或任何已治愈(5 年内无疾病复发的证据)的其他肿瘤;②当前需要治疗或未经控制的中枢神经系统转移肿瘤;③患有先天或后天免疫功能缺陷(如HIV 感染者);④活动性乙肝或丙肝;⑤严重肝肾功能障碍、严重贫血、严重凝血功能障碍;⑥有本研究化疗药物禁忌证;⑦妊娠期和哺乳期妇女。本研究经医院医学伦理委员会批准实施,批件号为[2018]41 号;患者对本研究内容知情同意。
1.2 治疗方法 治疗前患者均进行相关临床检验和影像学检查,经评估合格后采用以下药物治疗。帕博利珠单抗注射液[规格100 mg/4 mL/支,注册证号S20180019,MSD Ireland(Carlow)生产]每次200 mg,3 周1 次静脉滴注,治疗6 周时进行疗效评价。白蛋白紫杉醇(规格100 mg,注册证号H20130650,美国Abraxis Bio Science,LLC 生产)130 mg/m2用100 mL 生理盐水稀释后于治疗周期的第1、8 天静脉滴注,滴注时间为30 min,3 周为1 个治疗周期,最少治疗2 个周期。注射用卡铂(规格150 mg/15mL/支,注册证号H20110231,意大利百时美施贵宝公司生产)按照AUC=5 mg/(mL·min)静脉滴注,治疗周期的第1天1次静脉滴注,3周为1个治疗周期。卡铂每个周期治疗前常规进行血常规、血生化、凝血功能、甲状腺功能以及心电图检查,患者使用药物直至出现不可耐受的毒性、疾病进展、受试者死亡、失访或撤回知情同意,以先发生为准。在治疗过程中如发生与卡铂相关的3 级及以上的不良反应,卡铂在下1 个周期需减量20%,如再次发生则再减量20%,最多允许减量2 次,如仍不能耐受则考虑停止。如出现与帕博利珠单抗相关的3级及以上不良反应,需暂停给药直至不良反应消失后再进行;帕博利珠单抗不允许剂量下调,如再次发生3 级及以上不良反应则考虑永久停药。
1.3 疗效评定及安全性随访 治疗期间患者每6周进行1 次影像学检查,根据RECIST 1.1 进行疗效评定[4],分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD);首次疗效评定为CR、PR 的患者需要在6 周后进行疗效确认。计算患者客观缓解率(ORR)、疾病控制率(DCR),记录患者总生存期(OS)、无进展生存期(PFS)。如在死亡之前就已经失访的患者,将最后一次随访时间记录为死亡时间。从患者接受治疗开始收集其治疗相关的不良事件,不良事件的评价标准参考美国国立癌症研究所通用毒性反应标准5.0版。随访截止时间为2020年7月31日。
1.4 统计学方法 采用SPSS 22.0 软件进行统计分析。计量资料不符合正态分布以中位数表示,组间比较采用秩和检验;计数资料以例数和百分比表示。绘制Kaplan-Meier 生存曲线,观察不同临床特点患者之间总生存期和无进展生存期的差异。P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC 患者总体临床疗效 78 例患者均可进行疗效评定,CR 12例、PR 28例、SD 23例,PD 15例,ORR 为51.28%,DCR 为80.77%。截止到随访时间,仍有25 例患者继续接受治疗。患者中位OS 和中位PFS 分别为11.81(95%CI10.61~13.05)个月和9.76(95%CI8.51~11.12)个月。
2.2 不同临床特点NSCLC 患者疗效比较 53例男性患者中位OS 11.15 个月、中位PFS 9.25 个月,25例女性患者中位OS 11.56 个月、中位PFS 9.53 个月,不同性别OS、PFS 比较无统计学差异(P均>0.05)。29 例ECOG 评分1 分患者中位OS 10.44 个月、中位PFS 8.24个月,49例ECOG 评分0分患者中位OS 13.81 个月、中位PFS 11.52 个月,不同ECOG评分OS、PFS 比较无统计学差异(P均>0.05)。58例PD-L1 阴性表达患者中位OS 12.43 个月、中位PFS 10.31 个月,20 例阳性表达患者中位OS 9.04 个月、中位PFS 7.13个月,不同PD-L1表达患者OS、PFS比较有统计学差异(P均<0.05)。31 例吸烟患者中位OS 8.18 个月、中位PFS 6.21 个月,47 例不吸烟患者中位OS 12.95 个月、中位PFS 10.93 个月,吸烟与不吸烟患者OS、PFS比较有统计学差异(P均<0.05)。不同临床特点NSCLC患者的生存曲线见图1。
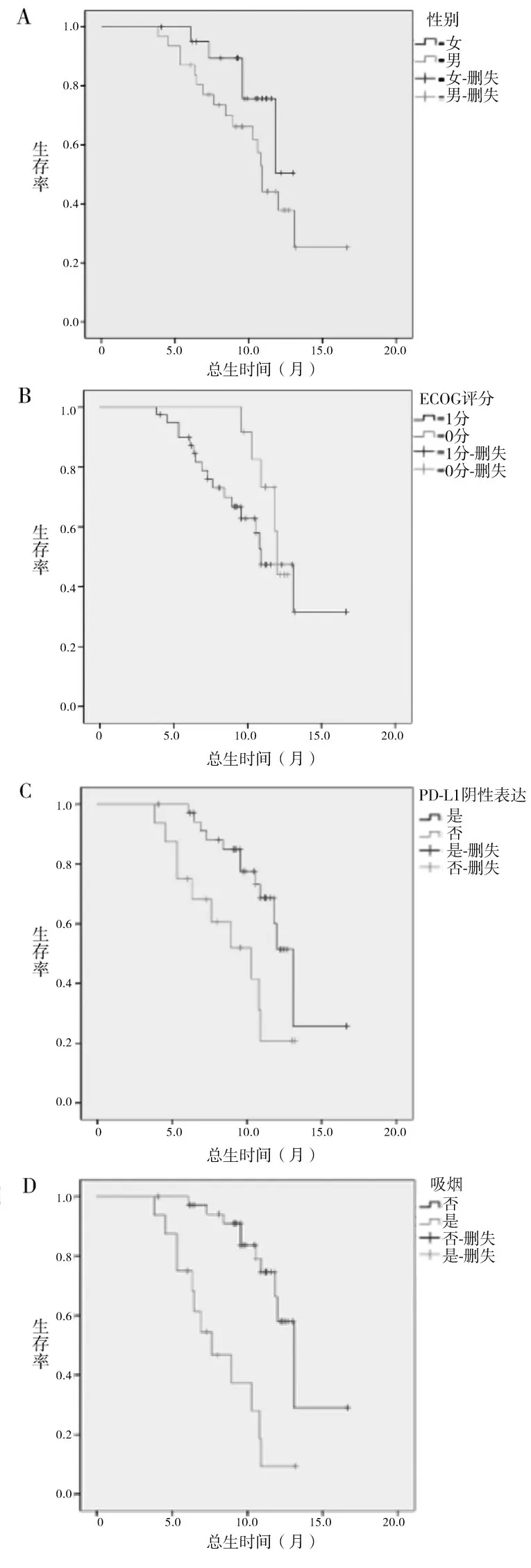
图1 不同临床特点NSCLC患者的生存曲线。
2.3 不良反应发生情况 主要不良反应包括血小板计数减少13 例(16.67%),白细胞计数降低15 例(19.23%),贫血14例(17.95%),天冬氨酸氨基转移酶升高16 例(20.51%),丙氨酸氨基转移酶升高18例(23.08%),呕 吐9 例(11.54%),恶 心11 例(14.10%),乏力14 例(17.95%),皮肤毒性17 例(21.79%),甲状腺功能异常27 例(34.62%)。上述大多数不良反应经对症处理后明显减轻或消失,未影响联合治疗方案正常实施,总体安全性良好。
3 讨论
NSCLC 患者发病率高、病程短、预后较差,且发病隐匿,大多数患者发现时已经处于中晚期,无法进行手术治疗,只能采取化疗、生物治疗、免疫治疗等保守治疗方式延长生存期提高生活质量[5]。目前临床上常用的一线化疗药物主要以卡铂为主,为第2代铂类抗癌药,其活性与顺铂相当,抗癌谱相似,能引起DNA 链间与链内交联,破坏DNA 分子结构而抑制肿瘤生长,且化学稳定性好[6]。白蛋白结合型紫杉醇是一种新型白蛋白溶剂型纳米紫杉醇,以人血白蛋白为载体携带紫杉醇并通过激活细胞膜上的小窝蛋白,经由血管内皮细胞将紫杉醇转运入肿瘤组织中,为NSCLC 优选的治疗药物之一,常与铂类药物联合应用,临床治疗效果良好[7]。
近年来随着免疫治疗药物的不断兴起,适于NSCLC 治疗的多个PD-1单抗药物获批临床应用,其中帕博利珠单抗可用于NSCLC患者治疗的以下3种方案:①PD-L1 高表达,无表皮生长因子受体、间变淋巴瘤激酶基因突变的转移性NSCLC 单药一线治疗;②PD-L1 高表达,经过含铂方案或表皮生长因子受体、间变淋巴瘤激酶基因突变一线治疗后的转移性NSCLC 治疗;③联合培美曲塞卡铂作为转移性NSCLC 一线治疗[8-9]。PD-1 抑制剂药物与免疫细胞膜表面的PD-1 结合,阻断PD-1/PD-L1 相互作用,同时保留宿主T 细胞的抗肿瘤功能,促使T 淋巴细胞攻击肿瘤细胞,以达到抗肿瘤的目的[10]。帕博利珠单抗是一种人源化的抗PD-1单克隆抗体,能够增强抗肿瘤免疫活性,FDA 于2015 年批准该药物在美国上市,已被指南推荐为治疗NSCLC 的一线药物[11]。研究显示,晚期非鳞NSCLC患者采用PD-1单抗联合化疗方案治疗,生存期可长达5 年[12]。在NSCLC 患者中,鳞癌只占其中新发病例的30%左右,非鳞癌患者占据更大的比例[5],本文非鳞癌患者占76%。因此,PD-1单抗的应用给晚期许多NSCLC 患者带来了新的希望。
目前,NSCLC 患者采用PD-1单药联合1种化疗药物的两联方案报道较多,三联方案在NSCLC 中的研究鲜有报道。本文研究显示,帕博利珠单抗联合卡铂、白蛋白紫杉醇三联方案治疗NSCLC的ORR为51.28%,与既往报道的帕博利珠单抗联合培美曲塞或铂类化疗一线治疗无表皮生长因子受体、间变淋巴瘤激酶基因突变的转移性非鳞状NSCLC的疗效相当(ORR为49%)[13]。本研究ORR未见明显提高,考虑可能与样本量小以及患者入组前未对PD-L1表达水平进行限制有关。本研究随访时间有限,平均14个月左右,患者中位OS 和PFS 分别为11.81 个月和9.76 个月,与既往王震等[14]研究结果基本一致。截止到随访时间,本研究仍有25例患者继续治疗,因此后续研究的中位OS和PFS理论上应该高于当前的数据。本研究中患者不良反应主要发生在血液、消化系统,大多数不良反应经对症处理后明显减轻或消失,未影响联合治疗方案正常实施,总体安全性良好。
为进一步探索该治疗方案的优势人群,本研究对不同临床特点NSCLC 患者的疗效进行比较。显示不同性别、不同ECOG 评分患者中位OS 和PFS 未见统计学差异,不同PD-L1表达患者、吸烟与不吸烟患者OS、PFS 比较有统计学差异,即PD-L1 阴性表达、不吸烟患者采用该方案治疗获益优势明显。研究显示,PD-L1 表达与患者性别、年龄、分化程度、ECOG 评分等无相关性,肿瘤细胞PD-L1 表达状态可作为抗PD-1/PD-L1 抗体使用临床获益的预测指标,PD-1 单抗联合化疗对NSCLC 患者PD-L1 阴性表达人群有显著疗效[15]。PD-L1 表达是肿瘤逃避机体自身免疫反应的重要机制,PD-L1 阳性高表达NSCLC 患者预后不良,生存期短[16]。肺癌流行病学调查显示,吸烟不仅是肺癌发病重要原因,也是影响晚期NSCLC 患者生存时间的独立影响因素,不吸烟NSCLC患者预后更好[17]。
综上所述,帕博利珠单抗联合卡铂、白蛋白紫杉醇治疗Ⅳ期NSCLC 患者有显著疗效,且安全性可控,具有良好的临床应用前景。但是,本研究为回顾性分析且样本量较小,无法避免回忆偏倚和数据偏倚。因此,上述结论还需进一步开展多中心大样本的前瞻性随访研究证实。
