2 型糖尿病患者血糖波动与骨代谢指标及骨密度的关系
2021-05-08蒋晓南李全忠
蒋晓南,李全忠
1 河南大学人民医院,郑州450003;2 河南省人民医院
半个世纪前,人们就已经认为糖尿病与骨骼脆弱相关[1]。随着人均寿命的延长及社会老龄化的加重,糖尿病患者骨质疏松和骨折的发生率显著增加[2],糖尿病与骨骼脆弱的关系得以进一步证实,2型糖尿病(T2DM)患者成为骨质疏松发生的高危人群[3]。虽然骨质疏松可以通过测量骨密度(BMD)来确诊,但BMD 无法反映机体骨基质的变化,不能早期诊断是否存在骨质疏松。血清骨代谢指标可早期反映骨代谢情况,在骨质疏松及代谢性骨病的诊断、疗效评估以及分类中发挥着重要作用。目前临床中关于T2DM 患者骨质疏松的发生机制并未明确,但已有研究证实血糖波动与骨代谢之间存在相关性[4-5]。血糖波动可通过扫描式葡萄糖监测(FGM)系统每15 min自动记录一次葡萄糖值描述血糖变异性,FGM 最长可佩带14 d[6],且研究证实2~3 d 的血糖监测已有足够的可靠性[7]。本文探讨T2DM 患者日内血糖波动指标与骨代谢指标及BMD 之间的相关性,为糖尿病慢性并发症的控制提供依据。
1 资料与方法
1.1 临床资料 2018 年9 月—2020 年8 月于河南省人民医院内分泌科住院且均佩戴雅培公司FGM系统监测血糖的T2DM 患者213 例,男149 例、女64例,年龄(53.38 ± 12.33)岁。纳入标准:①均符合1999 年WHO 糖尿病分型诊断标准;②均佩戴雅培扫描式葡萄糖监测仪。排除标准:①T1DM 患者;②胶带过敏者;③长期卧床,服用维生素D、糖皮质激素等影响骨代谢的药物;④其他可引起继发性骨质疏松的疾病如甲状腺功能亢进症、类风湿关节炎等;⑤严重糖尿病急慢性并发症或病情危重患者。本研究获河南省人民医院伦理委员会批准实施,患者对本研究均知情同意。
1.2 血糖监测及分组 患者均佩戴雅培公司FGM系统监测血糖至少7 d,剔除前2 d血糖数据,纳入后5 d 共480 个血糖数据。利用Matlab2018 软件计算血糖波动指标即血糖水平标准差(SDBG)、日平均血糖 波 动 幅 度(MAGE)[8]及 最 大 血 糖 波 动 幅 度(LAGE)。根据SDBG 分为两组,SDBG<2.0 mmol/L者为血糖波动正常组,SDBG≥2.0 mmol/L 者为血糖波动异常组。
1.3 血液生化指标检测 患者禁食12 h 后采集次日清晨空腹血5 mL,4 000 r/min 离心5 min,分离血清。采用雅培C1602126 型生化分析仪检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白蛋白、钙、磷等。采集空腹静脉血5 mL,采用高效液相层析法测定糖化血红蛋白(HbA1c)。
1.4 骨代谢指标及BMD 检测 采用电化学发光法测定患者骨代谢指标包括骨钙素(OC)、总I 型前胶原氨基端延长肽(T-P1NP)和I型胶原羧基端肽交联(β-CTX)、25-羟基维生素D[25-(OH)D](罗氏公司试剂盒)。BMD 检测应用美国GE 双能X 线骨密度仪由2 名专业人员共同进行测定,仪器软件系统根据骨密度自动进行T 值评分。被检测者取仰卧位,使用腰椎检查垫抬高下肢,选取第1~4 腰椎(L1~4)和股骨颈(FN)正位进行检测,分别获得BMDL1~4和BMDFN,并计算BMD全部T值。
1.5 统计学方法 采用SPSS22.0 统计学软件分析数据,正态分布的计量资料采用±s表示,采用两独立样本t检验;非正态分布的计量资料采用中位数及四分位数间距M(P25,P75)表示,采用两独立样本比较的秩和检验;计数资料采用百分数表示,组间比较采用χ2检验。相关性比较采用Pearson 法,线性依存关系采用多元线性回归分析。P<0.05 为差异有统计学意义。
2 结果
2.1 血糖波动正常及异常患者的临床特征 213例患者根据SDBG 分为血糖波动正常组93 例(A组),男68 例、女25 例,年龄(51.26 ± 10.21)岁,病程(8.40±6.51)年,BMI(24.45±2.31)kg/m2;血糖波动异常组(B 组)120 例,男81 例、女39 例,年龄(52.57 ± 11.97)岁,病程(9.86 ± 6.31)年,BMI(25.32±3.24)kg/m2;两组性别、年龄、病程、BMI比较差异无统计学意义(P均>0.05)。两组血液生化指标比较见表1,显示两组TC、TG、HDL-C、LDL-C、ALT、AST、白蛋白、钙、磷水平比较差异无统计学意义(P均>0.05),两组HbA1c 比较差异有统计学意义(P<0.05)。

表1 两组血液生化指标比较
2.2 两组血糖波动指标 B 组SDBG、LAGE、MAGE均明显高于A组(P均<0.05)。见表2。
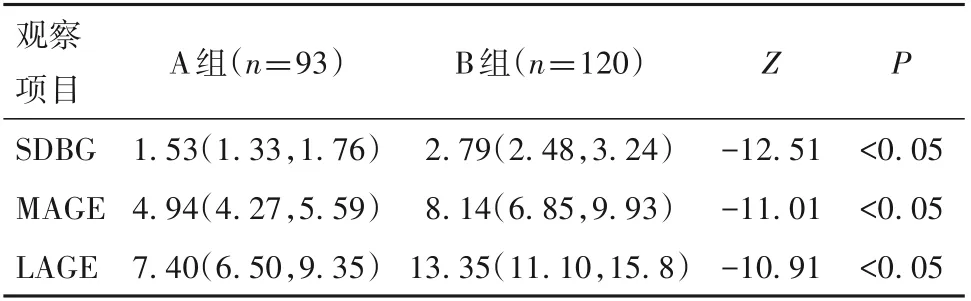
表2 两组血糖波动指标比较[mmol/L,M(P25,P75)]
2.3 两组骨代谢指标及BMD B 组β-CTX 高于A组,25-(OH)D、OC、BMDFN、BMD 全部T 值均低于A组(P均<0.05)。见表3。
2.4 血糖波动与骨代谢指标及BMD 的相关性及回归分析 以血糖波动指标SDBG 为因变量,以25-(OH)D、OC、T-P1NP 、β-CTX、BMDL1-4、BMDFN、BMD全部T 值、HbA1C为自变量,利用Pearson 双变量分析分别检验二者是否具有相关性,结果显示SDBG 与β-CTX、糖化血红蛋白呈正相关(r分别为0.625、0.624,P均<0.05),与0C 水平呈负相关(r=-0.287,P<0.05)。以SDBG 为因变量,以两组间存在差异的指标为自变量进行多重线性回归分析,结果显示β-CTX、OC 和HbA1C可被纳入影响SDBG 严重程度的回归方程,是SDBG 严重程度的相关因素,且在纳入分析的因素中影响较大。见表4。
3 讨论
糖尿病是以血糖水平升高为主要表现的慢性代谢性疾病,可造成多种慢性并发症;波动性高血糖和持续性高血糖作为慢性高血糖的两种状态,均可加重糖尿病并发症的发生和发展。研究显示,糖尿病患者间歇性暴露于高糖诱导比恒定暴露于高糖诱导更易发生代谢变化和细胞毒性,更能加剧慢性并发症的发生和发展。多项研究证实,血糖波动与糖尿病患者大血管、微血管及神经病变的发生发展密切相关[9-11]。目前,关于血糖波动与骨代谢及BMD 的研究较少。杜凌超等[4]通过制造波动性和持续性高血糖的SD 大鼠的模型发现,相对于持续性高血糖组,波动性高血糖促进骨质吸收、抑制骨生成的作用更强。另有研究者发现在T2DM 患者中血糖波动异常与正常者相比,骨代谢状态存在显著差异,波动越大骨吸收越明显[5]。T2DM 患者骨折风险增加,其可能机制为患者长期处于持续性高糖或血糖波动状态,造成了高糖毒性及胰岛B细胞损伤,氧化应激反应增强,体内炎性因子水平升高,引发机体钙磷代谢障碍,抑制体内骨转换,使骨吸收大于骨形成,造成骨代谢紊乱进一步加重骨质疏松症状。临床研究发现患者在出现病理性血糖波动后,如若不进行人为治疗性干预,患者血糖波动很难自行恢复平稳,无数个短期血糖波动异常就成为长期血糖波动异常。本文短期血糖波动水平与骨代谢指标的相关性研究中发现,两组患者临床一般生化指标无明显差异,处于同一基线水平,血糖波动异常组与正常组相比,骨代谢状态存在显著差异,表现为血糖波动大,25-(OH)D、OC、BMD 全部T值水平越低,β-CTX 水平较高,且骨代谢指标及BMD 与SDBG 存在相关性,即血糖波动越大,骨吸收越明显。进一步以波动指标SDBG为因变量,以骨代谢指标为自变量进行多重线性回归,结果显示β-CTX、OC、HbA1C与SDBG 存在线性依存关系。即血糖波动越大,HbA1C、β-CTX 越高,OC值越低,即骨吸收指标增高,骨形成指标下降。近年来MAGE 被认为是评估日内血糖波动的金标准,但本文选取了SDBG,主要考虑MAGE 仍存在一些缺陷与争议。MAGE 的计算以第1 个有效血糖波动上升支或下降支波动的方向为基准,数据少,误差大;并且MAGE 是一个平均值概念,无法反映各个血糖值在时间上的关系,计算过程也较为复杂,易出错。SDBG 主要描述血糖离散趋势,用来评价总体水平偏离平均血糖的程度,几乎是最经典的评价血糖波动的指标,应用范围广泛,无论是自我血糖监测、医院内床旁快速血糖监测,还是现在应用较多的CGMS 系统获得的血糖数据均可应用,计算简便。OC、25-(OH)D、TP1NP 是骨形成指标,β-CTX 是骨吸收指标,都是骨基质的组成部分或骨组织细胞在骨重建阶段分泌的酶,反应了骨重建的动态情况[12]。糖尿病患者循环中OC 和β-CTX 水平降低,提示存在低骨周转率状态13]。骨周转率的降低会导致BMD 的增加,从而导致骨质量的下降。骨转换标志物与BMD 测量有很好的拟合性,因此无论是高危人群还是骨质疏松患者,可通过血清快速检测骨转换标志物来评价治疗及治疗依从性的效果。

表3 两组患者骨代谢指标及BMD比较
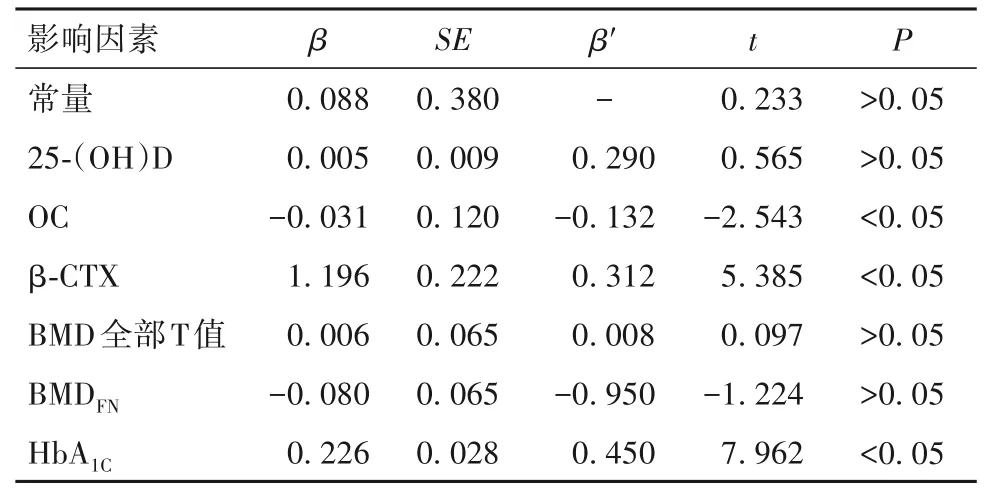
表4 SDBG影响因素的多元线性回归分析
本研究结果提示血糖波动与骨代谢及骨密度存在相关性,血糖波动越明显越不利于骨形成。在临床上为了提高患者生活质量,减少T2DM 合并骨质疏松症的发生及发展,应使患者保持血糖波动平稳。但是,本研究也存在一定的局限性,主要表现为:①回顾性研究且样本量较少;②未进行性别、年龄分类计算(围绝经期的女性骨代谢转换率较高,骨代谢加快,骨量减少[14]);③存在影响骨转换指标的因素如生物变异性:④多数骨转换存在昼夜节律,个体间存在差异。因此,进行大样本、前瞻性研究进一步探讨血糖波动与骨代谢、BMD 的相关性及机制十分必要。
