Graves眼病患者外周血中IL-17、IL-22的表达及其临床意义
2021-05-08齐冉冉柴昌
齐冉冉,柴昌
(河南大学人民医院,河南省人民医院,河南 郑州 450003)
0 引言
Graves眼病也称为甲状腺相关性眼病(thyroid-associated ophthalmopathy,TAO),表现为眼眶发炎以及脂肪和眼外肌的扩张。GO的病理生理学仍不确定,但是淋巴细胞和其他单核细胞浸润眼眶,这可能是细胞因子产生和对成纤维细胞作用的结果。近年来GO的发病机制一直是受国内外关注的,GO是一种器官特异性自身免疫性疾病,受多种因素影响,包括遗传、环境和吸烟等[1]。T细胞介导的免疫促进GO的发生已被广泛接受,目前发现的CD4+T细胞亚型一共有四种,分别是辅助性T细胞(Th1)、Th2、Th17和调节性T细胞(Treg)[2]。这些细胞分泌的细胞因子与GO的发病有关,Th1/Th17淋巴细胞介导了强烈的淋巴细胞浸润,导致腺体破坏[3-4]。B细胞也参与抗原呈递和自身抗体产生,细胞轨道成纤维细胞还具有产生细胞因子并对其产生反应的能力,因此也参与免疫反应[5,6]。CD4+T辅助淋巴细胞在炎症和自身免疫性疾病的发病机理中起关键作用,根据细胞因子合成的模式,CD4+T辅助细胞最初被分类为Th1和Th2淋巴细胞,它们参与细胞和体液免疫[7]。研究发现Treg和Th17的在自身免疫过程中发挥重要作用,这些细胞分泌多种具有促炎功能的细胞因子,包括 IL-17,IL-21 和 IL-22。近几年研究发现Treg和Th17的平衡关系也参与了GO的发病[8],在此项研究中,我们将通过分析GO患者和对照组的血清中IL-17与IL-22浓度水平,分析IL-17和IL-22细胞因子的分泌是否与GO处于活动期或非活动期有关,以及这些细胞因子是否与甲状腺状态和GO临床活性有关。为GO免疫治疗的提供新思路、新方法。
1 资料与方法
1.1 研究对象
选取2020年8月至2020月12月在我院就诊的Graves眼病病人52例,纳入标准:①符合GO的诊断标准[9];②未行糖皮质激素、手术等相关治疗。排除标准:①合并其他免疫性疾病;②排除其他情况引起的眼球突出;③经药物治疗的GO。按2016年EUGOGO提供的临床活动度评分(CAS)7分法[10],将其分成静止期组(CAS<3)和活跃期组(CAS≥ 3)。其中活跃期组共25例,其中男12例,女13例,平均年龄(47.72±7.992)岁;静止期组共27例,其中男11例,女16例,平均年龄(46.32±7.157)岁;另选同时间段在我院体检正常者20例作为对照组,其中男10例,女10例,平均年龄(45.50±7.338)岁。三组研究对象年龄、性别等无统计学差异(P>0.05),均排除心、肝、肾等疾病,本研究由河南省立眼科医院伦理委员会批准,在静脉采血前均征求受试者本人知情同意。
1.2 研究方法
收集研究对象的性别、年龄、CAS、糖皮质激素及免疫抑制剂使用情况等临床资料。所有研究对象于清晨空腹采集静脉血3mL,室温下静置2h,3000r/min离心5min后取上清,储存于-80℃冰箱中待检,避免反复冻融。采用双抗体夹心酶联免疫吸附法(ELISA)检测各组血清中IL-17与IL-22的含量,使用的试剂盒由武汉伊莱瑞特公司提供,所有操作步骤均严格按产品说明书进行。酶标仪在450nm波长下检测各孔光密度值,绘制出标准曲线,计算出IL-17与IL-22的含量。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料正态分布以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用方差分析;计数资料采用χ2检验,相关性分析用Spearman等级相关分析法,绘制受试者工作特征曲线(ROC),P<0.05为差异有统计学意义。
2 结果
2.1 3组临床资料分析
结果显示,各组之间的性别、年龄差异无统计学意义(P>0.05)。活跃期组的CAS明显高于静止期组(P<0.05)。见表1。
表1 各组基线资料(±s)
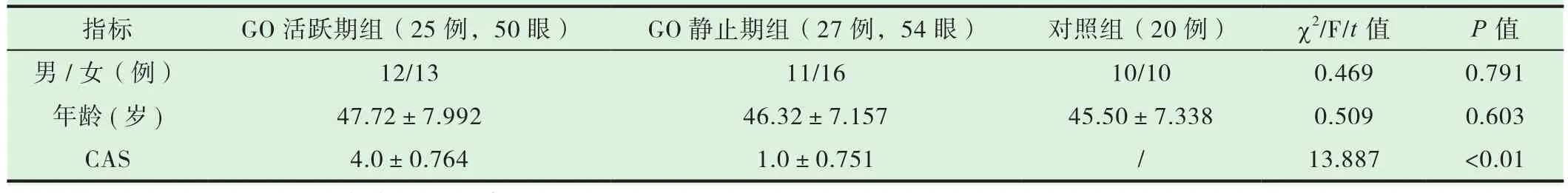
表1 各组基线资料(±s)
指标 GO活跃期组(25例,50眼) GO静止期组(27例,54眼) 对照组(20例) χ2/F/t值 P值男/女(例) 12/13 11/16 10/10 0.469 0.791年龄(岁) 47.72±7.992 46.32±7.157 45.50±7.338 0.509 0.603 CAS 4.0±0.764 1.0±0.751 / 13.887 <0.01
2.2 3组IL-17与IL-22的浓度值比较
3组对象外周血血清中IL-17、IL-22的表达含量比较,差异有统计学意义(P<0.05)。GO活跃期组和静止期组的IL-17、IL-22水平均高于对照组,且GO活跃期的值均高于GO 静止期(P<0.05)。见表2。
表2 各组IL-17、IL-22的含量 (pg/mL,±s)

表2 各组IL-17、IL-22的含量 (pg/mL,±s)
组别 IL-17 IL-22 GO活跃期组(25例) 104.05±19.128 68.58±14.603 GO静止期组(27例) 66.54±16.717 39.35±10.156对照组(20例) 38.59±9.634 16.58±5.336 F值 94.653 122.805 P 值 <0.01 <0.01
2.3 相关性分析
对IL-17、IL-22与CAS行Spearman等级相关法检测指标间的相关性,结果显示患者血清中的IL-17、IL-22水平与临床活动性评分均呈正相关,相关系数分别为0.732和0.647,有显著统计学差异(P<0.05)。
2.4 IL-17、IL-22作为预测GO患者处于活跃期指标的ROC曲线分析
以静止期为对照组,活跃期为实验组,绘制IL-17、IL-22评估病情的ROC曲线,判断其能否成为评估疾病活动性的有效指标。结果显示,IL-17作为预测GO为活跃期指标的 AUG 为 0.878(95%CI:0.782-0.973,P<0.001),灵 敏 度为76.0%,特异度为88.0%,最佳诊断截点为79.06 pg/mL。IL-22作为预测TAO活跃期指标的AUC为0.818(95%CI:0.697~0.940,P<0.001),灵敏度为 68.0%,特异度为 85.0%,最佳诊断截点为51.72 pg/mL。见图1。
3 讨论
Graves眼病是与细胞因子水平异常分泌有关的自身免疫性疾病,免疫机制学说是其重要的发病机制之一,近年来T淋巴细胞免疫反应在GO发病中的作用越来越引起关注[11],T淋巴细胞的免疫效应主要是CD4+T细胞,其中Th17细胞是CD4+T的一个重要子群,特征性的产生IL-6、IL-15、IL-17、IL-21、IL-22、IL-23等。其中IL-17是Th17细胞主要产生的关键性细胞因子,研究发现IL-17细胞因子家族由6种蛋白质(IL-17A至IL17F)和5种受体(IL-17RA至IL-17RE)组成,IL-17A和IL-17F由几种类型的免疫细胞产生,而IL-17B,IL17C和IL-17D主要由上皮细胞产生,IL-17受体广泛分布在不同组织的常见细胞类型中[12]。尽管对IL-17B-F的认知有限,但IL-17A(通常称为IL-17)因其在自身免疫性疾病中的促炎作用而受到了广泛关注。然而,在过去的十年中,已经清楚的是,IL-17的功能比仅仅启动炎症要细微得多。越来越多的证据表明,IL-17在损伤,生理应激和感染的反应过程中,在维持健康方面具有重要的背景和组织依赖性作用[13]。
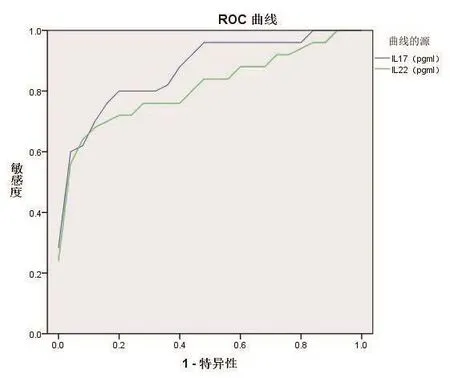
图1 疾病活动性分期的受试者工作特征曲线
Th17细胞与包括Graves病在内的许多人类自身免疫性疾病相关,例如牛皮癣,类风湿性关节炎,克罗恩病和多发性硬化症等[14]。已有研究发现在Graves眼病的发病机理中起关键作用。Fang等[15]发现产生IL-17,IFN-γ和IL-22的Th17细胞与GO的CAS具有相关性和趋势。当患者从疾病的活跃炎症阶段发展到“倦怠”阶段时,Th17细胞的致病性表现出GO的明显减弱趋势。这些结果表明,Th17细胞的状态与GO的临床过程相关。Chen[16]通过检测GO患者的眼泪和眼眶组织中IL-15和IL-17的表达水平发现,这两种细胞因子的浓度与正常人相比是显著升高的,并且活动期的浓度是高于非活动期的。再一次证实了它们与GO眼眶炎症的密切关系。唐喜香等[17]研究结果显示GO患者血清IL-6、IL-17水平升高,IL-2水平降低,其中IL-17与病情活动度关系密切。
本研究结果进一步显示,GO患者血清IL-17、IL-22水平均高于正常人,且与临床活动性评分呈正相关,因此认为在GO患者血清中IL-17、IL-22水平可以作为病情活动性分期的重要指标之一。这与其他三位学者的研究结果也是相符合的。近年来,基于对Graves眼病发病机制的研究,靶向治疗为GO的治疗带来了新的希望,但是多数新药还处于临床实验阶段,依然缺乏GO的特效治疗药,我们仍面临着巨大挑战[18]。总之,我们目前发现的相关细胞因子介导的炎症反应,为GO相关性自身免疫的潜在分子机制提供了新的思路,在以后的研究中将会更深入的探究CD4+T其他重要的细胞亚群及其相关细胞因子,为以后疾病的诊断及治疗提供新方法。
