注射用脑蛋白水解物(Ⅱ)促进神经细胞轴突再生及其相关机制
2021-05-08魏大厦张盛滨王存芳
魏大厦,管 昕,张盛滨,余 芳,王存芳,周 余,庞 涛*
(1中国药科大学药物科学研究院新药筛选中心,南京210009;2广东隆赋药业股份有限公司,中山528451)
神经元和神经元之间的轴突连接对于维持神经系统的功能十分重要,在中枢神经系统中,多发性硬化[1]、脑卒中[2]、肌萎缩性侧索硬化症[3]和帕金森病[4]等多种神经系统疾病的病理进程中均出现神经元轴突损伤,破坏神经元的功能。神经营养因子的缺乏、胶质疤痕的形成以及微环境中具有抑制作用的分子都会导致轴突再生障碍[5],但当药物可以促进轴突再生时即可恢复神经元功能,改善损伤后的中枢神经元[6]。因此,寻找促进轴突再生的药物可以成为治疗损伤神经元的新策略。
注射用脑蛋白水解物(Ⅱ)[cerebroprotein hydrolysate for injection(Ⅱ),CBL]是猪脑蛋白经酶水解而产生的富含多种氨基酸和小分子生物活性多肽的混合物,作用于神经系统,促进神经元的存活,具有神经营养和神经保护的作用[7]。Plosker等[8]研究发现,对SD大鼠静脉注射125I标记的脑蛋白水解物0.79 mg,35 min后,检测到每克脑组织中脑蛋白水解物的平均含量为170~237 ng。据文献报道[9-10],已在临床上使用CBL治疗缺血性脑血管病,可显著改善神经功能,促进神经元的分化,保护神经元免受缺血和神经毒素的影响。但是,尚不清楚CBL改善神经功能的作用是否与轴突再生有关,缺乏对CBL的作用机制的探究。
本文研究了CBL对神经细胞轴突再生的作用,阐述了CBL的作用机制,发现CBL可能是通过激活TrkB信号通路发挥作用,研究结果为进一步提高CBL药物临床应用提供理论指导。
1材料
1.1 药品与试剂
注射用脑蛋白水解物(Ⅱ)(CBL,国药准字H20051230,规格:30.5 mg,无菌冻干粉,内含约16种游离氨基酸和不同长度的多肽,以及适宜辅料,广东隆赋药业股份有限公司);MEM培养基、DMEM/F12培养基、青链霉素(美国Gibco公司);Neurobasal培养基、B27添加剂、胰酶、Hoechst 33342(美国Invitrogen公司);DNA酶、多聚赖氨酸(美国Sigma公司);胎牛血清(美国Clark公司);Hank's平衡盐缓冲溶液(美国赛默飞世尔公司);RIPA细胞裂解液(上海碧云天生物技术有限公司);BCA蛋白浓度测定试剂盒(美国Thermo公司);牛血清白蛋白(BSA,南京生兴生物科技有限公司);上样缓冲液(美国Bio-Rad公司);Alexa Fluor 633羊抗鼠IgG(H+L)抗体、p-TrkB(Tyr706)抗体(美国Affinity Biosciences公司);β-actin抗体(武汉爱博泰克公司);TUBB3抗体、TrkB抗体(美国Protein⁃tech公司);山羊血清(北京索莱宝公司);Triton-100(上海生工生物工程有限公司);其他试剂均为市售分析纯。
1.2仪器
FV3000型激光共聚焦显微镜(日本Olympus公司);Operetta Phenix高内涵荧光成像系统(美国PerkinElmer公司);BT25S电子分析天平(德国Sar⁃torius公司);BB15型CO2细胞培养箱(美国Thermo公司);垂直凝胶电泳仪、Gel DOCXR凝胶成像仪(美国Bio-Rad公司);冷冻离心机(美国Thermo公司)。
1.3 细胞株和动物
Neuro-2a细胞购于中国科学院上海生命科学研究院细胞库。怀孕两周的SPF级C57BL/6孕鼠,体重(30±2)g,购于上海斯莱克实验动物有限公司(合格证号:SYXK(苏)2016-0011)。所有动物实验均符合动物伦理委员会标准。
2方法
2.1 化合物的配制
如先前报道所述[11-12],CBL的蛋白质含量根据凯氏定氮法(GB 50010.3—2011)测定。从-20℃冰箱中取出CBL粉末30 mg,加入无菌生理盐水6 mL,然后配成5 mg/mL的CBL生理盐水溶液,放在-20℃冰箱保存。
2.2 小鼠原代皮层神经细胞的培养
根据文献报道[13],将怀孕14 d的C57BL/6孕鼠用异氟烷麻醉,75%乙醇溶液喷洒于表皮,在超净台内取出胎鼠立即放入预冷的Hank's平衡盐缓冲溶液中,在显微镜下分离出大脑皮质,除去血管和脑膜,加入等体积的0.25%胰酶室温消化30 min,加入含10%FBS的DMEM/F12培养基终止消化,离心,弃上清液,加入含10%FBS的DMEM/F12重悬均匀,70µm孔径的细胞筛网过滤,制备单细胞悬液,以每孔4×105个细胞接种到多聚赖氨酸包被的24孔细胞培养板中,于37℃、5%CO2的细胞孵箱中培养。4 h后弃去培养基,换用含2%B27添加剂的Neurobasal培养基培养,每隔3天对小鼠原代神经细胞进行半量换液。
2.3 Neuro-2a细胞的培养
将Neuro-2a细胞用含10%FBS的MEM培养基于37℃、5%CO2的细胞孵箱中培养,每隔24小时换液。当细胞达到80%~90%融合度后用0.25%胰酶消化,制成单细胞悬液备用。
2.4 蛋白免疫印迹分析
对细胞进行相应的处理后,弃掉细胞培养基,用预冷的PBS溶液洗涤3次,加入含蛋白酶及磷酸酶抑制剂的RIPA裂解液,转移至新的1.5 mL离心管,用BCA蛋白试剂盒检测蛋白浓度,加入适量的上样缓冲液后,在95℃的金属浴中加热10 min,使蛋白变性。每个泳道加入同等质量的蛋白进行SDS-PAGE电泳。电泳结束后转至PVDF膜,随后用5%BSA溶液封闭60 min;加入5%BSA溶液稀释的一抗溶液(p-TrkB、TrkB、β-actin),4℃孵育过夜。用TBST缓冲液洗涤5次后用HRP偶联的山羊抗兔二抗(1∶10 000)室温孵育1 h。随后用ECL化学发光液孵育2 min,使用凝胶成像系统分析。用Image J软件分析图像灰度,以目的蛋白和其内参蛋白β-actin的光密度值做比值,作为目的蛋白的相对表达量,实验重复3次。
2.5 细胞免疫荧光实验
将Neuro-2a细胞、小鼠原代神经细胞接种于共聚焦小皿中,在37℃、5%CO2的细胞孵箱培养24 h,加入不同质量浓度(1µg/mL、5µg/mL)的CBL生理盐水溶液,对照孔加入相应体积的生理盐水,分别于24 h、48 h及72 h弃去小皿中的培养液,用预冷的PBS溶液洗涤3次;加入4%多聚甲醛固定30 min,用PBS洗涤3次;加入5%山羊血清溶液,室温孵育1 h;弃掉5%山羊血清溶液后,加入5%山羊血清稀释后的TUBB3一抗,4℃孵育12 h;用PBS溶液洗涤3次,然后用5%山羊血清稀释后的羊抗鼠IgG二抗溶液,室温避光孵育1 h;最后加入Hoechst 33342染液,采用激光扫描共聚焦显微观察并拍照保存,采用Image J软件对图像进行分析。
2.6 统计分析
实验数据均采用GraphPad Prism 7.0进行统计学分析,数据均采用xˉ±s表示。单因素多组别之间用One-Way ANOVA加Bonferroni检验进行分析差异,多因素多组别之间用Two-Way ANOVA加Bonferroni检验进行分析差异。当组间差异P<0.05,即认为组间差异具有统计学意义。
3结 果
3.1 CBL对低血清诱导Neuro-2a细胞轴突再生模型的作用
将Neuro-2a细胞接种在培养皿中,根据文献报道[14],用含有0.1%FBS的MEM培养基诱导其轴突再生;然后将1µg/mL和5µg/mL的CBL分别作用于Neuro-2a细胞24、48及72 h,对其进行免疫荧光实验。结果如图1所示,与溶剂对照组相比,1µg/mL和5µg/mL的CBL处理后的Neuro-2a细胞中,轴突长度以及有轴突细胞的数目显著增加,且CBL质量浓度为5µg/mL,作用时间为72 h时,CBL促进Neuro-2a细胞轴突再生的作用最为明显。
3.2 CBL对小鼠原代皮层神经细胞轴突再生的作用
为了探索CBL对小鼠原代神经细胞轴突再生的作用,将不同浓度的CBL分别处理小鼠原代皮层神经细胞,通过免疫荧光染色检测小鼠原代皮层神经细胞中轴突长度及有轴突细胞的比例。结果如图2所示,与溶剂对照组相比,1µg/mL、5µg/mL的CBL作用于小鼠原代皮层神经细胞24 h、48 h及72 h后,小鼠原代皮层神经细胞的轴突长度以及有轴突细胞的数目显著增加(P<0.001),并且当CBL质量浓度为5µg/mL处理原代皮层神经元72 h时,CBL促进原代皮层神经元轴突再生作用最强。
3.3 CBL对Neuro-2a细胞TrkB磷酸化水平的作用
为了研究CBL对Neuro-2a细胞轴突再生的作用机制,给予Neuro-2a细胞5µg/mL的CBL分别处理15 min、30 min及1,3,6,9,12 h,通过Western blot检测CBL对Neuro-2a细胞TrkB磷酸化水平的影响。结果如图3所示,与对照组相比,CBL作用0.5、1及3 h后能显著上调Neuro-2a细胞的TrkB磷酸化水平。当CBL作用于Neuro-2a细胞1 h时,TrkB的磷酸化水平达到最高值,且与对照组有显著性差异(P<0.001)。
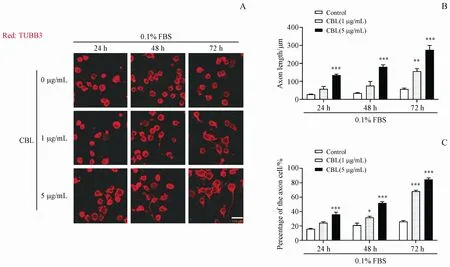
Figure 1 Effect of cerebroprotein hydrolysatefor injection(II)(CBL)on axon regeneration of Neuro-2a cells incubated with low serumA:Representative immunofluorescence staining for the TUBB3(red)in Neuro-2a cells treated with different concentrations of CBL for 24 h,48 h and 72 h after low serum culture,scale bar=100µm;B:Axon length of Neuro-2a cells was measured by Image J software;C:Percentage of the axon of cellswascounted by Image Jsoftware(xˉ±s,n=3)**P<0.01,***P<0.001 vs control group
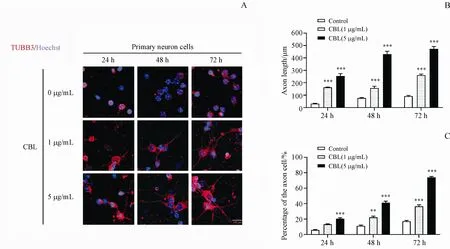
Figure2 Effect of CBLon axon regeneration of mouseprimary cortical neuronal cellsA:Representative immunofluorescence staining for the TUBB3(red)and Hoechst(blue)in mouse primary cortical neuronal cells treated with different concentrations of CBL for 24 h,48 h and 72 h,scale bar=100µm;B:Axon length of mouse primary cortical neuronal cells was measured by Image J software;C:Percentage of the axon of cells was counted by Image Jsoftware(xˉ±s,n=3)*P<0.05,**P<0.01,***P<0.001 vs control group
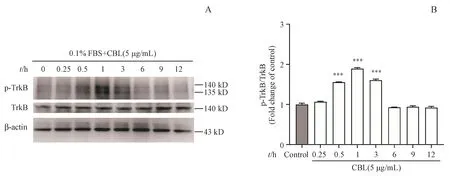
Figure3 Effect of CBL on the phosphorylation of TrkBat different time points in Neuro-2a cellsA:Neuro-2a cells were treated with CBL(5µg/mL)at the different timepoints,and theexpression of p-TrkBand total TrkBweredetected by Western blot;B:Quantitativemeasurement of theratio of p-TrkB/TrkBexpression by Image Jsoftware(xˉ±s,n=3)***P<0.001 vs control group
为了研究CBL质量浓度与Neuro-2a细胞p-TrkB表达水平是否存在相关性,用0.2、1、5µg/mL的CBL溶液处理Neuro-2a细胞1 h,通过Western blot检测不同质量浓度的CBL对Neuro-2a细胞内TrkB磷酸化水平的影响。结果如图4所示,与对照组相比,5µg/mL的CBL处理后的Neuro-2a细胞中TrkB磷酸化水平显著升高。
上述结果表明,当CBL质量浓度为5µg/mL、作用于Neuro-2a细胞1 h时,Neuro-2a细胞的TrkB磷酸化水平最高。
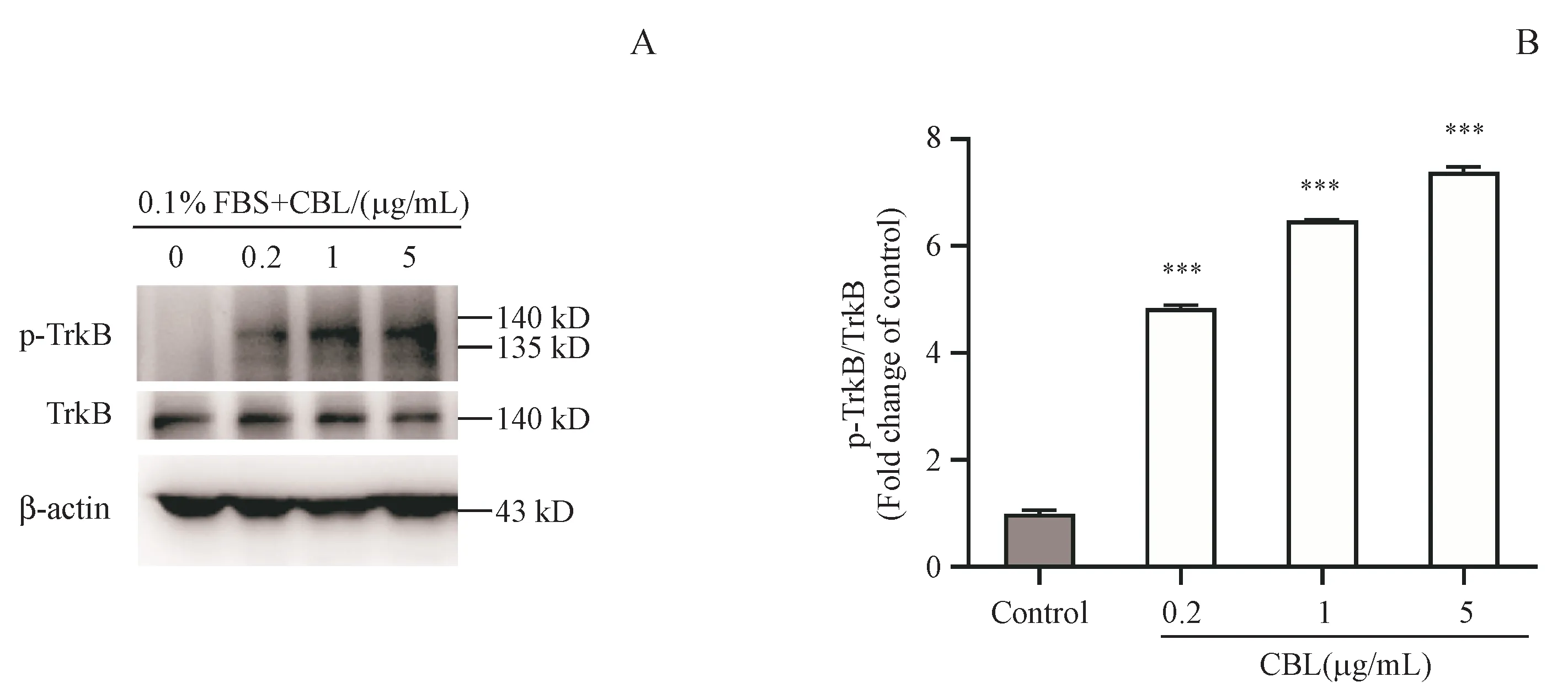
Figure4 Effect of CBL on the phosphorylation of TrkBin different concentrations in Neuro-2a cellsA:Neuro-2a cells were treated with different concentrations of CBL for 1 h,and the expression of p-TrkB and total TrkB were detected by Western blot;B:Quantitativemeasurement of theratio of p-TrkB/TrkBexpression by Image Jsoftware(xˉ±s,n=3)***P<0.001 vs control group
3.4 CBL对小鼠原代皮层神经细胞TrkB磷酸化水平的作用
为了确定CBL对小鼠原代皮层神经细胞是否也存在这样的机制,用5µg/mL的CBL处理小鼠原代皮层神经细胞15 min、30 min、1 h、3 h及6 h,通过Western blot检测小鼠原代皮层神经细胞中TrkB磷酸化水平的变化。结果如图5所示,与对照组相比,5µg/mL的CBL处理后,小鼠原代皮层神经细胞中TrkB的磷酸化水平显著升高。当CBL作用于小鼠原代皮层神经细胞1 h时,细胞内TrkB的磷酸化水平达到最高值,且与对照组有显著性差异(P<0.001)。
为了研究CBL质量浓度与小鼠原代皮层神经细胞TrkB磷酸化水平是否存在相关性,用不同浓度的CBL溶液处理小鼠原代皮层神经细胞1 h,用Western blot检测小鼠原代皮层神经细胞中TrkB的磷酸化水平。结果如图6所示,与对照组相比,0.2、1或5µg/mL的CBL溶液处理过的小鼠原代皮层神经细胞中TrkB磷酸化水平显著升高,并且当CBL质量浓度为5µg/mL时小鼠原代皮层神经细胞中TrkB磷酸化水平最高。
上述结果表明,当CBL质量浓度为5µg/mL,作用于小鼠原代皮层神经细胞1 h时,CBL能够显著上调细胞内TrkB的磷酸化水平,可能通过激活TrkB信号通路促进神经元轴突再生。
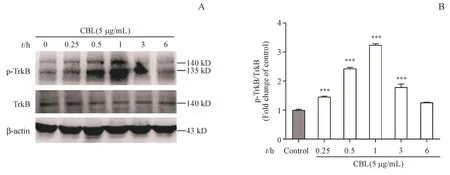
Figure 5 Effect of CBL on the phosphorylation of TrkBat different timepoints in mouseprimary cortical neuronal cellsA:Mouse primary cortical neuronal cells were treated with CBL(5µg/mL)at the different time points,and the expression of p-TrkB and total TrkB weredetected by Western blot;B:Quantitativemeasurement of theratioof p-TrkB/TrkBexpression by Image Jsoftware(xˉ±s,n=3)***P<0.001 vs control group
4讨论
中枢神经系统损伤后,通过轴突再生促进中枢神经系统的恢复,但由于自身再生能力差,以及微环境中的抑制因子,导致轴突再生失败,无法修复损伤的中枢神经系统。有研究表明,脑蛋白水解物可以促进突触的再生[15],但不清楚CBL促进神经细胞轴突再生的作用及其分子机制。在本研究中,证明了CBL可以促进神经细胞轴突再生,可以上调神经细胞TrkB的磷酸化水平;当CBL作用于神经细胞1 h时,TrkB的磷酸化水平达到峰值,并且随着CBL浓度的增加,TrkB的磷酸化水平也随之增加,当CBL质量浓度为5µg/mL时可以显著促进神经细胞轴突再生。因此,上调TrkB的磷酸化水平可能是CBL促进神经细胞轴突再生的重要分子机制,CBL可能通过激活TrkB信号通路促进神经细胞轴突再生。
原肌球蛋白相关激酶(tropomyosin related kinase,Trk)受体是酪氨酸激酶受体家族的一种,包括TrkA、TrkB和TrkC共3种亚型[16]。脑源性神经 营 养 因 子(brain-derived neurotrophic factor,BDNF)是小分子多肽,在神经元的发育、受损神经元的修复和轴突的再生中发挥至关重要的作用[17]。BDNF和受体TrkB结合后,会激活3个主要的信号传导途径:磷脂激3(PI3K)、磷脂酶Cγ(PLCγ)和细胞外信号调节激酶(ERK)[18]。除此之外,BDNF也可以调节cAMP反应元件结合蛋白(cAMP-response element binding protein,CREB),对神经细胞具有保护作用[19]。PI3K/AKT信号通路有助于稳定大脑内环境和保护神经元。中枢神经系统损伤后,通过PI3K/Akt信号通路逐级调节,促进3-磷脂酰肌醇依赖性的蛋白激酶-1(3-phos⁃phoinositide dependent protein kinase 1,PDK1)磷酸化,进一步激活雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和糖原合成激酶3(glycogen synthase kinase 3,GSK3),促进蛋白的合成和轴突再生[20]。在中枢神经系统中,ERK的激活通过影响轴突的运输、局部蛋白的合成和基因的表达来调节轴突的再生和神经元的存活。细胞培养和动物模型表明,ERK的信号传导主要参与体外轴突的生长和体内远距离神经再生[21]。BDNF和TrkB受体结合后,导致细胞内多种蛋白质(如PLCγ)磷酸化,进而激活Ras/MEK/MAPK途径,促进细胞的增殖和分化[22]。
轴突再生的机制尚不清晰,可能涉及到多个神经递质和细胞受体,但与TrkB的关系密切。Zheng等[23]发现补肾益穗配方可以通过调节BDNF-TrkB信号通路以及下游的PI3K/AKT信号通路促进轴突再生;使用小分子TrkB激动剂可以促进周围神经切断后的轴突再生[24]以及靶向TrkB可以促进髓鞘的再生,进一步促进轴突再生[25]。TrkB的激动抗体在体内体外模型中可以提高运动神经元的存活率,用于治疗运动神经元的变性[26],促进损伤后中枢神经系统的恢复,改善神经细胞的功能。Fan等[27]基于TrkB受体信号通路在轴突发芽、树突状乔木的增殖、突触可塑性和神经元分化中起关键作用,使用TrkB的激动剂可以挽救神经元的丢失,对海马神经元具有保护作用,可用于治疗早期阿尔兹海默病。因此,细胞表面的受体TrkB是促进轴突再生药物潜在的作用靶标[28]。此外,TrkB的完整性表达对于轴突再生至关重要,TrkB过表达可以促进神经细胞轴突再生[29]。在本研究中,实验结果证明了CBL可以使神经细胞内TrkB的磷酸化水平上调,促进神经细胞轴突再生。这些研究都表明TrkB与轴突再生密切相关,靶向TrkB可以促进轴突再生。除了以上的信号通路,是否存在其他的信号通路调控轴突再生,这些信号通路中是否存在联系,激活多个信号通路是否可以进一步提高神经细胞轴突再生的能力,这些问题都不是很清楚。所以,轴突再生的具体机制还没有被真正阐明,仍然存在一些局限。
CBL是复合物,成分较为复杂,含有多种氨基酸和小分子多肽。本研究只是证明了CBL可以促进神经细胞轴突再生,无法确定其真正的有效成分。有研究表明,CBL中的有效成分为小分子多肽,发挥着神经营养因子的作用。因此,需要进一步确定CBL中与TrkB结合的多肽,确定CBL中促进神经细胞轴突再生的有效成分,以明确CBL临床发挥药效的有效成分。
