分子伴侣蛋白介导的革兰阴性菌耐酸机制研究进展
2021-05-08朱浩,刘楠
朱 浩,刘 楠
(中国药科大学生命科学与技术学院,南京210009)
自然界中微生物生长或工业生产过程中会遇到各种外界环境压力,如高温[1]、强酸强碱[2]、高渗[3]及氧化[4]胁迫等。在长期进化过程,微生物已形成了一整套响应外界压力的应对机制,如细胞膜组分由短链饱和脂肪酸向长链饱和脂肪酸转化引起的信号通路变化[5],生理、生化和F1F0-ATP酶和分子外排泵相关的代谢过程[6],脱羧和脱氨基[7]等一系列酶促反应等。以大肠埃希菌为代表的革兰阴性菌在长期进化过程中利用这一系列生理、代谢过程及质子消耗等机制,抵御外界酸性环境对菌株生长的影响,主要机制包括由HdeA/B分子伴侣介导的周质空间耐酸机制、代谢相关的谷氨酸脱羧酶途径(acid resistance 3,AR2)和精氨酸脱氨酶途径(acid resistance 3,AR3)的耐酸机制以及与耐酸基因相关的二元调控系统等。
革兰阴性菌为双层膜结构,外层膜上具有非专一性通道蛋白,允许小分子物质进出,其中氢离子可在相关通道蛋白进入周质空间时,对菌体造成酸胁迫,导致周质空间重要代谢相关蛋白质错误折叠,影响其表达[8]。在革兰阴性菌的周质空间中存在与菌体耐酸机制密切相关的分子伴侣,其帮助保护新生蛋白质的折叠以及在酸性环境压力下失去活性的蛋白质重折叠,使其回复活性[9]。因此,系统研究革兰阴性菌周质空间中分子伴侣的结构、耐酸机制及调控方式就显得尤为重要。
1 周质空间及分子伴侣的结构及功能
1.1 革兰阴性菌周质空间的结构
周质空间(periplasmic space),又称周质(peri⁃plasm)或壁膜间隙,是革兰阴性菌细胞膜与外膜之间的间隔区域。周质空间蛋白主要分为4类:第一类为水解酶类,例如蛋白酶、核酸酶等;第二类为合成酶类,例如肽聚糖合成酶;第三类为结合蛋白,具有运输营养物质的作用;最后一类为底物蛋白,主要与细胞的趋化性有关[10]。当细胞面临外界酸性环境压力时,周质空间蛋白质较胞内蛋白受到酸性压力更大,所受酸性伤害也比胞内蛋白质更严重。在革兰阴性菌耐酸过程中,除了胞内多种脱羧酶系统外,分子伴侣可识别并保护蛋白质空间结构,使其维持活性状态,避免沉淀降解,是调控革兰阴性菌耐酸途径的重要分子之一。
1.2 革兰阴性菌的分子伴侣
多数蛋白质是边翻译边折叠过程,需要相关酶以及分子伴侣的参与。细胞中某些蛋白质分子可以识别正在合成的多肽链或部分折叠的多肽并将这些蛋白质转运至相应功能部位,从而帮助多肽转运、折叠和装配,这类分子本身并不参与最终产物的形成,被称为分子伴侣[11]。根据功能分子伴侣主要有热休克蛋白70(Hsp70)和热休克蛋白60(Hsp60)两大家族:Hsp70与部分折叠的蛋白质暴露在外的疏水区有效地结合,防止它们彼此之间聚合在一起[12];Hsp60则自身形成桶装结构,没有折叠的蛋白质可以在其中进行有效的折叠[13]。所有的分子伴侣都具有ATP酶活性从而通过水解ATP有利于克服蛋白质折叠过程中遇到的能障。在大肠埃希菌中,已知主要参与周质空间耐酸反应的分子伴侣为HdeA、HdeB,此外,在一些嗜酸菌如Picrophilusoshimae中,由GroEL、DnaK组成的分子伴侣耐酸体系,同样可在ATP的协助下发挥其保护周质空间蛋白质的功能[14]。
1.3 革兰阴性菌的分子伴侣结构
Hsp70是一类从古细菌、植物到人类几乎所有生物体中均有发现且进化最为保守的热休克蛋白质。Hsp70由45 kD N-末端核苷酸结合结构域(nucleotide binding domain,NBD)和25 kD的C-末端底物结合结构域(substrate binding domain,SBD)组成[15]。NBD具有结合和水解ATP的功能,由两个亚结构域(I和II)组成,两个亚结构域又被进一步分成4个子域(IA、IIA、IB、IIB)。在I和II两个亚结构域间有裂缝,核苷酸结合位点位于裂缝的底部[16]。不同外界环境的刺激可诱导Hsp70发挥帮助蛋白质正确折叠[17]、保护细胞免受外界环境刺激[18-19]和抗氧化作用[20]等生物学功能。Hsp60存在于所有的原核及真核生物的线粒体和叶绿体中,原核生物中Hsp60的类似物是大肠埃希菌中的伴侣蛋白GroEL,而在真核生物中的线粒体中以Hsp60形式存在,Hsp60在线粒体外区域中以单体或低聚体的形式存在,除扮演分子伴侣功能外,并具有协调细胞凋亡、参与炎症与免疫反应等功能,与神经系统疾病相关[21-22]。在革兰阴性菌中,与耐酸密切相关的热休克蛋白包括属于Hsp70的HdeA/B、DnaK和属于Hsp60的GroEL等。
研究表明,HdeA和HdeB是调节细菌细胞在酸性环境下生理活性重要的分子伴侣蛋白。HdeA和HdeB序列相似度较低,但它们的单体结构具有较高的相似性,核心结构均由4个α-螺旋包裹形成疏水区[23]。中性环境下形成同型二聚体,但HdeA与HdeB单体排列组成方式不同。HdeA两个α-螺旋平行相对,而HdeB呈垂直分布[24],但两种二聚体α-螺旋均包裹疏水表面,与周质空间蛋白结合的主要部位,当疏水区表面的氨基酸被取代时,其失去与底物蛋白结合能力[25]。此外,在面对酸性环境压力的刺激下,GroEL、DnaK也可防止蛋白聚集并修复受损蛋白[26]。
2 分子伴侣介导的耐酸机制
尽管蛋白质的空间结构与其氨基酸序列相关,但细胞在面对外界压力如高温、强离子浓度以及强酸碱度等极端环境时,胞内新生肽链经常不能正确折叠,倾向于形成非天然状态下的空间结构,这些异常空间结构会暴露出内部疏水区,发生蛋白质的聚集,影响细胞正常功能,甚至造成细胞死亡。因此,细菌细胞需要利用胞内相关“纠错”系统,应对外界环境压力的影响,而针对于酸性环境的压力的过程中,位于周质空间区域的蛋白质最易受到pH变化的影响,故其空间中分子伴侣这套“纠错”系统产生了重要的作用,不同的分子伴侣耐酸机制有异同(图1)。
2.1 HdeA/B分子伴侣
在大肠埃希菌及布氏杆菌Brucella abortus中敲除HdeA/B基因可明显降低其在酸性环境下存活率,回补HdeA或HdeB基因后,则可增加菌株存活率[27]。HdeA/B主要通过疏水力作用结合底物蛋白,在中性环境下,HdeA与HdeB形成无活性二聚体;当细胞处于强酸环境(pH<3),HdeA与HdeB可感知细胞外氢离子浓度变化,HdeA/B从无活性的二聚体解离为单体,暴露疏水区域与底物蛋白结合,保护底物蛋白免受酸性环境的的伤害[28]。此外,体外实验结果显示:HdeA与HdeB发挥保护蛋白活性的最适pH不同,在pH为2时,HdeA活性高于HdeB,二聚体分离较完全;pH为3时,则HdeB较高,完全解离为单体状态[29]。
在酸性环境下,周质空间蛋白DegP和SurA是HdeA的主要底物蛋白;在中性环境下,DegP和SurA可帮助受HdeA蛋白保护的底物蛋白重新折叠并恢复其活性,故称DegP和SurA为保护伴侣蛋白的伴侣蛋白(chaperone-protecting-chaperone),是革兰阴性菌重要的耐酸机制之一[28]。北京大学陈鹏课题组利用新一代可切割型光交联探针DiZSeK与荧光差异双向凝胶电泳(2D-DIGE)相结合,检测周质空间中与HdeA/B分子伴侣直接作用的底物蛋白,结果显示在酸性环境下,转运蛋白、代谢酶、膜蛋白、脂蛋白及蛋白酶等周质空间蛋白质与HdeA/B作用,完整地阐释了细菌抵御酸胁迫过程中pH对于分子伴侣的底物特异性调控机制,即pH通过系统性地调控HdeA/B及底物蛋白的折叠状态与功能,使分子伴侣蛋白在不同条件下逐步激活,协同分工保护底物蛋白,并在其释放后帮助重新折叠[30]。
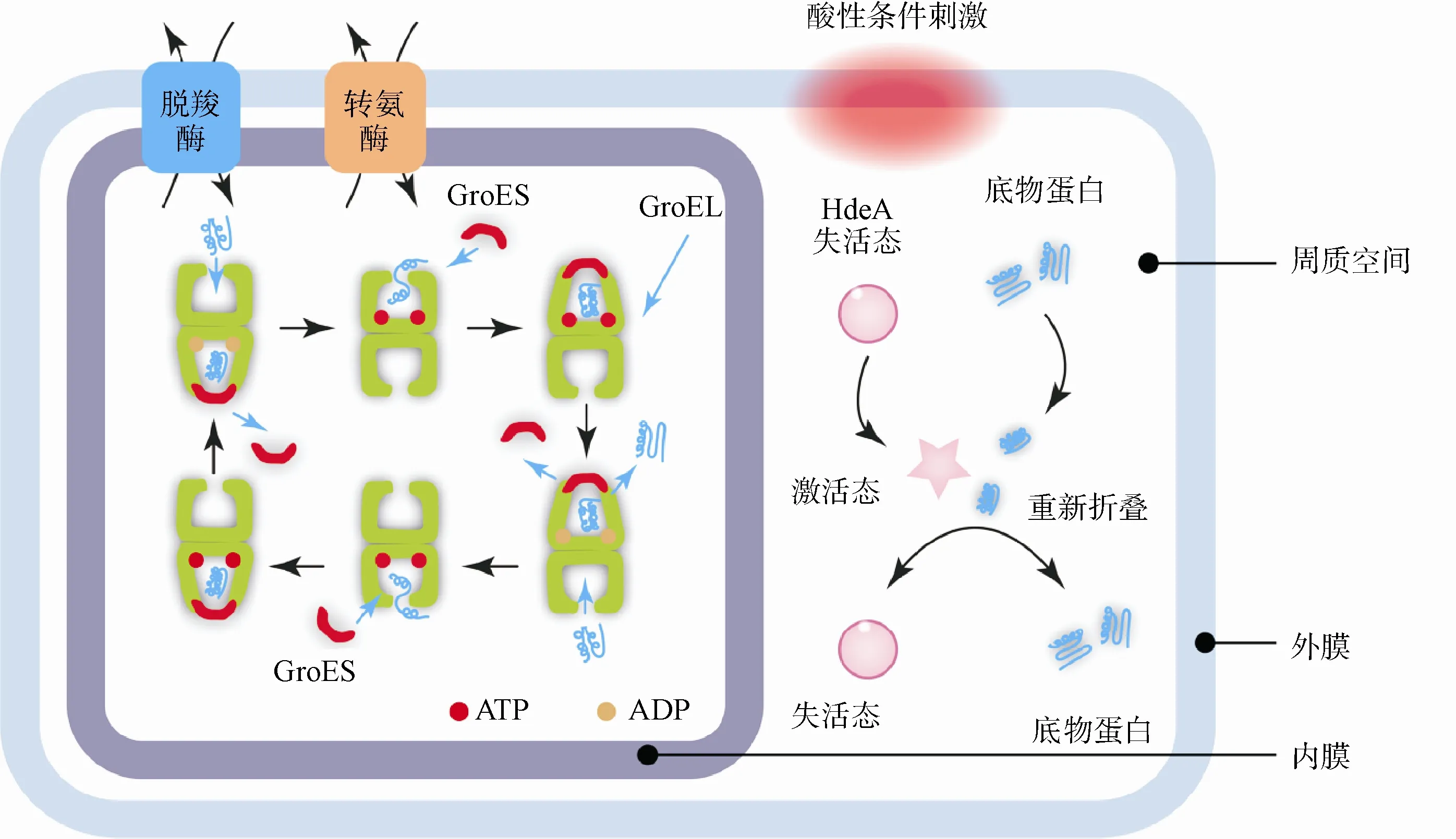
图1 分子伴侣耐酸机制
2.2 GroEL分子伴侣
GroEL是一种由14个亚基组成的同型寡聚复合体,呈双环圆桶状结构。3个主要功能域:含待折叠蛋白结合位点以及GroES结合位点的顶部结构域、中间结构域以及ATP结合位点的赤道结构域。GroES充当桶顶部的圆盖,可以和GroEL分开。待折叠肽链进入圆筒内部以后,顶盖合上,肽链在内部与桶壁发生多次可逆结合,每一次结合由ATP水解所驱动,在最终折叠成特定的三维结构之前可能会消耗大量的ATP[31-32]。一旦折叠完毕,便从GroES-GroEL复合物中释放出来。当外界环境遭遇酸胁迫时,由分子伴侣蛋白组成的抗逆体系,可帮助蛋白质正确折叠、组装、转运及降解,从而促进细胞自我修复,适应外界环境压力。研究发现pH的降低可引起At.thiooxidans中ZJJN-3核心的修复分子伴侣GrpE、DnaK、DnaJ转录水平上调,从而确保在酸胁迫下蛋白的正确折叠[33]。
研究显示,革兰阴性菌可通过不同热休克基因表达,使其在动态环境中耐受应激环境,尤其是酸性环境[34]。在协助底物蛋白去折叠过程中,GroEL进化出多种机制协助底物蛋白进行去折叠过程,Dahjya等[35]认为GroEL仅促进底物去折叠,但不改变去折叠速率。通过折叠中间体模型发现,底物RCAM-T1被牢牢地结合在GroEL上,使平衡向着去折叠方向进行。但一些蛋白的去折叠过程也可通过GroEL促进其去折叠速率,一旦GroEL参与其去折叠过程,去折叠速率明显增加[36]。
2.3 DnaK分子伴侣
DnaK是一种ATP依赖的分子伴侣蛋白,可参与酸性环境刺激下大肠埃希菌中蛋白质的保护过程。在细菌中DnaK属于热休克蛋白70家族,具有NBD以及SBD两结构域。ATP存在情况下,DnaK与ATP紧密结合形成单聚体,无ATP时DnaK以无序低聚物存在。DnaK是大肠埃希菌中重要的应激型分子伴侣,其转录和蛋白表达水平在酸胁迫的细菌细胞中均会提高。在外界酸性环境刺激下,它可与GroEL分子伴侣相互协作,帮助蛋白质正确折叠以及修复损伤蛋白[37]。Abdullah等[38]在乳酸菌NZ9000中异源表达大肠埃希菌DnaK基因,发现DnaK可以提高其对乳酸的耐受水平,异源表达菌株对于pH等环境压力较野生型菌株存活率提高4.6倍,GroEL等分子伴侣蛋白表达水平显著提高[39]。
3 分子伴侣介导耐酸机制的调控方式
微生物在适应外界酸性环境过程中,进化出多种应对机制来回应酸性环境信号。近年来提高微生物酸胁迫的耐受性成为人们研究热点,主要途径包括全局调控工程、过表达微生物耐酸相关热休克蛋白、人工诱变或基因组改组等以提高微生物对酸的耐受性[40]。
3.1 全局调控因子
全局转录调控工程(global transcription machinery engineering,gTME)是通过改造和进化全局转录因子、转录机器等关键蛋白,构建高度多样、复杂的转录调控突变文库,在转录水平上产生新型的丰富多样性,实现对基因表达网络和细胞代谢重程,并以定向进化方式加以迭代,从而使细胞获得所期望的表型。针对细胞酸胁迫的复杂性,可利用gTME从转录全局角度来调控周质空间伴侣分子的活性而抵耐酸胁迫[41]。H-NS是一种典型的全局调控因子,与转录抑制相关的DNA结合蛋白,在大肠埃希菌中主要调节与环境应答相关基因[42-43]。H-NS可自身结合形成二聚体,在大肠埃希菌中过表达H-NS基因后通过转录组学手段显示,H-NS可调控许多耐酸机制基因,导致细菌耐酸能力变化,如HdeA、HdeB、HdeD,这表明H-NS是大肠埃希菌耐酸过程重要的调控因子[44]。Gao等[45]通过易错PCR等技术,在大肠埃希菌MG1655菌中构建H-NS突变体文库,获得在酸性环境下菌株生长能力显著提高的耐酸菌株,突变型菌株较野生型菌株在酸性环境下生长密度提高24%。进一步通过转录组学分析显示,H-NS突变体可显著激活AR2途径以及HdeA和HdeB,从而达到提高大肠埃希菌耐酸能力的目的。
3.2 ABC转运体
ABC转运体(ATP-binding cassette transporter)是所有转运体家族中最大的一类转运体,广泛分布于从原核生物到人类几乎所有的物种中[46]。大部分ABC家族转运体都是跨膜蛋白,通过偶联ATP水解释放的能量来转移底物。ABC转运体结构由2个跨膜结构域(transmembrane domain,TM)和2个NBD组成。乳酸乳球菌在工业发酵过程中会大量积累乳酸及其他酸性代谢产物,影响细胞生长及代谢活动,降低发酵产量[47]。Zhu等[48]在乳酸乳球菌L.lactis NZ9000中过表达ABC转运体的4种基因RbsA、RbsB、MsmK及DppA,结果显示4组重组菌株酸性环境下生长2 h后较野生型菌株存活率分别提高7.0、10.3、163.3、2.0倍,转录组学数据显示4种重组菌株中耐酸基因的表达较野生型菌株同样显著性提高。4种ABC转运体蛋白的过表达可显著提高乳酸乳球菌的耐酸性。可见改善细菌酸性环境下耐受程度,有助于高质量发酵产物的生产。
3.3 其他压力反应调控蛋白
在革兰阴性菌中还存在调控其他压力反应的基因,通过调节这些基因的活性也可以改变菌体对酸的耐受。RpoS是一般酸胁迫反应的主要调控因子,可调控特异性耐酸基因的表达,感知氧化应激、高温、高压以及酸性环境压力[49],酸胁迫过程中,可促进革兰阴性菌如Shigella flexneri细胞膜组成改变,降低细胞膜流动性,抑制H+的入侵,提高细胞生存能力;GadEWX[50]、RcsB基因[51]会影响AR2途径中GadA和GadX的表达,在大肠埃希菌Escherichia coli K-12 MG1655中敲除GadEWX基因,通过转录组及生长状况显示,GadEWX基因的表达与GadA的表达呈正相关,GadEWX的敲除可降低菌株酸性环境下存活率;在肺炎链球菌Klebsi ella pneumoniae CG43S3中敲除RcsB可显著降低酸胁迫下菌株存活率并影响GadA基因的表达;此外RcsB与KvhA基因均可调控HdeB、HdeD和YfdX从而影响细菌细胞内的耐酸能力;大肠埃希菌Escherichia coli K-12中EvgA会通过调控YdeO蛋白活化HdeA及HdeB,提高其耐酸能力[52];在痢疾杆菌Shigella Flexneri中EvgS/EvgA双分子信号传递系统是一种致病性相关调控基因,参与抗生素抗性基因与耐酸基因的调控,Fur基因可间接调控EvgA,从而影响下游耐酸基因的作用[53]。
中科院天津工业生物技术研究所刘君课题组通过适应性进化策略结合转录组测序,在谷氨酸棒杆菌C.glutamicum ATCC 13032中,通过连续70 d的酸性环境刺激进化,筛选得到耐酸菌株。通过比较分析进化菌株与野生型菌株细胞结构、生长曲线、活性氧水平以及转录组表达水平,结果显示适应性进化策略可使得菌株更好保持酸胁迫环境下胞内完整性,维持了更高的胞内pH及较低的活⁃,性氧水平(较野生型降低61%),酸胁迫下较野生型菌株存活率提高39%,此外,研究中还发现和鉴定出多个候选抗酸元件,如铜伴侣蛋白Cg1328、细胞分裂蛋白FtsE/X、脂肪酸合成酶Fas、分子伴侣HscA等。进一步研究揭示,过氧化氢酶-饥饿诱导DNA保护蛋白(KatA-Dps)介导的胞内活性氧清除过程和硫代谢调控因子(McbR)介导的硫元素同化抑制效应能够协同参与谷氨酸棒杆菌的低酸胁迫耐受应答,是影响谷氨酸棒杆菌抗酸生理性能的重要因素,有助于更好理解菌株酸胁迫下生理适应策略,为耐酸菌株的开发提供了一种全新的思路[54]。
4 展望
细菌细胞在各种环境压力下,通过长期进化,形成多种应对机制来应对各种压力环境。其中酸性环境下细菌细胞的耐酸机制是令人关注的研究方向之一。目前已知多种氨基酸脱羧酶系统(AR2-AR5)、细胞间质空间分子伴侣的作用(HdeA、HdeB),此外还有多种关键基因的表达可影响细菌细胞内耐酸机制(H-NS、ABCtransporter、RcsF、RcsC等),这些机制的发现对于无论是工业化发酵过程,还是临床抗菌治疗靶点的发现均具有重要作用,也对蛋白质间相互作用的检测提供了理论基础。因此,深入探究和解析分子伴侣对低酸胁迫环境的生理适应策略,以期利用这些知识对目的菌株进行生理性能改造,提高菌株在酸性胁迫环境下的存活能力和耐受性,从而充分发挥其应用价值,具有重要理论和现实指导意义。
