马赛替尼通过抑制自噬和细胞凋亡减轻脑缺血/再灌注损伤
2021-05-08平锋锋周丹丽陈艳华凌菁菁
王 燕,平锋锋,周丹丽,陈艳华,凌菁菁*
(1南京医科大学附属无锡市儿童医院药学部,无锡214023;2南京医科大学附属无锡市人民医院生殖医学科,无锡214023)
脑卒中是一种常见的神经系统疾病,因其具有高发病率、高致残率和高致死率的特点,对人类健康带来极大威胁。缺血性脑卒中是脑卒中的主要类型,占脑卒中患者总数的60%~70%。一项世界卫生组织调查报道,我国脑卒中的发病率居于世界首位,且随着人口老龄化,发病率还在逐年上升[1-2]。因此,研究缺血性脑卒中的发病机制和损伤后的修复机制,寻找能有效改善神经功能,发挥脑保护作用的药物一直是众多神经病学科研工作者为之努力的方向。马赛替尼(masitinib)是一种口服的C-kit抑制剂,C-kit属于Ⅲ型蛋白酪氨酸激酶受体超家族成员,其配体为SCF[3-4]。近年来研究发现,SCF在脑缺血/再灌注(I/R)损伤后,发挥重要的神经保护作用[5-6]。但C-kit是否参与缺血性脑卒中的发病机制尚未见报道。因此,本实验通过线栓法建立大鼠大脑中动脉闭塞(MCAO)模型,灌胃给予不同剂量的马赛替尼,评估马赛替尼治疗缺血性脑卒中的潜力,并对其作用机制进行初步探讨,以期为临床脑卒中的治疗提供有力的实验依据和新的研究思路。
1材料
1.1 药品与试剂
马赛替尼(法国ABScience公司);2,3,5-氯化三苯基四氮唑(TTC,中国医药上海化学试剂公司);TUNEL细胞凋亡检测试剂盒(上海碧云天生物科技有限公司);全蛋白抽提试剂盒、BCA蛋白含量检测试剂盒(江苏凯基生物技术股份有限公司);cDNA第一链合成试剂盒、One Step TB Green™PrimeScript™RT-PCR Kit II(SYBR Green,日本TaKaRa公司)。LC3抗体(美国Santa Cruz公司),Beclin-1、IkB-α、P62、p65、Bcl-2、Bcl-xl、Bax、Bad、caspase 8抗体(美国Abcam公司),Bid抗体(美国Proteintech公司),p-IkB-α、cleaved-caspase 3、GAP⁃DH抗体(美国CST公司),羊抗兔IgG-HRP(江苏凯基生物技术股份有限公司),其他试剂均为市售分析纯。
1.2仪器
Sartorius BT 125D电子天平(北京赛多利斯仪器系统有限公司);5804R型台式冷冻高速离心机(德国Eppendorf公司);Trans-Blot Turbo全能型蛋白转印系统(美国Bio-Rad公司);凝胶成像系统(英国Syngene公司);荧光定量PCR循环仪(美国应用生物系统公司);2838MCAO栓线(北京沙东生物技术有限公司)。
1.3动物
健康雄性Sprague-Dawley大鼠,体重260~280 g,由上海斯莱克实验动物有限责任公司提供(合格证编号:SYXK(苏)2017-0015)。所有动物实验均符合动物伦理委员会标准。
2方法
2.1 动物分组和受试药的配制
大鼠适应环境7 d后,随机分成伪手术(Sham)组、I/R模型组、马赛替尼低剂量组(18.9 mg/kg)、马赛替尼中剂量组(37.8 mg/kg)、马赛替尼高剂量组(75.6 mg/kg)、依达拉奉(3 mg/kg)组,每组12只。
马赛替尼的具体配制方法如下:称取马赛替尼7.56 g溶于生理盐水10 mL中,配制成756 mg/mL的母液。临用前取母液0.5 mL至生理盐水50 mL中,稀释得到7.56 mg/mL的高剂量组母液,则高剂量组的给药体积V(mL)=(75.6 mg/kg×大鼠体重(kg))/7.56 mg/mL,以此类推,配制好中剂量组和低剂量组的受试药。大鼠缺血2 h后再灌注时即刻给药,每天两次,连续给药7 d。Sham组和I/R组大鼠灌胃给予等容积生理盐水。实验流程如图1-A所示。
2.2 MCAO模型的建立
参照Longa法[7]建立大鼠MCAO模型,术前12 h禁食不禁水。大鼠异氟烷麻醉,仰卧位固定于手术台上,颈部备皮,碘伏消毒。取颈部正中切口,小心分离皮下脂肪和肌肉,右侧颈总动脉(com⁃mon carotid artery,CCA)、颈外动脉(external carotidartery,ECA)和颈内动脉(internal carotid artery,ICA)。用微小动脉夹临时夹闭CCA和ICA,并在CCA远心端备线勿扎紧。分离ECA主干,钝性分离出甲状腺动脉和枕动脉,并电灼切断;剪断后将ECA下拉与ICA成一条直线。在距CCA分叉远端约2 mm处用眼科剪作细小斜向切口,将肝素浸泡过的线栓(直径0.26 mm)插入,扎紧缝合线,松开ICA动脉夹,慢慢推动线栓进入ICA,使其从ICA入颅动脉支。线栓穿过距ICA和ECA分叉处约2.0 cm有阻力感时,表明线栓已将大脑中动脉堵塞,将备线扎紧并记录栓塞开始时间。将少量青霉素注射粉针涂于手术伤口,对齐并缝合皮下软组织和皮肤,栓线尾部留于体外。2 h后缓慢退出线栓至CCA切口处,恢复MCA区血流供应。术中维持大鼠肛温37℃左右,直至动物苏醒。Sham组的动物只做钝性分离,但不插入线栓,其他操作与手术组相同。
2.3 神经功能评分
再灌注7 d后,根据Zea Longa的神经功能缺损5分制标准[7],对实验大鼠进行神经行为功能评分。分数越高,损伤越严重。剔除造模过程中死亡大鼠,以及取材时发现蛛网膜下腔出血的大鼠。
2.4 大鼠脑组织含水量的测定
再灌注7 d后,异氟烷过量深度麻醉处死大鼠,快速断头取脑,去除嗅球、小脑和低位脑干,迅速称取脑湿重。然后将脑组织置于110℃干燥箱中烘至恒重,称取脑组织干重。脑组织含水量=(脑组织湿重-脑组织干重)/脑组织湿重×100%。
2.5 大鼠脑组织梗死体积的测定
采用TTC染色法测定脑组织梗死体积。再灌注7 d后,10%水合氯醛过量深度麻醉处死大鼠,快速断头取脑,去除嗅球、小脑和低位脑干,即刻放入鼠脑专用切片模具中,按2 mm的规格冠状切为5片,迅速加入2%TTC染色液,避光置于37℃水浴中保温20 min,其间每隔7~8分钟上下面翻动一次。根据切片颜色结束染色过程,正常脑组织呈玫瑰红色,梗死组织呈白色。将切片按层面顺序排列整齐并用数码相机拍摄照片后输入电脑,使用Image-Pro Plus 6图像分析软件测定大脑健侧半脑面积及梗死侧正常组织面积。梗死面积百分比(%)=[(梗死面积×2 mm)/(2×健侧脑面积×2 mm)]×100。
2.6 Western blot检测相关蛋白的表达
再灌注7 d后处死动物,取缺血侧脑组织皮质部分,放入预冷的组织裂解液(1∶9),冰浴中进行匀浆,得到的组织匀浆于4℃12 000 r/min离心20 min,取上清液获得总蛋白,BCA法测定蛋白浓度。加入适当量的蛋白上样缓冲液混匀、离心、变性、上样。每孔加入上样蛋白50µg,SDS-PAGE凝胶电泳分离,然后进行转膜、封闭。加入一抗后4℃孵育过夜,二抗室温摇床孵育2 h。采用ECL发光试剂显色,并经Image J凝胶成像系统进行显影检测。涉及到的一抗包括:LC3(1∶500),Beclin-1(1∶2 000),IkB-α(1∶2 000),p-IkB-α(1∶2 000),P62(1∶3 000),p65(1∶2 000),Bcl-2(1∶1 000),Bcl-xl(1∶1 000),Bax(1∶5 000),Bid(1∶5 000),Bad(1∶2 000),caspase 8(1∶2 000),cleaved-caspase 3(1∶1 000),GAPDH(1∶1 000);二抗:羊抗兔IgGHRP(1∶5 000)。
2.7 RT-PCR检测相关基因的表达
称取各组大鼠脑组织100 mg,加Trizol 1 mL,提取总RNA,定量后取RNA 2µg逆转为cDNA,用SYBR Green进行扩增,采用的循环为:95℃15 s,60℃1 min,95℃1 min,65℃10 s,共40个循环。采用GAPDH作为每次扩增过程中的内参,引物的序列见表1。
2.8 HE染色和TUNEL染色
制备脑组织石蜡切片,将组织切片经过梯度乙醇常规脱蜡至水,经苏木精-伊红(HE)染色、二甲苯透明后中性树胶封片,光学显微镜下观察。此外,依据TUNEL试剂盒说明书操作,光学显微镜下观察各组大鼠脑组织凋亡神经元并拍照计数。
2.9 统计学处理
采用GraphPad Prism统计软件包进行数据统计。所有数据采用xˉ±s表示,组间比较采用One-Way ANOVA检验,P<0.05为差异有统计学意义。
3结果
3.1 马赛替尼对I/R模型大鼠神经功能和脑梗死的影响
Sham组无明显神经功能损伤。I/R损伤后,各组动物表现出不同程度的神经功能障碍,出现强迫体态和对侧前肢偏瘫,爬行时向偏瘫侧转圈、追尾等相应症状。如图1-B所示,与Sham组相比,I/R组大鼠神经功能缺损评分明显升高(P<0.001),表明I/R大鼠造模成功;与I/R组相比,马赛替尼低、中、高剂量组和依达拉奉组大鼠经过治疗后,神经功能缺损评分均不同程度降低(P<0.05,P<0.001,P<0.001,P<0.001),其中马赛替尼高剂量组效果最突出。
再灌注7 d后,对脑组织进行TTC染色,评估脑梗死的情况。正常脑组织因含有脱氢酶而被染成红色,梗死脑组织因细胞膜损伤,导致脱氢酶被完全释放丢失而不被染色。如图1-C和1-D所示,Sham组大鼠的脑组织均呈红色,无梗死灶出现;I/R组和马赛替尼组均出现了不同程度的脑组织梗死。与Sham组相比,I/R组大鼠脑梗死体积明显增加(P<0.001);与I/R组相比,马赛替尼低、中、高剂量组和依达拉奉组均能够不同程度的降低脑梗死体积(P<0.05,P<0.01,P<0.01,P<0.01),其中马赛替尼高剂量组的降幅最大。
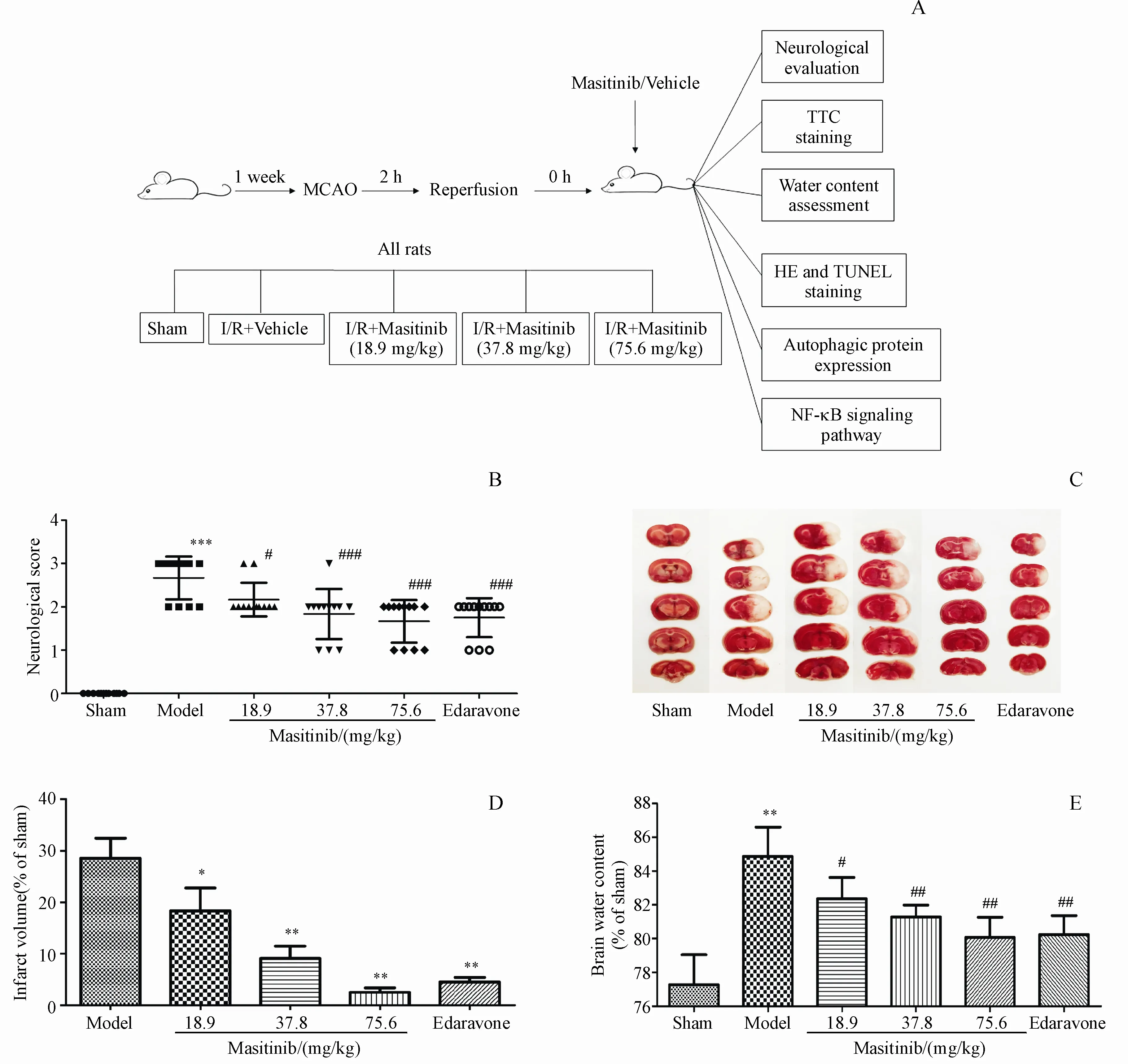
Figure 1 Effects of masitinib on neurological score and infarction after ischemia/reperfusion(I/R)A:Experimental outline;B:Neurologic deficits were assessed at 7 d after reperfusion(xˉ±s,n=12);C:Infarcted brain regions were visualized using TTCstaining.Representative examples are shown from each treatment group;D:The ratio of corrected infarct area to whole brain area was calculated for thecerebral infarct size(xˉ±s,n=6).(E)Brain edemaweredetected in ischemic cerebral cortex after cerebral I/Rin rats(xˉ±s,n=6)*P<0.05 vs shamgroup,**P<0.01,***P<0.001 vs shamgroup;#P<0.05 vs model group,##P<0.01 vs model group
与健侧脑组织相比,缺血侧脑组织出现明显水肿(图1-E)。与Sham组相比,I/R组大鼠的脑水肿程度显著增加(P<0.01)。给予不同剂量的马赛替尼和依达拉奉后,脑水肿程度均得到了不同程度的减轻(P<0.05,P<0.01,P<0.01,P<0.01)。
3.2 马赛替尼对I/R模型大鼠脑组织损伤的影响
HE染色结果如图2-A所示:Sham组大脑皮层神经元基本正常,核居中,未见神经元明显变性、坏死及炎细胞浸润等病理学改变。I/R组大脑皮层神经元均出现重度变性、坏死。神经元数目明显减少,神经元结构模糊、胞体肿胀,尼氏体减少或消失,出现不同程度的核固缩、核溶解。马赛替尼各剂量组和依达拉奉组均能不同程度的减轻神经元损伤,神经元变性、坏死程度明显减轻,炎细胞浸润明显减少。
TUNEL染色结果如图2-B所示:I/R损伤可引起大鼠缺血侧皮层神经元细胞发生凋亡,表现为TUNEL阳性细胞(棕黄色)数量明显增加,Sham组大鼠皮层神经元几乎未见TUNEL阳性细胞。马赛替尼各剂量组和依达拉奉组均能不同程度的减少TUNEL阳性细胞数量,其中马赛替尼高剂量组作用最明显。结果提示马赛替尼可明显减少I/R损伤引起的大鼠缺血侧皮层神经元细胞凋亡。
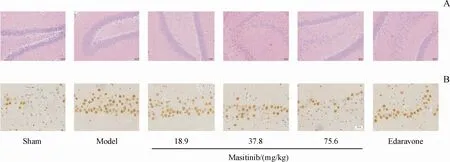
Figure2 Effects of masitinib on neuronal injury and apoptosis in ischemic cerebral cortexA:Cerebral sections were stained with hematoxylin and eosin and examined under light microscopeat 7 d after reperfusion;B:Representativemicropho⁃tographs of TUNEL staining in the ischemic cortex at 7 d after perfusion(Scale bar,20µm)
3.3 马赛替尼对I/R模型大鼠脑组织中自噬水平的影响
采用Western blot法检测自噬标记物LC3、Beclin-1和p62的蛋白水平。结果如图3-A,3-B和3-D所示,I/R组大鼠脑组织中Beclin-1和LC3-I的表达显著升高(P<0.01,P<0.01),且LC3-I向LC3-II的转化增多;p62的表达降低(P<0.01)。与I/R组相比,马赛替尼中剂量和高剂量组均不同程度地降低了Beclin-1(P<0.05,P<0.01)和LC3-I的表达,抑制了LC3-I向LC3-II的转化(P<0.01,P<0.01);增加了p62的表达(P<0.01,P<0.01)。与蛋白表达的变化一致,给予马赛替尼中剂量和高剂量后,p62的mRNA水平也显著上调(P<0.01,P<0.01)(图3-E)。
3.4 马赛替尼对I/R模型大鼠脑组织中NF-κB信号通路的影响
结果如图4所示,与Sham组相比,I/R组大鼠脑组织内NF-κB蛋白和mRNA的表达明显上调(P<0.01,P<0.01);与I/R组相比,只有马赛替尼高剂量组显著抑制了I/R损伤后NF-κB蛋白和mRNA表达的上调(P<0.01,P<0.01)。此外,与Sham组相比,I/R组大鼠脑组织内IκBα的表达显著降低(P<0.01),而p-IκBα的表达则明显增加(P<0.01)。与I/R组相比,不同剂量的马赛替尼均能不同程度地逆转I/R损伤后的上述变化,其中高剂量组作用最显著(P<0.01,P<0.01)。
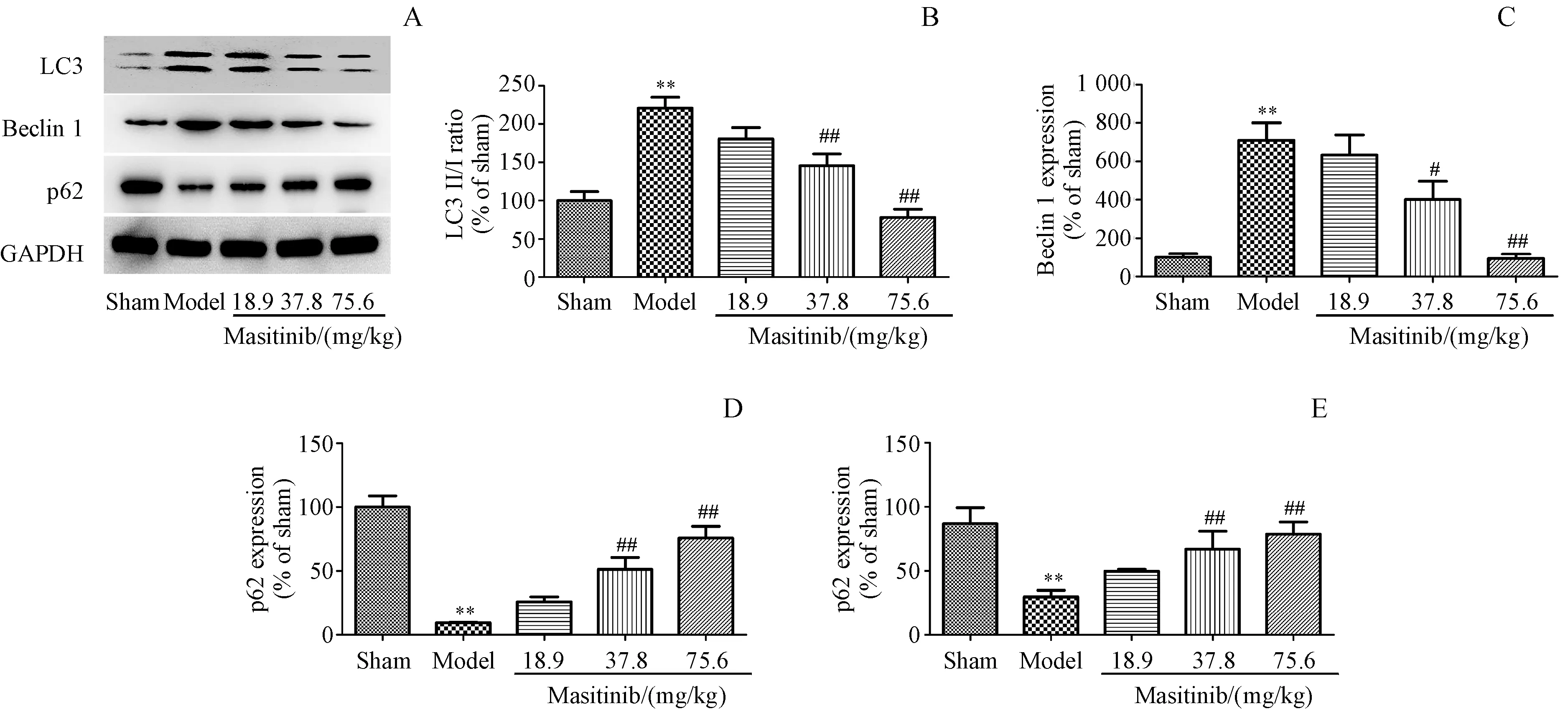
Figure 3 Effects of masitinib on autophagy in ischemic cerebral cortex after I/RA:Representative Western blots of LC3,Beclin-1 and p62 protein expression in ischemic cerebral cortex after I/R;B-D:Quantitation of the Western blot analysis for LC3,Beclin-1 and p62 compared with GAPDH;E:p62 mRNA expression was normalized to GAPDH level(xˉ±s,n=3)**P<0.01 vs sham group;#P<0.05 vs model group,##P<0.01 vs model group
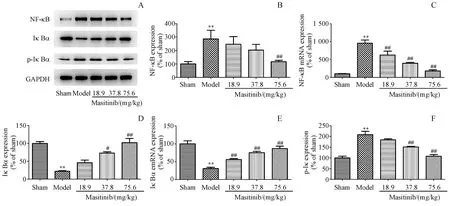
Figure4 Effectsof masitinib on autophagic cell apoptosisin ischemic cerebral cortex after I/RA:Representative Western blots of Bcl-2,Bcl-xl,Bax,Bad,Bid,caspase 8 and cleaved caspase 3 protein expression in ischemic cerebral cortex after I/R;B:Quantitation of the Western blot analysis for Bcl-2,Bcl-xl,Bax,Bad,Bid,caspase 8 and cleaved caspase3 compared with GAPDH(xˉ±s,n=3)**P<0.01 vs sham group;#P<0.05 vs model group,##P<0.01 vs model group
3.5 马赛替尼对I/R模型大鼠脑组织中凋亡水平的影响
如图5所示,Western blot结果表明I/R损伤后,Bax、Bid、Bad、caspase 8和cleaved-caspase 3的表达显著升高(P<0.05,P<0.01,P<0.01,P<0.01,P<0.01),而Bcl-2和Bcl-xL的表达则明显降低(P<0.01,P<0.01)。与I/R组相比,马赛替尼高剂量组显著逆转了上述所有蛋白的变化(P<0.01,P<0.01,P<0.05,P<0.01,P<0.01,P<0.01,P<0.01)。
4讨论
脑缺血损伤可阻断脑血流,导致缺血缺氧,进而过度激活氧化应激和炎症反应,导致神经元细胞死亡[8-9]。马赛替尼最初被授权用于治疗犬肥大细胞瘤[10]。最新研究指出,马赛替尼能够作为一种强的化学增敏剂,增加吉西他滨对人类胰腺癌的抗肿瘤作用[11]。然而,马赛替尼在脑缺血中的作用却鲜有研究。本研究旨在探讨马赛替尼对大鼠脑I/R损伤的保护作用及其机制。
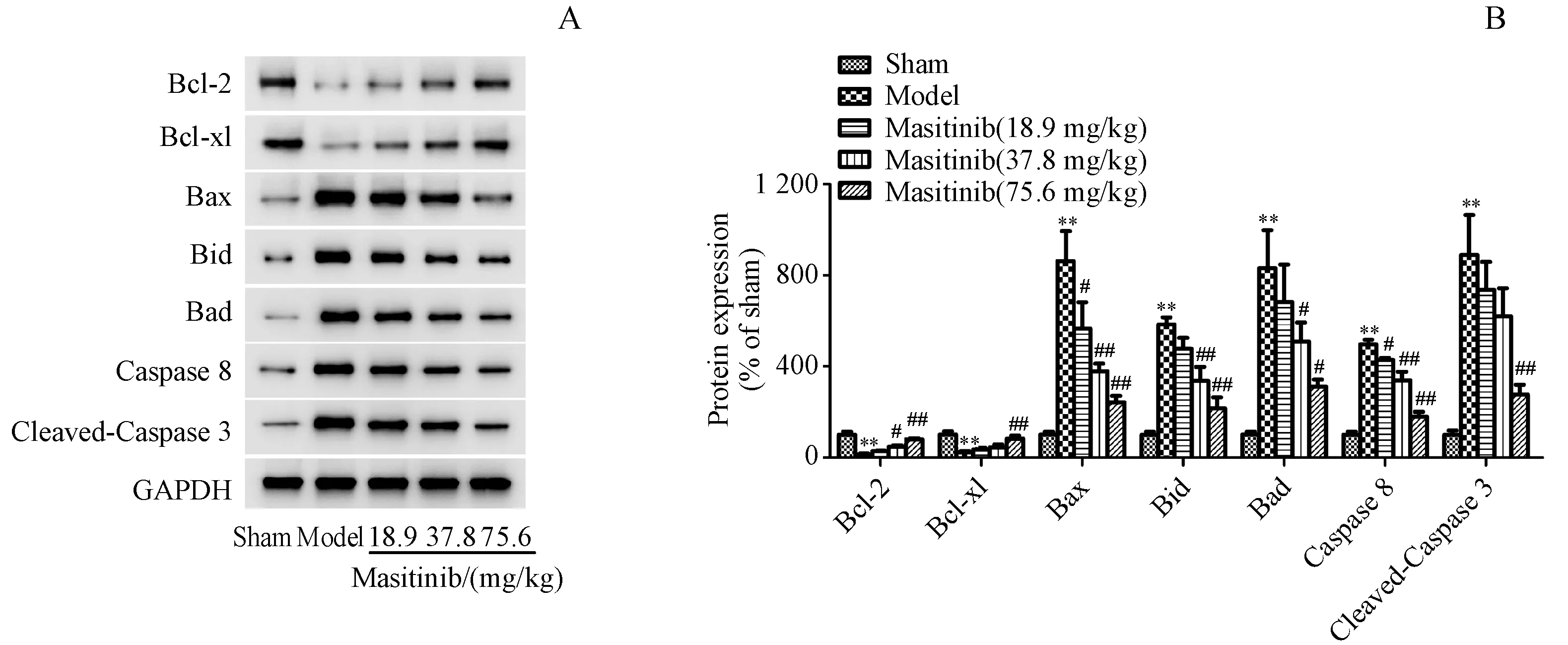
Figure 5 Effects of Masitinib on NF-κBsignalingpathway in ischemic cerebral cortex after I/RA:Representative Western blots of NF-κB,IκB and p-IκB protein expression in ischemic cerebral cortex after I/R;B-C:Quantitation of the Western blot and PCR analysis for NF-κB;D-E:Quantitation of the Western blot and PCR analysis for IκB;F:Quantitation of the Western blot analysis for p-IκB(xˉ±s,n=3)**P<0.01 vs sham group;#P<0.05 vs model group,##P<0.01 vs model group
本研究结果显示,I/R损伤可导致严重的神经功能障碍,并伴有自噬的激活。给予马赛替尼治疗后,不仅能明显降低模型组大鼠脑组织的梗死面积和脑含水量,而且能显著改善神经功能缺损。TUNEL染色结果表明,马赛替尼能显著抑制I/R损伤引起的神经元凋亡。
近年来脑缺血后自噬的研究已成为国内外关注的热点[12-13]。在正常生理条件下,自噬被限制在基本水平范围内;但是在饥饿以及细胞内外环境变化的刺激下,自噬便被激活[14]。自噬相关蛋白Atg8,即微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3),是自噬体形成的唯一标志物,LC3-I广泛分布于细胞质中,当自噬发生形成自噬体后,胞浆型的LC3-I可以转变成存在于自噬体膜上的脂质型LC3-II,超微电镜下观察到自噬体是细胞自噬发生的铁证,自噬体越多,LC3-II/(LC3-I+LC3-II)的比值越高,细胞自噬水平越高,LC3-II的生成是蛋白水平检测自噬程度的金指标[15]。自噬蛋白p62通过直接与LC3结合选择性地并入自噬体中,并通过自噬有效降解。p62水平与自噬活动呈负相关[16-17]。自噬另一相关蛋白是Beclin-1,Beclin-1是第一个被报道参与自噬启动环节的主要蛋白[18-20]。在本研究中,马赛替尼显著降低了LC3-II/I比值,下调了Beclin-1的表达,上调了p62的表达,表明马赛替尼可能通过抑制自噬对I/R损伤起到神经保护作用。
P62还可以通过锌指结构与调节细胞凋亡的分子开关RIP1结合形成信号复合物。近年来,研究表明p62/RIP1信号复合物可作为支架蛋白激活IKK,降解IκB,激活NF-κB信号通路[21]。NF-κB信号的激活是由κB激酶的上游激酶抑制剂介导的。许多刺激可激活IκB激酶,使IκB磷酸化,导致其泛素化和蛋白酶体降解。随后,NF-κB进入细胞核,诱导靶基因转录。因此,IκB为阻断NF-κB通路提供了一种可能的途径。特别是,“超级阻遏物”IκBα是IκB的一种抗降解形式,已被证明能阻断NF-κB的活性[22]。在本研究中,马赛替尼能够显著降低I/R损伤后NF-κB和p-IκBα的表达;增加IκBα的表达,提示NF-κB信号通路参与了马赛替尼对脑缺血损伤的保护作用。
自从Beclin-1在自噬过程中被发现以来,Beclin-1作为一种Bcl-2相互作用蛋白的新作用被注意到了[23-24]。Bcl-2或Bcl-xl可与Beclin-1结合以抑制自噬,而Beclin-1的敲除使哺乳动物细胞对饥饿诱导的凋亡敏感[25]。一旦Beclin-1和Bcl-2或Bcl-xl之间的相互作用被破坏,Beclin-1将被释放以促进自噬[26-27]。先前的研究表明P62在细胞凋亡中起着信号传导的核心作用[28]。作为对死亡受体刺激的反应,基于Cullin3的泛素连接酶可以与诱导死亡的信号复合物结合并诱导caspase 8的多泛素化。当用诱导内质网应激或蛋白酶体抑制的试剂处理细胞时,细胞可以直接通过caspase 8激活凋亡系统,而不涉及死亡受体信号。Caspase 8介导的细胞凋亡的新机制依赖于自噬相关蛋白LC3和P62[29-31]。因此,caspase 8除了在“经典”外源性凋亡中作为一种典型的caspase物种外,还可以P62依赖的方式激活,并参与一种替代的内源性凋亡途径,特别是在由各种试剂或药物诱导时。在本研究中发现马西替尼可明显降低缺血再灌注损伤后促凋亡蛋白Bid、Bax、Bad、caspase 8和切割caspase 3的表达,而增加Bcl-2和Bcl-xl的表达。基于以上结果,推测马赛替尼可下调Beclin1和caspase 8的表达,推测马赛替尼可能通过P62依赖的方式阻止Bcl-2与Beclin-1的分离,抑制capase 8的激活,从而抑制自噬和凋亡。
综上所述,马赛替尼减轻了缺血再灌注的神经损伤作用,其作用机制可能是通过抑制过度自噬和凋亡发挥的。自噬参与了脑血管疾病的发生过程这一点毋庸置疑,但自噬在脑缺血损伤后的作用仍然是有争议的。有的研究报道自噬在缺血/低氧性脑病发病机制中加重脑损伤,但也有报道在脑缺血后,自噬的激活减轻脑损伤,起到脑保护作用。关于自噬在缺血性脑损伤中呈现的相反作用,一方面推测这可能与实验中采用了不同的缺血再灌注时间、使用了非特异性的药物或者方法有关;另一方面也进一步提示自噬在脑缺血的病理生理机制中是一把“双刃剑”。选择合适的药物,引导自噬在疾病中发挥积极作用,这将为脑血管疾病的治疗开启新纪元。
