乙烯基胶原蛋白微球的制备及其应用*
2021-05-07邢燕梅王学川
徐 娜,邢燕梅,王学川
(1.陕西科技大学 轻工科学与工程学院,西安 710021;2.陕西科技大学 化学与化工学院,西安 710021)
0 引 言
我国是皮革生产大国,每年有大量的出口贸易,在带来经济增长的同时,也会带来一系列问题,如:环境污染、资源浪费等。这些问题会制约该行业的发展,所以皮革废弃物资源化利用就显得尤为重要。据报道,皮革固体废弃物中含有大量的胶原蛋白,通过对制革过程中产生的残次皮料、边角余料等进行加工处理可以为其它行业提炼出满足需求的胶原蛋白。从而达到废弃胶原蛋白再利用的目的[1-2]。
胶原蛋白是一种分子链上含有大量的活性基团(氨基、羟基、羧基)的天然高分子材料[3-4]。胶原蛋白具有廉价易得、来源广泛、环保可降解、无毒性等优点,但它同时遇水易溶胀、干燥后易断裂、黏度大难清理的缺点也会限制一部分应用。将胶原蛋白作为原材料制备的胶原蛋白微球则避免了这些缺点。胶原蛋白微球因具有形状特殊性(球形)、良好的包埋性、小尺寸、比表面积大、吸附性强、功能基在表面富集等特殊特点,被广泛应用在多个领域如医药学、食品、染料处理、化妆品中[5-10],成为当今科学研究的热点之一。虽然研究胶原蛋白微球的应用领域非常广泛,但是应用在纺织材料的相关研究报道还是相对比较少。
1 实 验
1.1 乙烯基胶原蛋白微球的制备
1.1.1 实验试剂及仪器
胶原蛋白(上海阔泉生物科技有限公司,工业级);甲基丙烯酸酐(上海阿达玛斯试剂有限公司,RG);液体石蜡(天津市富宇精细化工有限公司,CP);Span-80(天津市恒兴化学试剂制造有限公司,CP);戊二醛水溶液(天津市科密欧化学试剂有限公司,AR);甲醛水溶液(天津市天力化学试剂有限公司,AR);(3-巯基丙基)三甲氧基硅烷(上海阿达玛斯试剂有限公司,RG);三(2-羧乙基)膦盐酸盐(上海麦克林生化科技有限公司,RG)。
电热恒温水浴锅(上海科恒实业发展有限公司);恒速数显搅拌器(杭州仪表电机有限公司);高速离心机(安徽中科中佳科学仪器有限公司);冷冻干燥机(宁波新芝);傅里叶红外光谱仪(FT-IR,德国布鲁克公司);激光粒度分析仪(英国Mastersizer);扫描电镜(捷克TESCAN);超景深三维显微镜(日本HIROX(浩视)公司);静态接触角测量仪(德国Dataphyscs)。
1.1.2 乙烯基胶原蛋白的制备
乙烯基胶原蛋白的制备利用氨基(胶原蛋白)和羧基(甲基丙烯酸酐)的酰胺化反应[11-13]。将5 g胶原蛋白加入到含有50mL磷酸缓冲溶液(pH=7.4)的锥形瓶中,将锥形瓶置于70 ℃的恒温磁力搅拌器中加热搅拌至胶原蛋白完全溶解。然后将恒温磁力搅拌器的温度降至50 ℃,向锥形瓶中加入甲基丙烯酸酐反应2 h,甲基丙烯酸酐的加入量为磷酸缓冲溶液体积的3/500,透析24 h,冷冻干燥24 h,得到乙烯基胶原蛋白(CMA)。
1.1.3 乙烯基胶原蛋白微球的制备
图1所示的是以戊二醛为交联剂,通过乳化交联法制备乙烯基胶原蛋白微球的示意图。具体操作参考下列文献[14-16]:配置一定质量分数(10%、15%、20%、25%、27.5%、30%、32.5%)的乙烯基胶原蛋白水溶液(水相);将Span-80加入到含有液体石蜡(油相)的三口烧瓶中(Span-80的加入量为液体石蜡体积的0.5%、1.0%、1.5%、2.0%、2.5%),再将三口烧瓶置于水浴锅中,于一定转速(400、600、800、1000和1200 r/min)下将水浴锅升温至60 ℃使二者混合均匀。10 min后将一定体积的乙烯基胶原蛋白水溶液缓慢滴加至三口烧瓶中乳化20 min(水油体积比为1∶3、1∶4、1∶5、1∶6、1∶7)。然后在冰浴状态下加入一定量(0.2、0.4、0.6、0.8和1 mL)的戊二醛水溶液交联2 h。向乳液中加入10 mL的异丙醇进行脱水处理,10min后停止反应,将乳液于3000 r/min下离心5 min分离,先用异丙醇、丙酮交替洗涤4次沉淀物,再用水洗涤3次以除去杂质。冷冻干燥后即可得到纯净的乙烯基胶原蛋白微球(CMAs)。用同样的方法制备胶原蛋白微球(Cs)。
随着社会经济的飞速发展,中国近年来的用电需求提升迅速,配电网架不断扩大,尤其是农村用电负荷的增加,也对优质的供电电能提出了新的要求。然而,中国配电网建设滞后于经济建设,其网架薄弱,线径小,供电半径长(尤其是农网线路),配电变压器分布广、数量多,且主要集中在线路后端[1]。往往导致线路末端电压低,供电质量差。

图1 乙烯基胶原蛋白微球的制备示意图
1.1.4 乙烯基胶原蛋白微球在尼龙基材上的应用
将直径为55 mm的尼龙圆片浸泡在体积比为100:3的甲醛溶液和磷酸溶液中,于60 ℃下反应15 h,制备羟基化尼龙(Nylon-OH),再将Nylon-OH置于体积比为1 000∶7的异丙醇和硅烷偶联剂(3-巯基丙基)三甲氧基硅烷,于70℃下反应12 h制备Nylon-SH[17]。将Nylon-SH浸泡在5 mmol/L的三(2-羧乙基)膦盐酸盐溶液(TCEP)中还原1 h,然后将含有0.008%的光引发剂(Irgacure2959)的乙烯基胶原蛋白微球水溶液(6%)喷涂在Nylon-SH上,将其置于紫外灯(50 W,365 nm,辐照距离15 cm)下“巯基-烯点击”反应5 h,放入水中超声30 min,得到乙烯基胶原蛋白微球/尼龙复合材料(Nylon-CMAs)。
1.1.5 Nylon-CMAs的耐湿热稳定性能
将未进行巯基化的尼龙按照制备Nylon-CMAs的操作方法进行,得到另一种纯物理结合的胶原蛋白微球/尼龙复合材料(Nylon-Cs)。并与Nylon-CMAs材料进行湿热稳定性的对比实验。具体操作将Nylon-Cs和Nylon-CMAs分别置于100 mL蒸馏水中,加热至100 ℃并持续加热30min,量加热前后基材的质量变化。
1.2 样品的性能与表征
将样品置于载物台上,采用傅里叶变换红外光谱仪分析待测样品的特征官能团;将待测样品粘附在导电胶上喷金60 s,使用扫描电子显微镜观测样品的形貌;另外,将乙烯基胶原蛋白微球分散在水中,取一滴滴在载玻片上使用超景深三维显微镜观察微球在水溶液中的形貌。同时,还将微球分散在水中,用激光粒度分析仪测量乙烯基胶原蛋白微球的粒径及分布。最后,将基材粘在载玻片上并在尼龙基材上取10个不同位置的点,采用静态接触角测量仪测量基材的接触角。
2 结果与讨论
2.1 乙烯基胶原蛋白微球制备的条件优化
图2是乙烯基胶原蛋白浓度对微球粒径大小的影响。随着乙烯基胶原蛋白水溶液浓度的增加微球的粒径也随之在增大。乙烯基胶原蛋白水溶液浓度是影响成球效果的重要因素之一,随着溶液浓度的增加,溶液黏度不断增大,乳滴也随之增大,微球的粒径也就不断增加。
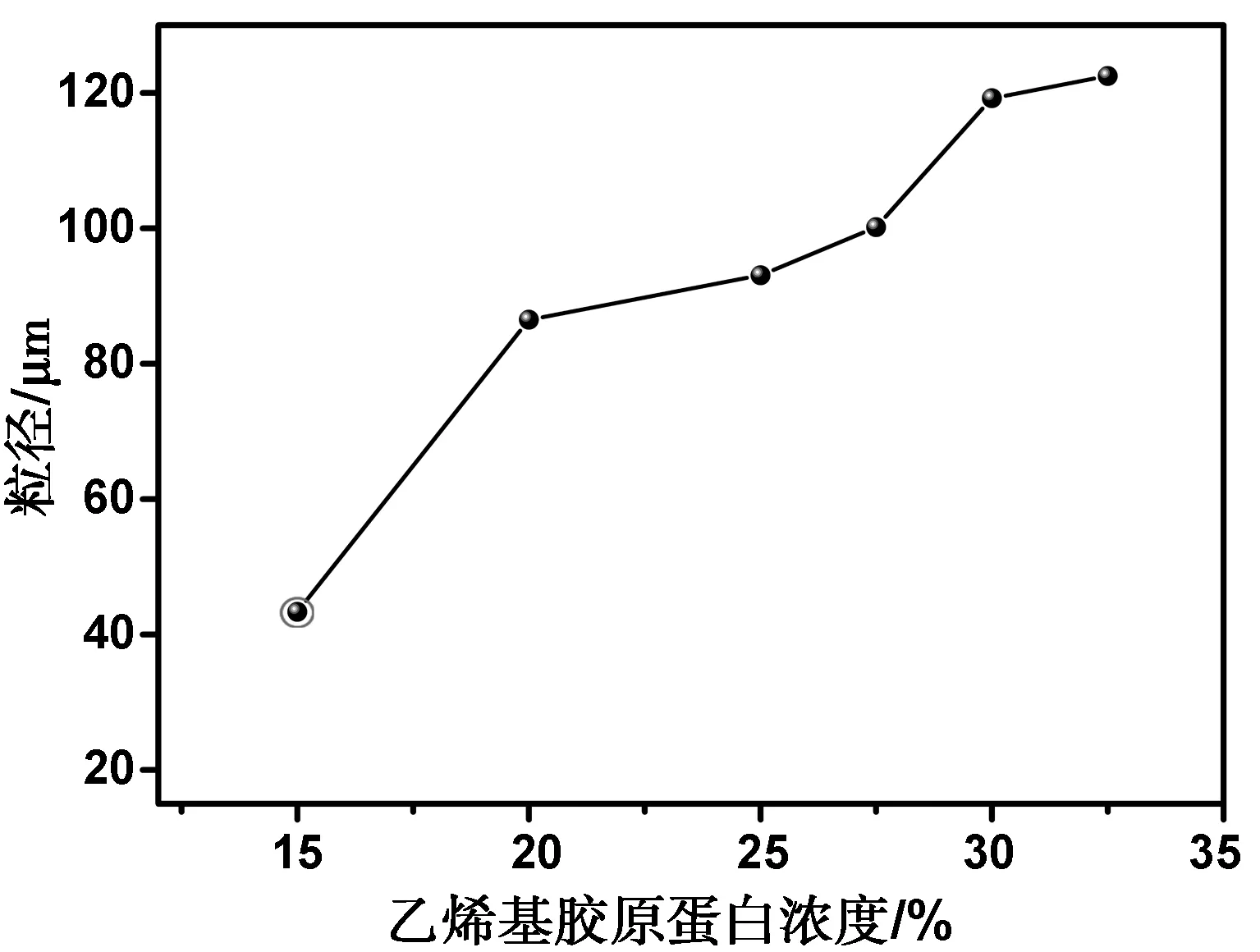
图2 乙烯基胶原蛋白溶液浓度对微球粒径的影响
图3是转速对微球粒径大小的影响。微球的粒径随着转速的增大先减小后增大,当转速为800 r/min时,粒径最小。这是因为转速较小时,不能提供足够的剪切力使乳液分散成较小的液滴。但当搅拌速度过大时会增加液滴与液滴之间的碰撞几率,导致微球之间粘连在一起,粒径增大。
图4是交联剂用量对微球粒径大小的影响。微球的粒径随着交联剂用量的增大先减小后增大。这是因为交联剂用量较少时,乙烯基胶原蛋白分子链之间没有充分交联,当破坏乳滴的行为发生时乳液中的微球不能很好的维持球形。当交联剂用量增加到0.8 mL时,乙烯基胶原蛋白分子链之间充分交联,粒径最小。当交联剂用量继续增大,微球之间会粘连,从而粒径增大。

图4 交联剂用量对微球粒径的影响
图5是水油相体积比对微球粒径大小的影响。微球的粒径随着水油相体积比的减小而减小。这是因为该乳液体系是油包水类型,当乳液体系中油相(连续相)多时,乳化时可以提供充足的空间让乳滴得到充分乳化,从而被分散成小液滴,所以微球的粒径较小,而当油相体积相对较少时,会大幅度增加乳滴与乳滴之间的碰撞几率,导致微球粘连现象严重,所以粒径会随着油相体积的减少而增大。考虑到经济环保,所以本实验选择水油比为1∶5。
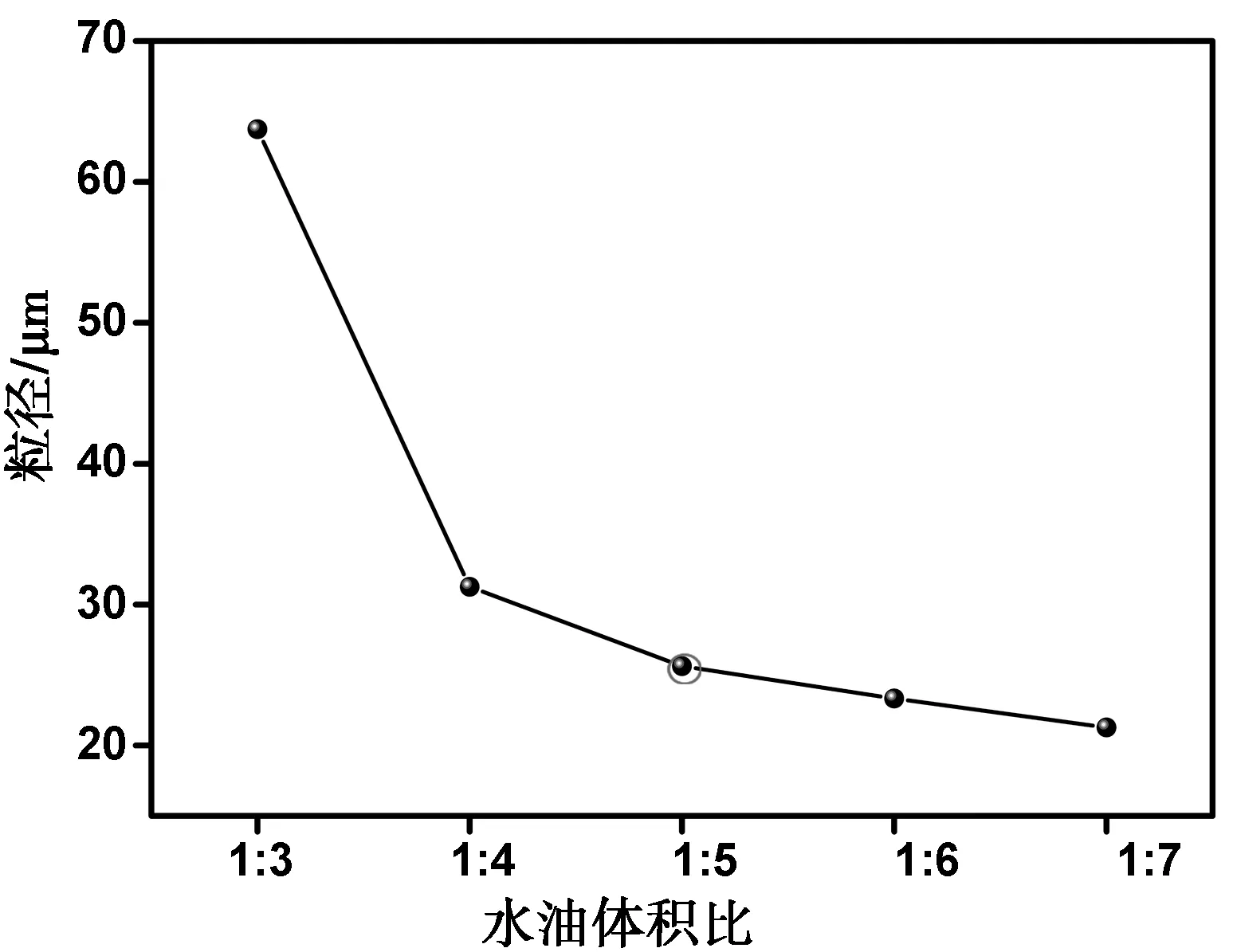
图5 水油相体积比对微球粒径的影响
从图6中可看出,乙烯基胶原蛋白微球的平均粒径随乳化剂用量的增加而减小。将乳化剂加入到体系中,乳化剂会吸附在油水界面上,随着用量的增加,吸附量也随之增加,界面张力的下降程度也在增加,从而导致液滴的直径减小。当乳化剂用量为2%~2.5%时粒径下降程度不明显,但是后处理时比较困难,需要大量的溶剂清洗除去,所以本实验选用2%的乳化剂用量。
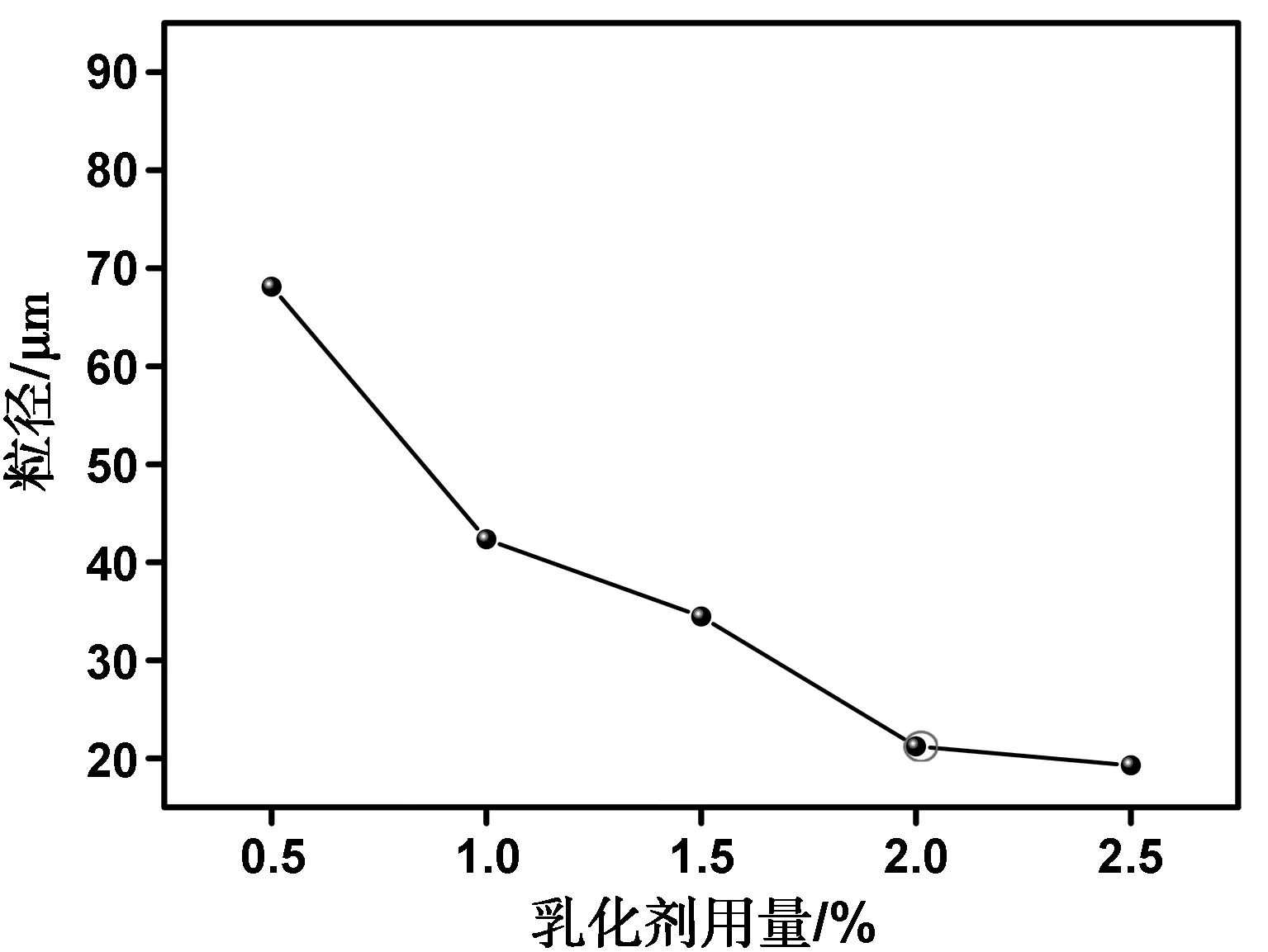
图6 乳化剂用量比对粒径的影响
2.2 乙烯基胶原蛋白微球的表征
图7是胶原蛋白、乙烯基胶原蛋白的FT-IR谱图。在这两种物质的红外谱图中,3 437 cm-1左右的宽频带属于胶原蛋白中氧氢键和氮氢键的伸缩振动吸收峰,1 633 和1 436 cm-1分别对应着胶原蛋白的N-H变形振动吸收峰和NH 二级吸收峰。1 350 cm-1为胶原蛋白中C=O 伸缩振动吸收峰。对比这两者峰形可以发现,1 078 cm-1处为C-N-C的伸缩振动峰[18],该峰为胶原蛋白上的氨基和酸酐发生酰化反应。乙烯基胶原蛋白在788 cm-1处有新的出峰,该峰可以归属为不饱和碳碳双键上碳氢键的面外弯曲振动峰。由此说明甲基丙烯酸酐成功改性胶原蛋白,胶原蛋白分子链上接枝了不饱和碳碳双键。

图7 胶原蛋白和乙烯基胶原蛋白微球的红外谱图
图8是胶原蛋白微球和乙烯基胶原蛋白微球的固体核磁氢谱。对比这两者的峰形可以看到,胶原蛋白微球在3×10-6处的峰应该归属于胶原蛋白中赖氨酸上的氨基上氢的共振吸收峰[19],而经过改性以后,得到的乙烯基胶原蛋白微球在此处的峰消失了,这一点说明甲基丙烯酸酐与胶原蛋白中的赖氨酸的氨基发生了反应。同时,乙烯基胶原蛋白微球在(4.9~6.8)×10-6处有一个宽信号峰,推测这个吸收峰应该归属碳碳双键(-C=C-)上氢的核磁共振吸收峰[20]。因此,也证明改性胶原蛋白微球上被成功的引入了-C=C-。

图8 胶原蛋白微球和乙烯基胶原蛋白微球的固体核磁氢谱
乳化交联法制备的乙烯基胶原蛋白微球的形貌及粒径如图9所示,(a)和(b)显示的是微球在干燥状态下的SEM图片,图中微球形貌规整,具有完整的球形,表面光滑,且微球之间没有出现粘连现象。如图9(c)所示,粒径分析仪测定微球的平均粒径是21.204 μm,分布范围较窄,较多分布在20~40 μm。如图9(d)所示,乙烯基胶原蛋白微球在水溶液中的形貌,微球在水溶液中颗粒饱满,粒粒分明。
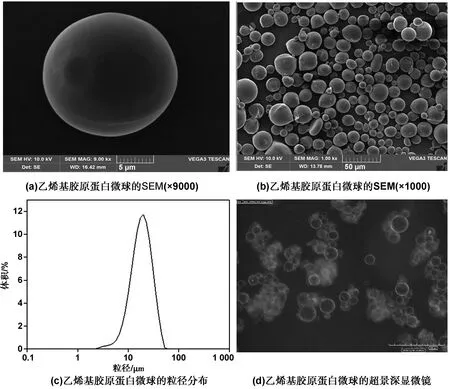
图9 乙烯基胶原蛋白微球的形貌及粒径
2.3 乙烯基胶原蛋白微球在尼龙上的应用
2.3.1 Nylon-CMAs的形貌及结构表征
图10为Nylon 和Nylon-CMAs的扫描电镜图。图10(a)为Nylon的微观形貌图,尼龙纤维束呈规则编制分布,纤维上光滑无异物。图10(b)是Nylon-CMAs的微观形貌图,可以看到乙烯基胶原蛋白微球呈无规则状态分布在尼龙表面上。

图10 Nylon 和Nylon-CMAs的SEM
用傅里叶红外光谱仪表征了Nylon 和Nylon-SH的官能团(如图11所示)。由图可得,3 296 cm-1处的出峰为胺基的吸收峰,2 933、2 860 cm-1处的出峰为亚甲基的吸收峰。尼龙中存在酰胺基团(1 638 cm-1,C=O伸缩振动,酰胺Ⅰ的吸收峰;1 542 cm-1处有N-H变形振动,酰胺Ⅱ的吸收峰)[21]。与Nylon相比,Nylon-SH在1 020 cm-1处有新的出峰,该峰为Si-O-Si的振动峰,证明-SH修饰到尼龙上。

图11 Nylon 和Nylon-SH的红外谱图
图12是尼龙经改性前后的平均接触角数值和对应图片。接触角的数值大小可以反应样品的亲疏水性能,数值越小代表样品越亲水。Nylon、Nylon-OH、Nylon-SH和Nylon-CMAs的接触角分别为120.6°±5°、82.0°±8°、93.4°±4°、72.6°±5°,Nylon-CMAs的接触角数值最低。说明乙烯基胶原蛋白的引入使尼龙从疏水织物改性为亲水性织物。

图12 Nylon, Nylon-OH,Nylon-SH和Nylon-CMAs 的接触角
2.3.2 Nylon-CMAs的湿热稳定性
制备复合基材的最后一步需要超声处理以除去基材上未反应的乙烯基胶原蛋白微球。在此过程中,Nylon-Cs上的胶原蛋白微球涂附在Nylon上,属于物理复合,所以超声过程中微球全部脱落,基材的质量未变化。而Nylon-CMAs因为乙烯基胶原蛋白微球修饰到基材上,超声后微球仍然在基材上,所以基材的质量明显增加(图13)。将Nylon-Cs和Nylon-CMAs 用100 ℃沸水高温分别煮30 min后,乙烯基胶原蛋白微球仍然接枝在尼龙上,仅有少量微球脱落。说明乙烯基胶原蛋白微球成功修饰到尼龙上,且湿热稳定性良好。
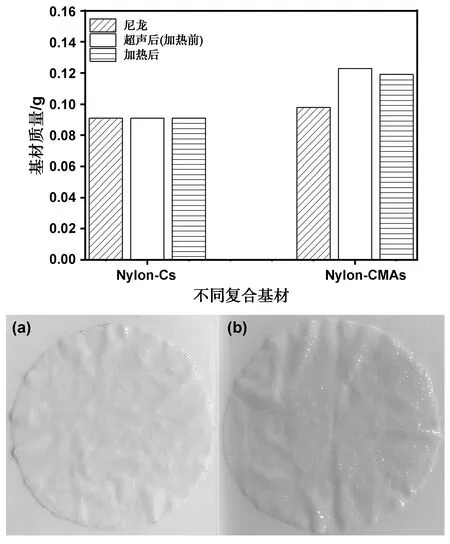
图13 (a)Nylon-Cs和(b)Nylon-CMAs水煮前后的质量变化以及对应实物图
3 结 论
乳化交联法制备的乙烯基胶原蛋白微球球形完整,表面光滑。当乙烯基胶原蛋白浓度为15%,转速为800 r/min,交联剂用量为0.8 mL,水油比为1∶5,乳化剂用量为2%,粒径分布较窄,平均粒径在21.204 μm。将乙烯基胶原蛋白微球应用到尼龙上可以有效改善尼龙的亲水性能,将尼龙从原来的疏水织物(120.6°±5°)改性成亲水织物(72.6°±5°),且制备的Nylon-CMAs具有较好的耐湿热稳定性能。
