丛枝菌根真菌与根瘤菌对3种豆禾混播植物种间互作的影响
2021-05-07周冀琼闫艳红赵艳兰孙飞达
潘 越, 周冀琼, 郭 川, 杨 喆, 刘 琳, 闫艳红, 赵艳兰, 刘 珊, 孙飞达
(四川农业大学草业科技学院,四川成都 611130)
种植高产优质的多年生豆禾混播人工草地,不仅能够提高饲草产量或品质,而且可以改良培肥土壤,减少水土流失,促进草食畜牧业的发展。研究表明,豆禾混播组合中不同种类植物在形态、生长发育、营养资源利用、时空生态层位都存在着不同程度的生态位互补[1]。土壤微生物群落是影响植物群落生产力和群落结构的重要驱动因子之一[2-3]。丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)和根瘤菌是两类重要的土壤微生物,能与宿主植物产生共生关系,协助宿主植物获取生长所需的矿质营养[3-4]。目前已有大量研究探讨了气候变化、放牧干扰、土壤非生物因子对豆禾混播草地植物群落生产力、多样性和稳定性的影响及其作用机制[4],而关于地下微生物,特别是AMF和根瘤菌对豆禾混播植物群落种间关系的调控作用仍不明确[5]。
研究表明,宿主植物可识别土壤中有益的AMF,并将光合产物供给AMF;而AMF则可帮助宿主植物吸收土壤中的养分,尤其是移动性较差的矿质营养,从而形成一种双向奖励机制[6]。根瘤菌能侵染豆科植物形成根瘤进行生物固氮。AMF对豆科植物有较好的共生性能[5],促进豆科植物生长及根瘤固氮作用的发挥。豆科植物双接AMF和根瘤菌的优越性一般高于单接种:一方面,AMF可帮助植物高效利用水分并吸收磷素,弥补了根瘤菌固氮时的磷限制,且AMF可促进植物的光合作用,为土壤中的微生物提供更多的碳水化合物,促进根瘤菌固氮作用的发挥[7-8];另一方面,根瘤菌通过生物固氮可为AMF合成细胞壁的主要成分甲壳素提供氮素等必需元素,因此,豆科结瘤和丛枝菌根形成常被认为是存在相互协同作用的[9]。AMF和根瘤菌通过调节宿主植物对二者碳水化合物的分配,并改变彼此协助植物吸收养分的能力,对植物群落产生正向或反向的交互作用[10]。由于AMF和根瘤菌对宿主植物所供给的光合产物有较高的需求,且植物对AMF或根瘤菌的依赖性有所差异,使得这种互利共生关系在不同植物间表现不同。前人通过meta分析发现,AMF和根瘤菌双接种并未对宿主植物的生长产生显著的加和效应,主要受到环境养分、宿主植物的生长阶段等因素的影响[5,11]。土壤中较低的氮磷比有利于生长速率快的植物生长,这类植物往往具有发达的根系,或者自身具备生物固氮的潜能。当环境中氮磷比较高时,一些生长较慢的丛生型植物可以通过根系或者根部共生体——丛枝菌根汲取土壤中有限的磷[12]。除此之外,AMF和根瘤菌对植物群落的反馈调节作用还受到AMF或根瘤菌的种类,植物向地下输入的碳水化合物的含量,以及根际微生态的影响[13]。
白三叶(Trifoliumrepens)、多年生黑麦草(Loliumperenne)和鸭茅(Dactylisglomerata)是西南山地丘陵区常见的豆禾混播草种,可用于建立高产稳定的人工割草地及放牧草场。但是由于草种比例不当及后期管理缺失等原因,3种植物混播的人工草地常出现牧草生长不良、种间竞争激烈、草群结构稳定性差等问题。AMF、根瘤菌可直接影响豆科和禾本科牧草的养分循环及竞争过程[14],目前对于AMF-根瘤菌共生体的研究多集中在二者对单个物种生长及养分转移方面[15],而AMF和根瘤菌对豆禾混播群落生产力及种间关系的影响仍未见定论[16]。本试验通过对白三叶、多年生黑麦草、鸭茅构建的混播组合接种AMF和根瘤菌,探讨AMF和根瘤菌对豆禾混播植物生产力及种间关系的调控机理,以期为建立高产稳定豆禾混播草地及退化草地修复中有益微生物的应用提供科学依据和技术支撑。
1 材料与方法
1.1 试验设计
盆栽试验设在四川农业大学智能温室内,于2019年3月—2019年12月进行。采用三因素完全随机试验设计:因素一为播种方式,包括单播白三叶、单播鸭茅、单播多年生黑麦草和白三叶+鸭茅+多年生黑麦草混播4个水平;因素二为接种AMF,包括接种AMF处理(+AMF)和不接种AMF处理(-AMF);因素三为接种根瘤菌,包括接种根瘤菌处理(+R)以及不接种根瘤菌处理(-R)。由于接种根瘤菌处理对两种禾本科植物单播处理无意义,因此对于单播鸭茅和单播多年生黑麦草处理只做+AMF处理及-AMF处理。共12个处理,每个处理重复4次,共48盆。
1.2 试验材料
供试植物品种为‘海法’白三叶、‘凯力’多年生黑麦草、‘宝兴’鸭茅。
用未经灭菌的原位土砂混合基质作为接种AMF处理的接种菌剂。这种接种方式与灭菌后重新接种一种或多种AM真菌的接种方式可取得相似的接种效果[17-18],目前在AMF盆栽接种试验中得到广泛应用[19-21]。尽管用未经灭菌的土砂混合基质进行接种时无法很好的获知接种基质中AM真菌的具体种类,但是未经灭菌的土砂混合基质中包含多种AM真菌的菌丝及孢子,有利于宿主植物被常见的AM真菌种侵染定殖,而且收集的原位土壤更加接近田间土壤的物理及化学营养条件。为了确定原位土砂混合基质的接种潜力,取部分基质检测其中AMF孢子含量[22],得出每100 g未灭菌的土砂混合基质中约含87个AM孢子。
供试根瘤菌为白三叶根瘤菌ACCC18007,由中国农业科学院土壤肥料研究所提供。
土壤基质采于四川农业大学教学科研园区,地理坐标为103°39′ E,30°32′ N,海拔为508 m。该地属四川盆地亚热带湿润季风气候,年降水量1 012 mm,年均温15.9℃,1月均温5.4℃,≥0℃年积温5 830℃,年日照1 161 h,无霜期283 d。主要种植的植物有白三叶、多年生黑麦草、鸭茅等多年生豆禾混播牧草品种。
1.3 试验方法
1.3.1育苗 试供种子表面灭菌:将种子浸泡在5%的次氯酸钠1 min,再浸泡于50%的乙醇2 min,用蒸馏水反复冲洗干净后置于灭菌的蛭石上进行萌发培养。每隔2天浇一次水,确保水分充足。
1.3.2培养基质准备 土壤过2 mm的筛,去除石块及植物根茎残枝等。购买商用河砂,按土壤∶砂1∶3的比例混合均匀。将混合基质均分为两部分,一部分放在4℃冷库保存用于+AMF处理;另一部分土高压蒸汽灭菌(121℃)2 h后于无菌环境中冷却12 h,装入4 L花盆(21.5 cm直径×21.5 cm高)备用,每个花盆装有约6 kg土砂混合培养基质。混合基质的有机质含量为2.65%,全氮含量为2.1 g·kg-1,碱解氮含量为118 mg·kg-1,速效磷含量为9.3 mg·kg-1,速效钾含量为101 mg·kg-1,pH值为6.3。为避免污染,试验中花盆及工具等均需提前用肥皂水反复清洁,并在95%的乙醇中浸泡灭菌。
1.3.3接种AMF +AMF的处理为未经灭菌的土砂混合基质[23],-AMF的处理为蒸汽灭菌后的土砂混合基质加上除AMF外的其它土壤微生物的土壤滤液(滤液的提取方法:未灭菌的土壤和水按 1∶2混合,充分搅拌后过25 μm的筛)。研究表明,细菌等其他微生物体积较小,能通过25 μm的筛;而AMF孢子的体积大于25 μm。因此,滤液中包含除AMF孢子以外的其他大多数土壤微生物[24-25]。每个-AMF处理需要加入100 mL土壤滤液,每个+AMF处理的花盆中加入100 mL无菌水。
1.3.4接种根瘤菌剂 将白三叶根瘤菌ACCC18007接种到YMA斜面进行活化,然后在25℃条件下恒温培养3 d后转于装有1 000 mL YMA培养液的三角瓶中,振荡30 h,培养至对数生长期(OD600 nm= 0.812),离心浓缩并用无菌水重悬,配制成菌悬液(菌数>1×109CUF·mL-1)。每个+R处理的盆中接种100 mL根瘤菌剂,-R处理注射100 mL无菌水[26]。
1.3.5种苗移栽 种子播种约25 d后进行幼苗移栽。选取长势相同的1种植物6株均匀移栽在1个花盆里,作为单播处理;选取长势相同的3种植物各2株移栽于1个花盆,每盆中共6株,不同种植物间隔并分布均匀。移栽1周内及时观察幼苗生长情况,若出现植物死亡,则选取生长良好的同种植物进行替换。将花盆置于温室中,采用随机排列法,每2周换位1次,采用自然光照,温度为(20~30/15~25)℃(白天/晚上)。前期浇水2天1次,后期3天1次,确保水分充足。为了补充植物所需要的必需元素,且保证接种的AMF和根瘤菌能在低氮磷的土壤环境中充分发挥作用,移栽植物1个月后每周补充1次修正后低氮磷浓度的Hoagland培养液(Hoagland培养液配方:四水硝酸钙945 mg·L-1,硫酸钾505 mg·L-1,七水硫酸镁493 mg·L-1,铁盐溶液22.5 mg·L-1,微量元素液5.151 mg·L-1)[27]。
1.3.6指标测定及方法 生长季内,每10 d测量1次各植物自然高度。待植物生长至18周时收获所有植物。将每种植物从茎基部分开,分别将地上、地下两部分放置于105℃条件下杀青30 min,然后置于70℃烘干至恒重后测定地上、地下生物量。
用清水小心冲洗植物根系,注意保存根系和白三叶根瘤的完整性。用镊子将白三叶根系上的根瘤小心摘下,记录单株有效根瘤数(根瘤颜色呈现粉红色)及总根瘤数。
采用曲利苯兰染色法[28]测定菌根侵染率,镜检采用放大交叉法(magnified intersections method[29]),观察并记录根系的菌根侵染强度。菌丝强度由根部侵染的囊泡、菌丝及丛枝共同决定。
分别使用钼锑抗吸光光度法、凯氏定氮法来测定植物全磷、全氮含量[30]。
1.4 数据分析
用菌根依赖性(Mycorrhizal dependence,MD)表示在特定的土壤养分水平下植物生物量积累对菌根环境的依赖性[31]。MD计算公式为:MD(%)=100×(BA-BNA)/BA(BA表示接种AMF后植物的生物量,BNA表示不接种AMF时植物的生物量;MD越大表示宿主植物对AMF的依赖程度越高)。用软件SPSS 22.0(Statistical Product and Service Solutions;Watson;NC;USA)分析数据。采用三因素方差分析播种方式、接种AMF、接种根瘤菌以及三者的交互作用对白三叶株高、生物量、根瘤数、相对生物量、根冠比、AMF菌根侵染率、植物N,P吸收的影响;采用两因素方差分析播种方式、接种AMF以及二者的交互作用对多年生黑麦草和鸭茅株高、生物量、根冠比、AMF菌根侵染率、植物N,P吸收的影响。用Spearman相关分析检验各物种根系侵染率与地上生物量及地上部分养分含量的相关性。采用Sigmaplot 12.0和Excel 2010制作相关图表。
2 结果与分析
无论是单播还是混播组合,接种AMF和根瘤菌均在不同程度影响了3种植物的株高、地上和地下生物量、根冠比、菌根侵染率及植物地上部的氮磷含量(表1)。
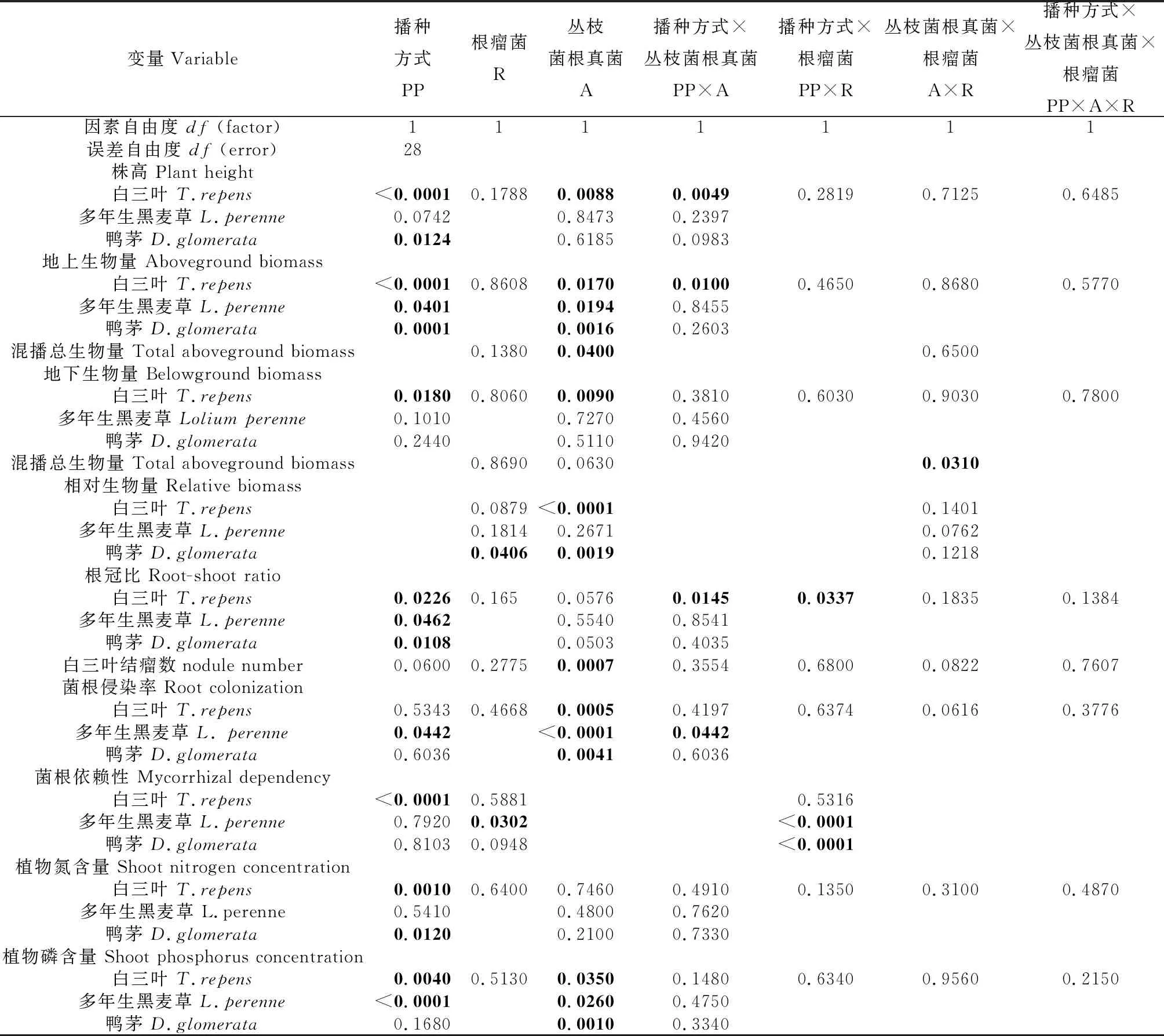
表1 不同播种方式(PP)、AMF(A)及根瘤菌(R)接种及交互作用对3种植物的株高和生物量、白三叶结瘤、相对生物量、根冠比、菌根侵染率、菌根依赖性、植物地上部分的氮、磷含量的方差分析结果
2.1 不同播种方式下接种AMF和根瘤菌对植物株高的影响
白三叶的株高在混播处理中显著低于单播处理(P<0.05);相比-AMF处理,+AMF显著增加了混播中白三叶的株高(P<0.05),平均增加8.4 cm;根瘤菌接种对白三叶的株高未产生显著影响。鸭茅在混播中的株高显著高于单播处理,接种AMF未对鸭茅株高产生显著性影响。多年生黑麦草的株高在所有处理中均无显著差异(图1b)。

图1 不同播种方式下接种AMF和根瘤菌对(a)白三叶、(b)多年生黑麦草、(c)鸭茅株高的影响
2.2 不同播种方式下接种AMF和根瘤菌对植物生物量的影响
2.2.1地上、地下生物量 在混播处理中,白三叶的地上、地下生物量均显著低于单播处理(P<0.001),而鸭茅的地上生物量显著高于单播处理;相比-AMF对照,+AMF显著增加了混播中白三叶的地上生物量(P<0.001),单播+AMF-R处理中白三叶地下生物量最高,达到0.83 g·株-1,在混播中,+AMF+R处理中的白三叶地下生物量要显著高于其他混播接种处理,达到0.56 g·株-1;混播中多年生黑麦草(P<0.05)和鸭茅(P<0.01)的地上生物量在+AMF处理下显著低于-AMF处理,但这2种禾草的地下生物量均未受到播种方式、接种AMF或接种根瘤菌的显著性影响;此外,混播处理中,+AMF的植物总地上生物量显著低于-AMF处理(P<0.05);接种根瘤菌对3种植物的总地上生物量无显著影响,但接种AMF和根瘤菌对地下生物量有交互作用(图2)。

图2 不同播种方式下接种AMF和根瘤菌对(a)白三叶、(b)多年生黑麦草、(c)鸭茅的地上、地下生物量以及(d)群落总地上、地下生物量的影响
2.2.2相对生物量 无论是否接种AMF,鸭茅在混播处理下均为优势物种,其相对生物量超过50%,多年生黑麦草次之,白三叶的相对生物量最小。相比-AMF处理,+AMF显著增加了白三叶在群落中的相对生物量(P<0.05),但降低了鸭茅的相对生物量;此外,+R处理中鸭茅的相对生物量显著高于-R处理(P<0.05)(图3)。
2.2.3根冠比 相比单播处理,混播处理显著增加了白三叶的根冠比(P<0.05),但是降低了多年生黑麦草和鸭茅的根冠比(表1和表2);混播+R处理中白三叶的根冠比达到最高。单播处理中,+AMF处理中鸭茅的根冠比最高(表2)。
2.3 不同播种方式下接种AMF和根瘤菌对白三叶结瘤数的影响
无论单播或是混播,+AMF+R处理中白三叶的根系结瘤数均为最高,平均结瘤数为63 个·株-1,而-AMF-R处理中白三叶的根系结瘤数平均仅为17个·株-1(图4)。
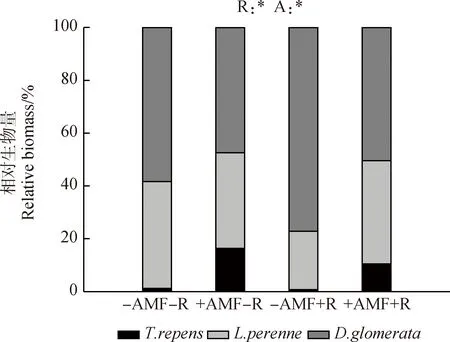
图3 混播条件中不同接种方式对白三叶、多年生黑麦草及鸭茅的相对生物量的影响

表2 不同播种方式下接种AMF及根瘤菌对3种植物根冠比的影响
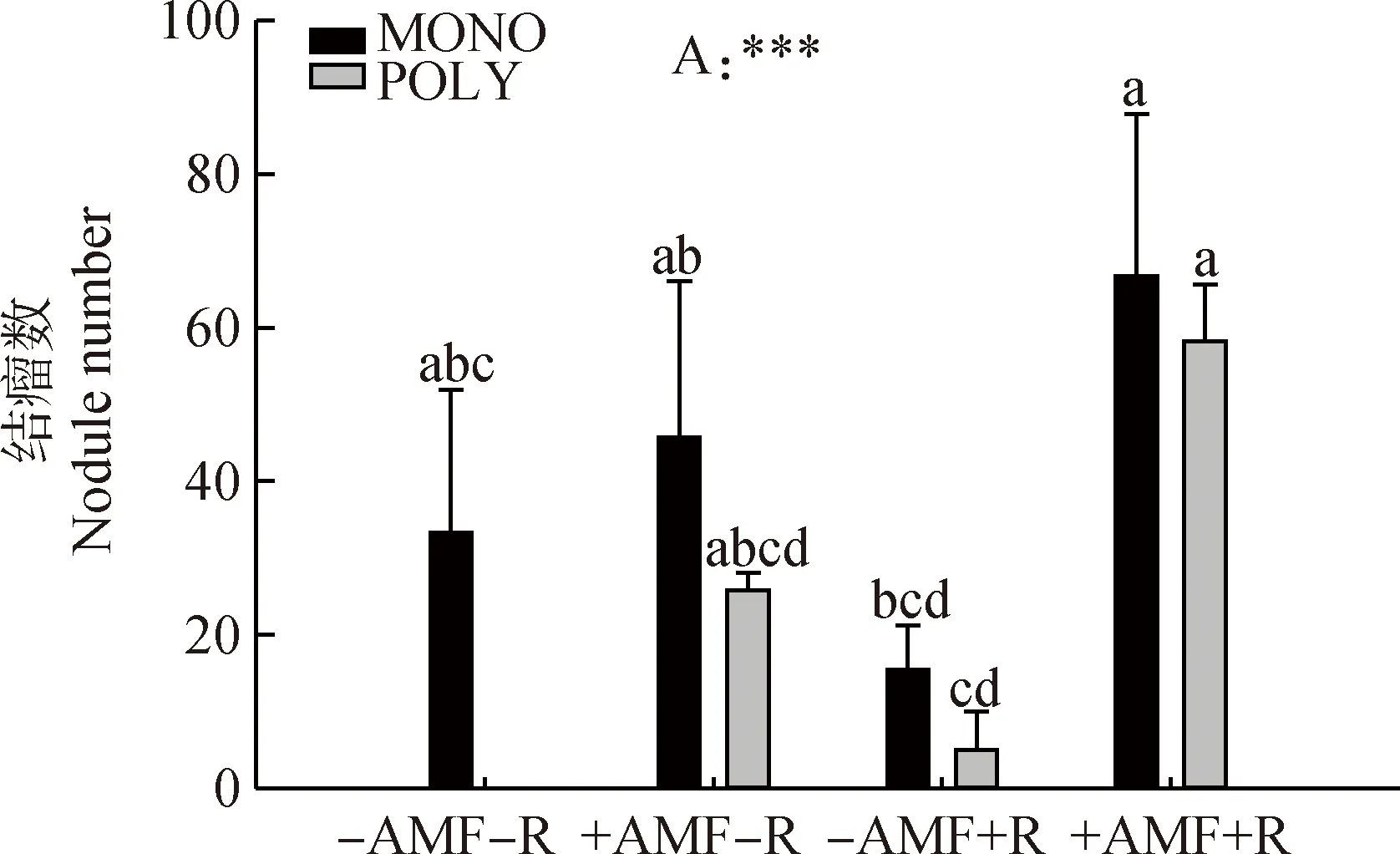
图4 不同播种方式下接种AMF和根瘤菌对白三叶结瘤数的影响
2.4 不同播种方式下接种AMF和根瘤菌对菌根侵染的影响
2.4.1菌根侵染率 多年生黑麦草的菌根侵染率在混播处理中明显高于单播处理(P<0.05),鸭茅和白三叶的菌根侵染率在不同的播种方式下无显著差异。
与-AMF处理相比,+AMF均显著提高了3种植物的菌根侵染率(图5)。
2.4.2菌根依赖性 相比单播处理,白三叶的菌根依赖性在混播处理中显著提高(F=454.65,P<0.001),而多年生黑麦草和鸭茅的菌根依赖性在单播混播中无显著差异。与-R处理相比,+R显著提高单播处理中白三叶的菌根依赖性(P<0.001)和混播处理中多年生黑麦草的菌根依赖性(P<0.05)(表3)。
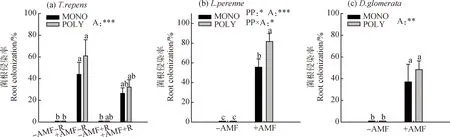
图5 不同播种方式下接种AMF和根瘤菌对(a)白三叶、(b)多年生黑麦草和(c)鸭茅菌根侵染率的影响

表3 不同播种方式及根瘤菌接种下白三叶、多年生黑麦草和鸭茅的菌根依赖性
2.5 不同播种方式下接种AMF和根瘤菌对植物地上部氮磷含量的影响
相比单播处理,混播中白三叶(P<0.05)和鸭茅(P<0.001)的地上部分氮含量显著降低,但是接种AMF或根瘤菌对3种植物地上部的氮含量均无显著影响(表1和图6)。
混播中的白三叶和多年生黑麦草的地上部分磷含量显著低于单播处理(P<0.05),但是接种AMF后,3种植物地上部磷含量显著高于不接种的对照(P<0.05)(表1和图7)。
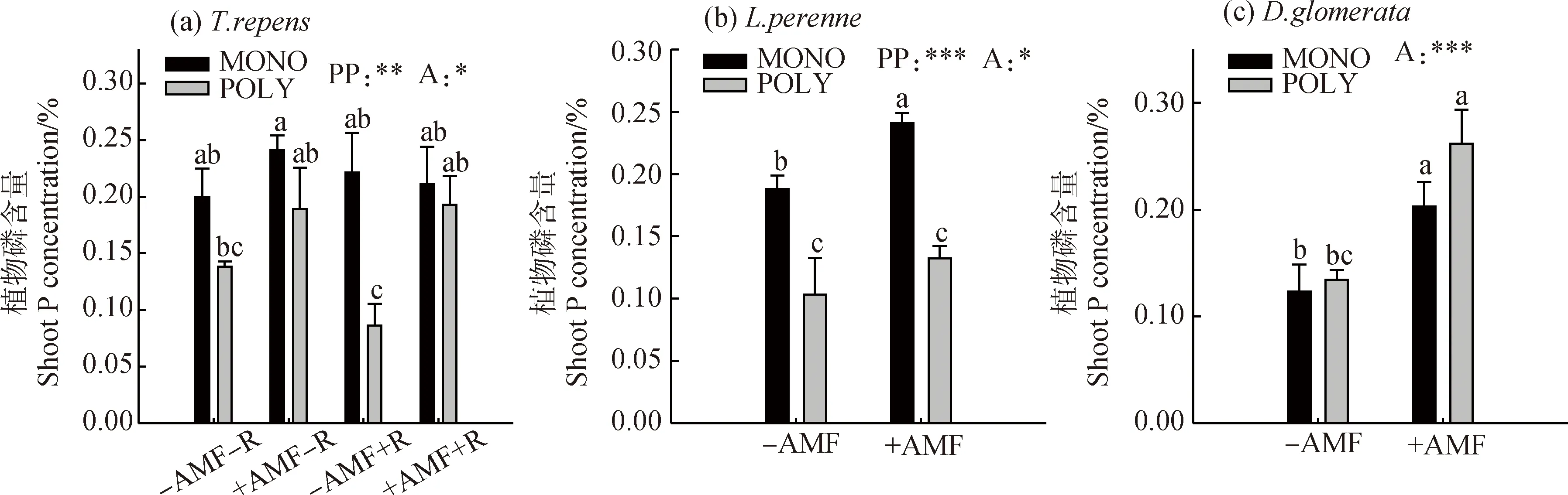
图7 不同播种方式下接种AMF和根瘤菌对(a)白三叶、(b)多年生黑麦草和(c)鸭茅的植物磷的影响
2.6 菌根侵染率与生物量及地上部P含量的关系
白三叶的菌根侵染率与其地下生物量有显著正相关关系(图8a),而2种禾草的菌根侵染率与其地上、地下生物量均无显著相关性。另外,鸭茅的菌根侵染率与其地上部的磷含量呈显著正相关关系(图8b),但白三叶与多年生黑麦草的根系菌根侵染率与各自地上部分氮、磷含量均无显著相关性。
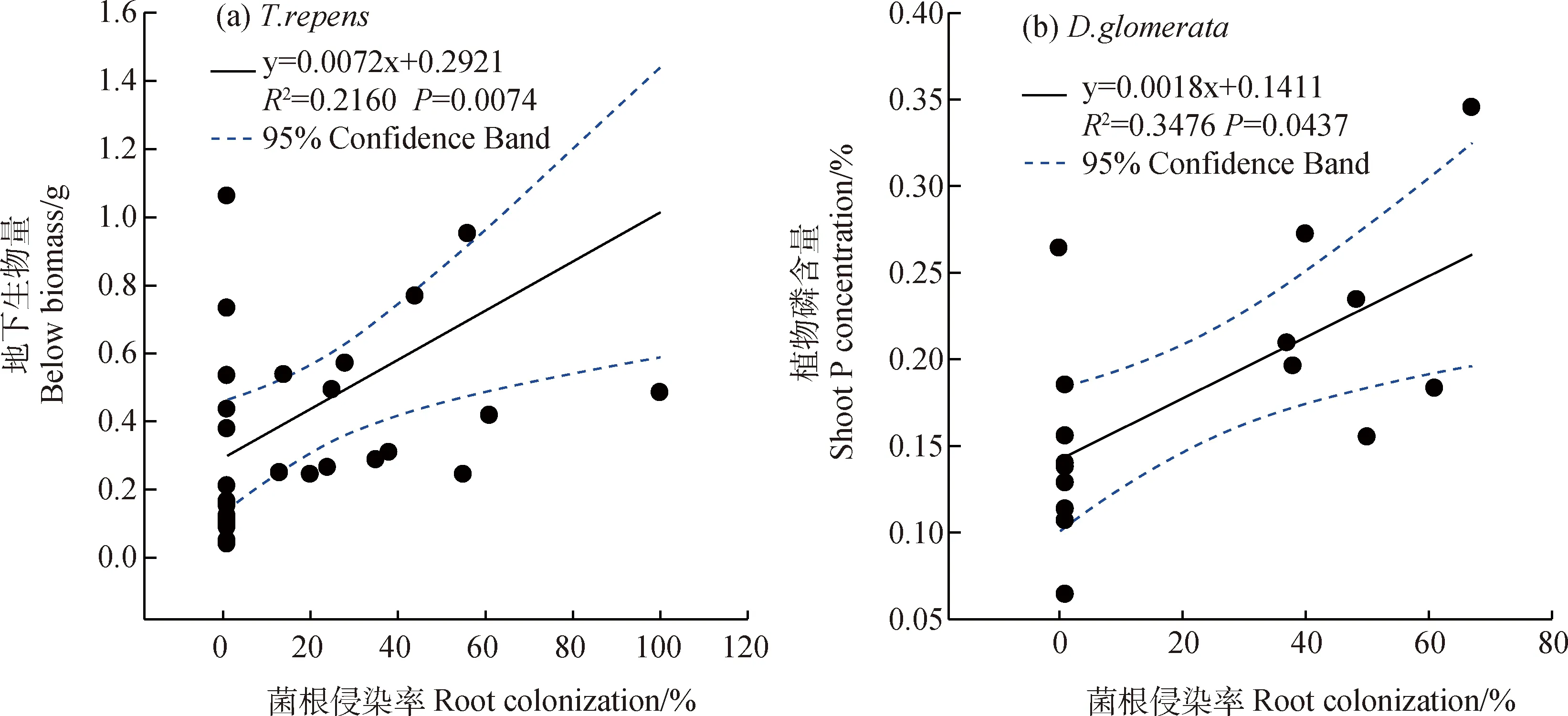
图8 (a)白三叶根部菌根侵染率与地下生物量的关系;(b)鸭茅根部菌根侵染率与地上部磷含量的相关性
3 讨论
3.1 AMF-根瘤菌对豆禾混播植物生长及种间关系的影响
本研究结果表明,3种植物混播时,白三叶的株高及地上地下生物量与单播相比显著降低,但多年生黑麦草和鸭茅的株高及地上生物量与各自的单播对照相比显著增加,这说明相比多年生黑麦草和鸭茅,白三叶在混播中处于竞争弱势。但是,在混播中接种AMF之后,白三叶的株高及生物量大幅增加,而鸭茅和多年生黑麦草在群落中的比例显著降低,说明接种AMF在3种植物混播时有助于增加白三叶的竞争力,对混播草地种间关系的调节起到非常关键的作用。无论单播还是混播,接种AMF均能与3种植物形成共生体。一定水平的氮可以促进AMF对寄主植物根系的侵染[32],混播中白三叶通过固氮增加土壤中可利用的氮含量,使AMF在混播群落中发挥更大的作用。由于AMF与宿主植物之间存在一定的宿主偏好性[33],导致在种植不同植物的土壤中AMF群落组成和数量存在差异,并进一步影响该种或者共存植物的生长,从而影响植物种间的相互作用[34-36]。前人研究表明,当草地群落中的优势种为菌根依赖性较低的植物时,AMF的存在显著增加了菌根依赖性强的亚优势物种生长[37]。本研究结果与其一致,无论是否接种AMF,混播组中鸭茅均为优势种,但接种AMF使鸭茅的相对生物量显著降低,白三叶所占比例显著提升。菌根依赖性的结果表明,白三叶的菌根依赖性最高,多年生黑麦草次之,鸭茅的菌根依赖性最弱,所以AMF可以调节3个物种种间关系。AMF的存在使得优势种与亚优势种的竞争关系趋于缓和,进而达到使群落内各物种生物量趋于均匀的效果,有利于混播草地群落的长期维持[38]。通常情况下,禾草对于土壤中养分及资源的竞争能力比豆科植物强,因此混播群落中的豆科植物会通过更强的AMF依赖性突破其养分需求的限制[39-40]。接种AMF增加了鸭茅的根冠比,调节了鸭茅体内碳从库到源的流通分配过程。AMF对白三叶、多年生黑麦草的根冠比无显著影响,主要因为根冠比受多种因素调控,如土壤水分、光照、矿质营养等原因[41]。在混播草地中,接种根瘤菌不仅对豆科植物的氮吸收具有重要意义,非豆科植物亦可通过其根系分泌物、根外菌丝网络以及豆科植物腐烂的根系等途径获得豆科植物与根瘤菌共生所固定的氮[42-43]。根瘤菌在提高白三叶生物固氮的同时,提高了土壤中的可利用氮素,从而促进了多年生黑麦草和鸭茅的生长,有利于AMF对多年生黑麦草、鸭茅养分吸收的正向促进作用。本试验中,接种根瘤菌显著提高了白三叶的根冠比,但对白三叶的其他生长结瘤指标无显著影响,而双接种AMF和根瘤菌处理中,白三叶地下生物量及根部结瘤数均显著高于其他接种处理。前人的研究表明,根瘤菌与豆科植物共生固氮是由根瘤菌菌株、寄主植株和环境条件共同调控的[44],由于根瘤菌在土壤环境中的扩散较差[45],而AMF产生的菌丝体可以协助根瘤菌转移到根际,从而与宿主豆科形成根瘤[46]。此外,AMF和根瘤菌在信号传导过程中存在着密切的联系,在丛枝菌根共生体形成过程中释放的一些信号物质是促进根瘤菌共生的关键结瘤因子,也是双接种能显著促进白三叶根系结瘤固氮的主要原因[47]。
3.2 AMF-根瘤菌对豆禾混播植物养分吸收的影响
混播中的白三叶和多年生黑麦草的地上部分磷含量显著低于单播处理,但是接种AMF后,3种植物地上部磷含量显著高于不接种的对照。由此可知,AMF可通过促进植物在群落中的养分吸收来调节植物种间关系。AMF可在低氮环境下促进植物对磷的吸收,与单播处理相比较,混播处理使白三叶和多年生黑麦草的植物磷含量显著降低,主要是由较强的种间竞争引起混播物种间的养分不平衡性导致的,但是接种AMF缓解了这种竞争排除。一方面,接种AMF提升了植物根际土壤中的磷酸酶活性,增加了土壤中可利用磷含量,从而促进宿主植物对磷元素的吸收;另一方面,混播群落中的不同物种可通过土壤中的菌丝网络进行养分传输,实现物种间养分利用的平衡[48-50]。尽管差异不显著,接种AMF增加了白三叶地上部分的氮含量,主要是因为AMF可为白三叶的结瘤固氮提供更多的磷元素,解除了豆科生长的磷限制。白三叶在混播组合中可将固氮的氮传递给相邻禾草,从而增加了禾草的可吸收氮素。
4 结论
本研究表明,接种AMF和根瘤菌对白三叶、多年生黑麦草和鸭茅的生长及种间关系有重要的调节作用。与未接种对照相比,接种AMF显著促进了混播中白三叶的生长和结瘤数量,缓解了优势物种鸭茅对白三叶、多年生黑麦草的竞争排除。同时接种AMF和根瘤菌为白三叶根部结瘤固氮创造有利的条件,而AMF的存在进一步降低混播植物间的种间竞争强度,对混播草地豆禾生产力及稳定性的维持起到显著的作用。
