低温干旱环境对紫花苜蓿根颈耐寒性的影响
2021-05-07徐洪雨甄莉丽李钰莹董宽虎李向林
徐洪雨, 甄莉丽, 李钰莹, 董宽虎, 李向林
(1. 山西农业大学草业学院, 山西 太谷 030801;2. 对外经济贸易大学外语学院, 北京 100029;3. 中国农业科学院北京畜牧兽医研究所, 北京100193)
紫花苜蓿(MedicagosativaL.,以下简称苜蓿)是一种蛋白含量丰富的优质饲草,其在我国的种植面积不断扩大,且主要集中在内蒙古、甘肃和新疆等北方地区[1]。我国北方冬季寒冷少雪,因此苜蓿越冬失败、不能正常返青时有发生,给生产上造成了严重的经济损失。在管理措施中,有研究表明浇灌越冬水可提高苜蓿的越冬能力[2]。秋冬季节,气温和地面温度不断下降,并一直向地下传递。当气温下降至冻结温度后,地下土壤剖面就会形成深度逐渐增加的冻土层。在形成的冻土层中,上层土壤剖面(约20~40 cm)的温度与地面温度具有很好的相关性,但因温度波向地下传递需要一定的时间,上层土壤剖面的温度与地面温度相比仍存在很大的滞后性[3]。另外,土壤冻结后,土壤孔隙被冰完全充填,冻土层可阻隔大气与土壤空气的热交换[3]。因此,在苜蓿整个越冬过程中,土壤冻土层能够缓解低温和温度剧烈变化对根颈和根系的伤害[4-5]。但北方地区(如内蒙古阿鲁科尔沁旗和甘肃等地)多为沙性土,沙性土保水能力差,浇灌越冬水时水分快速下渗,加上蒸发和空气循环等因素导致表层土壤水分丢失严重,使越冬期间表土层内水分含量低,难以形成冻土层。此种情况下,越冬水并不能对苜蓿根颈和根系起到很好的保护作用。2019年2月,对中国农业科学院国际农业高新技术产业园(河北,廊坊)内‘WL440HQ’苜蓿的越冬情况调查时发现,当月平均气温-6℃,0~10 cm表土层范围内的土壤(沙质土)含水量仅约田间持水量的20%~30%,土壤松散,苜蓿根颈失水严重,存在萎缩现象(图1-A),经多样点测定,根颈组织细胞液相对渗透率达到81.7%~89.6%。2019年4月,再次对产业园内的苜蓿进行调查,当月平均气温已达8℃,苜蓿返青率不足10%,原2月份调查时失水萎缩的根颈绝大部分已发生霉变(图1-B)。冬季寒冷和土壤干旱共同组成低温干旱环境,此种不利的环境条件可能是导致苜蓿无法顺利越冬的原因之一。

图1 紫花苜蓿越冬期间根颈萎蔫及返青期根颈霉变的情况
在低温胁迫下,植物细胞膜发生龟裂,透性增大,当细胞液相对渗透率达到50%时所对应的温度称为低温半致死温度(LT50),常用来衡量植物的耐寒性[6-8]。根颈靠近地表,是苜蓿返青时新枝条的生长点,因此根颈也被认为是苜蓿最重要的越冬组织[9],常用根颈的LT50来衡量苜蓿的耐寒性。有研究认为,脯氨酸不仅可防止细胞膜脱水,而且具有稳定蛋白质的作用,是影响苜蓿抗寒性的主要氨基酸[10]。在低温胁迫初期,苜蓿通过冷适应积累物质以提高自身的抗寒能力,其中可溶性糖是对低温条件反应较为敏感的物质[11]。可溶性糖不仅具有渗透调节的作用,还具有冷冻保护的作用[12-13]。此外,苜蓿的耐寒性还与冷适应期间低温诱导可溶性蛋白的积累有关,如脱水蛋白和营养贮藏蛋白[14]。可溶性蛋白可与细胞成分形成氢键从而结合水分,发挥冷冻保护剂的作用[10,15]。有研究表明,K-3脱水蛋白的转录水平在冷适应过程中显著提高,并且在苜蓿抗寒性的轮回选择性育种中,该基因在苜蓿群体中正等位基因的频率也会增加[14]。低温导致细胞脱水时,K3脱水蛋白在维持细胞膜的完整性中发挥着重要作用[16-17],与苜蓿的耐寒性息息相关[18]。
为研究冬季冷冻期土壤干旱对苜蓿越冬的影响,本研究在实验室内通过培养箱控温和更换表土试验,模拟苜蓿越冬过程中的低温干旱环境,借助根颈组织细胞膜透性、低温半致死温度、细胞活力和丙二醛等指标,分析低温干旱环境对不同秋眠级苜蓿根颈耐寒性的影响,并通过根颈组织含水量、脯氨酸、可溶性糖和可溶性蛋白等胁迫抗逆标志物含量,分析低温干旱环境对苜蓿耐寒性影响的原因。本研究结果将为研究如何通过管理措施提高苜蓿越冬能力提供参考。
1 材料与方法
1.1 试验材料
本试验选择的苜蓿品种为‘WL440HQ’(秋眠级6.0,WL)和‘肇东’(秋眠级2.0,ZD),ZD种子购买于甘肃大业牧草科技有限责任公司,WL苜蓿种子购买于北京正道生态科技有限公司。试验共涉及3个处理阶段,2种水分处理,4次生物学重复。
试验所用的苜蓿苗在中国农业科学院国际农业高新技术产业园区进行培育,园区位于河北省廊坊市万庄镇,占地约1 330 ha,全年光照充足,年平均气温11.9℃,年平均降水量为554.9 mm,土壤为沙质土,田间持水量为0.203 3 g·g-1(水/干土)。2018年5月育苗,2019年5月在培育好的材料中选取根系大小相近的2个品种苜蓿苗,而后移栽到预先准备好的PVC管(直径10 cm,高度15 cm)内,管内填充育苗田里的沙质土壤。将移栽好的苜蓿苗带回培养室内进行为期1个月的恢复生长,PVC管内的土壤含水量通过称重法维持在田间持水量的75%。进行恢复生长期间,培养室内的其它条件设置为:温度(24±2)/(20±2)℃(昼/夜),光照时长12 h,光照强度600~800 μmol·m-2·s-1。
1.2 试验处理及取样
本研究的试验处理过程如图2所示,具体处理细节如下所述:
(1)适应性生长。苜蓿苗在培养室恢复生长1个月后,将苗转移到低温光照培养箱(LRH-200-GD,THK Ltd.,广东)内进行适应性生长1周。培养箱内的条件控制:24/20℃(昼/夜)、光照12 h和光照强度400 μmol·m-2·s-1。
(2)冷适应处理(阶段1)。适应性生长1周结束后,降低培养箱温度对苜蓿苗进行冷适应处理。将培养箱温度设置从24/20℃(昼/夜)降低到4/0℃(昼/夜),光照条件不变,冷适应处理1周。此处理阶段不涉及控水处理,土壤含水量保持75%田间持水量。冷适应处理结束后,剪掉所有苜蓿地上部,烘干称重测定含水量和地上部干重。每个品种随机选取4管(Sampling 1,S1),剪掉地上部,烘干称重测定含水量及干重;将地下部洗净吸干,称取湿重,然后将根颈和根系分开,根系烘干并计算地下部含水量,根据含水量及地下部总鲜重,计算地下部总干重;根颈部位用于测定冷适应处理后苜蓿根颈的细胞液相对渗透率、LT50和细胞活力的大小以及丙二醛、脯氨酸、总可溶性糖和总可溶性蛋白的含量。此阶段2个品种的试验处理样品分别标记为WL-1-B和ZD-1-B。
(3)剪掉地上部和更换表层土壤。在冷冻处理之前,剪掉地上部,模拟苜蓿越冬期地上部枯黄。将阶段1取样后每个品种剩余的样品分别随机分成2份,其中1份用烘干的陶粒(直径1 mm)替换表层5 cm范围内的表土,模拟越冬期土壤干旱条件,另外1份保持原土壤及75%田间持水量的含水量不变。
(4)冷冻处理(阶段2和阶段3)。剪掉地上部和更换表层土壤后,关闭培养箱光照(地上部已剪掉,光合作用停止),将培养箱温度设置从4/0℃(昼/夜)降低到-2℃(夜),对苜蓿进行冷冻处理,以模拟北方苜蓿越冬。在冷冻处理5天后(Sampling 2,S2)和7天后(Sampling 3,S3)分别取样一次,地下部样品的处理参考冷适应阶段取样。在阶段2和阶段3处理后,未更换表层土壤的2个苜蓿品种样品冷冻处理后分别标记为WL-2-B,WL-3-B,ZD-2-B和ZD-3-B,而更换表层土壤的2个苜蓿品种样品冷冻处理后分别标记为WL-2-K,WL-3-K,ZD-2-K和ZD-3-K。

图2 试验过程示意图
1.3 试验指标的测定
(1)细胞液相对渗透率和LT50的测定
本研究采用细胞液相对渗透率和LT50作为判断各处理间根颈耐寒性的主要依据。受低温胁迫,细胞膜受到破坏,细胞液渗透增加,通过组织细胞电导率计算细胞液相对渗透率。具体计算公式如下:
相对渗透率(%)=(EL1-EL)/(EL2-EL)×100
(1)
式(1)中EL1为试验处理后根颈样品的电导率;EL2为经高压灭菌锅蒸煮后根颈样品的电导率,代表细胞完全破裂、细胞液完全渗出式样品的电导率;EL为浸泡根颈样品所用蒸馏水的电导率。
LT50的测定原理是对样品进行不同温度的冷冻,并测定每一冷冻温度下的细胞液相对渗透率,再根据Logistic方程计算出细胞液相对渗透率为50%所对应温度即为LT50。试验处理后,苜蓿根颈组织LT50的测定及计算方法参考徐洪雨[19-20]的方法。本研究测定根颈组织LT50时,对样品进行冷冻的温度设置9个梯度,分别为-2℃,-4℃,-6℃,-8℃,-10℃,-12℃,-14℃,-16℃和-18℃。
(2)细胞活力的测定
根颈细胞活力的测定参考王学奎[21]测定植物根系细胞活性的方法。
(3)丙二醛、脯氨酸、总可溶性糖和总可溶性蛋白的测定
参考Catola[22]和Nemat[23]的方法提取样品,参考Draper[24],Troll[25],Yemm[26]和Sedmak[27]的方法分别对丙二醛、脯氨酸、总可溶性糖和总可溶性蛋白的含量进行测定。
1.4 数据分析
采用最小显著差数法(LSD),对试验各阶段间指标变化的差异显著性以及同一阶段处理间比较的差异显著性进行分析,差异显著标准为P<0.05。
根据根颈组织的LT50、细胞液相对渗透率、细胞活力、含水量、干物质量以及丙二醛、脯氨酸、总可溶性糖和总可溶性蛋白的含量,采用隶属函数法对2个品种苜蓿在整个试验期间的表现进行综合评价。
2 结果与分析
2.1 低温干旱环境对苜蓿耐寒性的影响分析
2.1.1细胞液相对渗透率和低温半致死温度大小 图3-A为试验期间苜蓿根颈细胞液相对渗透率的变化情况,其大小可表征细胞膜的透性。除WL-K外,WL-B,ZD-B和ZD-K样本的根颈在试验期间细胞液相对渗透率无显著性变化。经过阶段2的冷冻,WL-K样本的根颈细胞液相对渗透率明显提高,其值达到62.26%;经过阶段3的冷冻,其值达到66.99%。据此判断,低温干旱环境对WL苜蓿根颈的影响极其显著,导致细胞液相对渗透率超过50%,即意味着细胞死亡,但此环境对ZD苜蓿根颈的影响并不显著。

图3 试验期间根颈细胞膜透性和低温半致死温度
图3-B为试验期间WL-B,ZD-B和ZD-K样本根颈的LT50的变化。经过阶段2的冷冻,ZD-B和ZD-K中根颈的LT50均有明显降低。经过阶段3的冷冻后,ZD-K和ZD-B中根颈的LT50显著低于WL-B中根颈的(P<0.05),但在ZD-K和ZD-B样本间根颈LT50的大小并无显著性差异。对于WL苜蓿而言,冷冻处理已使WL-K中的根颈致死,其LT50大小远远高于WL-B中根颈的LT50大小。综上,本研究中更换表土后的土壤干旱严重影响了WL苜蓿在零下低温环境中的耐寒性,但对ZD苜蓿并无显著性影响。
2.1.2细胞活力大小 图4为试验期间苜蓿根颈细胞活力的变化情况。冷适应结束后,ZD-B中根颈的细胞活力显著高于WL-B中根颈的(P<0.05)。而经过阶段2和阶段3的冷冻,4个样本中根颈的细胞活力均有所下降。在取样点S2和S3,根颈细胞活力的大小在样本间的比较为:ZD-B>ZD-K>WL-B> WL-K(P<0.05)。由此可见,经过冷适应和冷冻处理后,ZD苜蓿根颈的细胞活力大于WL苜蓿的,不控水处理的根颈细胞活力大于控水处理的。

图4 试验期间苜蓿根颈细胞活力
2.1.3丙二醛含量 图5为试验期间苜蓿根颈细胞内丙二醛的含量变化。由图可知,经过冷适应处理后,WL-B根颈中的丙二醛含量显著高于ZD-B根颈中的(P<0.05)。经过冷冻后,4个样本根颈中的丙二醛含量均有所增加,其中WL-K根颈中的丙二醛含量在阶段2增加最明显。经过冷冻后,在取样点S2和S3,WL-B和WL-K根颈中的丙二醛含量仍高于ZD-B和ZD-K根颈中的;WL-K根颈中的丙二醛含量显著高于WL-B根颈中的(P<0.05);对于ZD苜蓿,根颈中的丙二醛含量在ZD-B和ZD-K样本间并无显著性差异。根据试验样本根颈内的丙二醛含量变化判断,低温干旱环境对WL苜蓿的影响较大,而对ZD苜蓿影响不明显。

图5 试验期间苜蓿根颈丙二醛含量
2.2 低温干旱环境对苜蓿耐寒性影响的原因分析
2.2.1地上部和地下部干物质量 图6为试验期间苜蓿单株的地上部和地下部干物质量,目的是为评估试验期间苜蓿生长可能对根颈耐寒性的影响。在本研究中,冷适应处理结束后剪掉所有苜蓿的地上部并测定其干物质量,WL-B和ZD-B样本地上部干物质量分别为0.51 g·株-1和0.57 g·株-1,且平均单株地上部干物质量在2个样本间并无显著性差异(图6-A)。从图6-B中还可看出,4个样本中苜蓿地下部干物质量在同一取样点均无显著性差异。
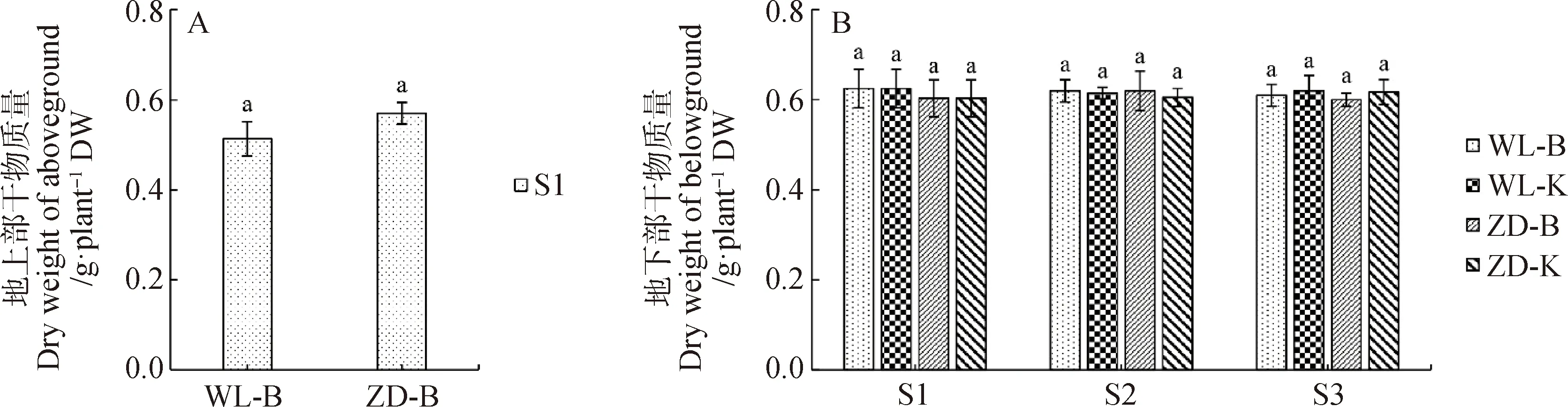
图6 试验期间苜蓿单株地上部和地下部干物质量
2.2.2组织含水量 冷冻试验结束后,WL-K中的根颈出现萎缩,而其它3个处理中的根颈无萎缩表现。图7为试验期间地上部和地下部组织(根颈和根系)含水量的变化情况。由图7-A可知,冷适应结束后,WL地上部的含水量为74.38%,ZD苜蓿的为71.25%,2个品种苜蓿地上部组织含水量与土壤含水量相近。由图7-B可知,在更换表层土壤进行冻干处理之前,2个品种苜蓿地下部含水量基本保持在75%左右;经过阶段2冷冻处理后,WL-B和ZD-B中地下部组织含水量无明显变化,而WL-K和ZD-K中的均显著降低。在阶段2和阶段3期间,WL-K中根系的失水速率分别为3.48 %·d-1和5.0 %·d-1,2个阶段的平均失水速率为3.91 %·d-1;而ZD-K中根系失水速率分别为1.52 %·d-1和2.5 %·d-1,2个阶段的平均失水速率为1.80 %·d-1。因此,WL-K中根系失水速率较ZD-K中的快。

图7 试验期间苜蓿地上部和地下部的含水量
2.2.3脯氨酸、总可溶性糖和总可溶性蛋白的含量 图8为试验期间根颈细胞内脯氨酸、总可溶性糖和可溶性蛋白含量的变化情况。与S1处样本根颈内的脯氨酸含量相比,经过阶段2和3的冷冻,4个样本根颈中的脯氨酸含量均明显下降。在取样点S2和S3处,ZD-B和ZD-K根颈中的脯氨酸含量显著高于WL-B和WL-K样本根颈中的(P<0.05)。在S2点,对于WL苜蓿来说,WL-K样本根颈中的脯氨酸含量显著高于WL-B样本根颈中的(P<0.05);但对于ZD苜蓿来说,根颈内的脯氨酸含量在ZD-B和ZD-K样本间却无显著性差异(图8-A)。在S3点,对于同一品种苜蓿,根颈内的脯氨酸含量在控水与不控水处理下的样本间(WL-K和WL-B;ZD-K和ZD-B)均无显著性差异(图8-A)。从可溶性糖的含量来看(图8-B),在同一取样点,ZD-B样本根颈中的可溶性糖含量显著高于WL-B样本根颈中的(P<0.05),ZD-K中的显著高于WL-K中的(P<0.05)。对于ZD苜蓿而言,根颈中的可溶性糖含量在ZD-B和ZD-K样本间无显著性差异;而对于WL苜蓿,WL-B样本根颈中的可溶性糖含量显著高于WL-K样本根颈中的(P<0.05)(图8-B)。对于根颈细胞内的可溶性蛋白含量,在S2点处,ZD-B中的显著高于WL-B中的(P<0.05);在S3点处,ZD-B中的显著高于WL-B中的(P<0.05),ZD-K中的的显著高于WL-K中的(P<0.05)。对于同一品种苜蓿,根颈中可溶性蛋白含量在ZD-B和ZD-K样本间无显著性差异,在WL-B和WL-K样本间也无显著性差异(图8-C)。

图8 试验期间苜蓿根颈组织中脯氨酸、总可溶性糖和总可溶性蛋白含量
2.3 综合评价
采用隶属函数法对2个品种苜蓿在整个试验期间的表现进行综合评价,评价结果见表1。根据多指标的综合评价,结果显示,排名前5位的全部为ZD苜蓿,而排名后5位的全部为WL苜蓿。在整个低温干旱试验中,ZD苜蓿的表现完全优于WL苜蓿,这与单纯根据LT50和细胞液相对渗透率等指标所比较的结果相一致。
3 讨论
本试验结果表明,WL苜蓿受低温干旱环境的影响远大于ZD苜蓿,试验中更换表土使土壤干旱的处理严重影响了WL苜蓿应对低温冷冻的能力,本研究结果与过去的研究结果保持一致。针对冬季土壤干旱可能对苜蓿越冬造成不良的影响,生产者常通过浇灌越冬水来提高苜蓿的抗寒越冬能力[2],其原因是土壤冻土层能够缓解温度剧烈变化对根颈和根系的伤害[4-5]。土壤剖面的温度滞后于空气的温度,且土壤冻结后孔隙被冰完全填充,冻土层阻隔了大气与土壤空气的热交换[3]。但即使秋末冬初已浇灌越冬水,因某些因素的影响(如浇灌越冬水的时节过早、灌水时土壤(沙质土)渗水过快或土壤蒸发,等等),导致越冬期间地表含水量过低,不能形成冻土层,从而影响苜蓿根颈应对低温冷冻的能力。因此,根据本研究结果,建议越冬期间对地表土壤水分状况进行监测,适时补充土壤水分可提高苜蓿的越冬能力。这与Wu等对冬季高土壤含水量利于苜蓿越冬的研究结论一致[28]。

表1 隶属函数法对2个品种苜蓿的综合评价
研究表明,植物受到干旱或者低温胁迫时,都会导致细胞内活性氧的增加[11,29]。细胞膜系统在受到氧化伤害后产生丙二醛,其含量可表征细胞膜脂过氧化的程度,也常用来表征细胞膜受破坏的程度[30]。在本研究中,经过低温冷冻处理后,WL根颈中的丙二醛含量明显高于ZD苜蓿中的。此外,对于WL苜蓿而言,低温干旱环境下根颈中的丙二醛含量显著高于低温环境下的,对于ZD苜蓿而言,低温干旱环境下根颈细胞内的丙二醛含量与低温环境下的无显著性差异。本研究中样本根颈细胞内丙二醛含量的对比结果与耐寒性的对比结果相一致,且符合丙二醛可表征细胞膜受破坏程度的理论。因此,本研究中丙二醛含量的对比结果可佐证耐寒性的对比结果。
在本研究中,调查了试验期间苜蓿地上部和地下部干物质量的变化。冷适应结束后,地上部干物质量在2个苜蓿品种间并无显著性差异。冷冻处理前,剪掉所有样本的地上部,以模拟越冬期间苜蓿地上部枯黄。结果显示,同一取样点地下部干物质量在各样本间也没有显著性差异,可能是由于试验前所选的苜蓿样本根系大小相近且冷冻处理期间地上部被剪掉后无新的物质积累。根据各样本间地上部和地下部干物质量的差异性分析,推断本研究中各样本间根颈耐寒性的差异以及WL苜蓿根颈在经过低温干旱环境处理后死亡的原因,并不是因试验期间苜蓿的生长而造成的。从本研究中苜蓿根颈含水量的变化来看,WL-B和ZD-B根颈含水量在试验期间未发生显著性变化,而WL-K和ZD-K根颈含水量在试验期间均存在显著性降低,只是WL-K根颈的失水速率远大于ZD-K根颈的。据此结果推断,低温干旱环境下水分散失过快致使根颈组织细胞含水量低,可能是导致WL-K根颈在低温冷冻期间细胞膜受到不可恢复的破坏的原因之一。
水分散失过快可能是导致低温干旱环境下苜蓿根颈细胞死亡的原因,需进一步分析是什么因素影响了苜蓿根颈细胞的水分散失速率。脯氨酸是植物体内重要的渗透调节物质[31-32],但有时植物抗寒性的增强要早于脯氨酸的积累,故无法确定它在改变植物耐寒性上的作用[33],然而也有研究通过转基因手段证明了脯氨酸的积累在植物应对非生物胁迫上的积极作用,如转入P5CS基因的矮牵牛其脯氨酸的积累量较野生种提高1.5~2.6倍,耐旱性也明显增强[34]。在本研究中,脯氨酸含量在品种间存在显著性差异,ZD苜蓿根颈中的脯氨酸含量高于WL苜蓿根颈中的。对于同一品种苜蓿而言,在S2点处WL-K根颈含有比WL-B根颈较高的脯氨酸含量,在S3点处WL-K根颈含有与WL-B根颈相近的脯氨酸含量,但这并未能阻止在冷冻环境下WL-K根颈较快的失水速率以及较大的细胞液相对渗透率。此外,经过阶段2和3的低温冷冻,2个品种苜蓿根颈内的脯氨酸含量均有明显降低,这与过去的研究结果相近。在对金银花进行干旱、低温和水淹胁迫处理时,曾发现随着胁迫时间的延长,脯氨酸含量有降低的趋势,可能是由于随着胁迫时间的延长,碳水化合物供应不足或酶活性降低等原因造成的[35]。在对2种暖季型草坪草进行持续的干旱胁迫,结果发现随着胁迫时间的延长,脯氨酸含量呈先升高后降低的现象,可能是由于胁迫时间的延长,根系活力下降造成的[36]。同时,研究还认为不能简单将某一时间点的脯氨酸含量作为衡量植物抗性的标准,可能会造成假结论的产生[36]。
此外,以往的研究表明,苜蓿在冷适应过程中会积累可溶性蛋白,并且学者们也肯定了可溶性蛋白在抗寒越冬过程中的重要作用[10,15]。但在本研究中,可溶性蛋白在WL-B和WL-K 2个样本间并无显著的差异性,可溶性蛋白未能阻止WL-K样本根颈细胞的破裂。可溶性糖也是苜蓿体内重要的渗透调节剂,还具有冷冻保护剂的作用,可影响苜蓿的耐寒性,如棉子糖和水苏糖等[10,37-38]。在本研究中,ZD苜蓿根颈内可溶性糖的含量显著高于WL苜蓿根颈内的。同时,对于ZD苜蓿而言,经过低温干旱环境和低温环境处理后,苜蓿根颈内的可溶性糖含量在2个样本间无显著差异;对于WL而言,低温干旱环境处理后苜蓿根颈中的可溶性糖含量显著高于低温环境处理后苜蓿根颈中的,此结果与本研究中根颈耐寒性的比较结果相一致。据此推断,在低温干旱环境下根颈中的可溶性糖含量较低,可能是导致WL苜蓿根颈水分散失过快以及细胞受到严重损伤的原因之一。根据几种物质的含量在品种间及样本间的差异性判断,脯氨酸和可溶性蛋白的含量可能与ZD苜蓿应对冷冻环境时更优异的表现有关,而可溶性糖的含量低是低温干旱处理境下WL苜蓿根颈细胞渗透性变高乃至死亡的原因。
4 结论
在模拟的低温干旱环境下,秋眠级较高的‘WL440HQ’苜蓿根颈失水速率较快,处理后细胞液相对渗透率超过60%,导致细胞受到无法修复的损伤,土壤干旱严重影响了‘WL440HQ’苜蓿抵抗冷冻的能力。而对于秋眠级较低的‘肇东’苜蓿,低温干旱环境条件下其根颈失水速率较‘WL440HQ’苜蓿慢,土壤干旱未对冷冻期‘肇东’苜蓿根颈的耐寒性产生显著性影响。从根颈细胞内物质的含量来看,脯氨酸和可溶性蛋白含量可能与‘肇东’苜蓿应对低温环境时更优异的表现有关,而可溶性糖含量低才是与“低温干旱”环境下‘WL440HQ’苜蓿根颈失水速率快乃至耐寒性受到严重影响的原因。
