藤茶总黄酮固体脂质纳米粒在大鼠体内肠吸收特性研究
2021-05-07张瑜倪杨毛毛林珠灿郭素华
张瑜倪,杨毛毛,张 瑞,林珠灿,郭素华
(福建中医药大学药学院,福建 福州350122)
藤茶为葡萄科植物显齿蛇葡萄[Ampelopsis grossedentata(Hand-Mazz)W.T.Wang]的 嫩 茎 叶[1],其味甘淡、性凉,具有清热解毒、祛风湿之功效[2]。现代研究表明:藤茶中富含黄酮类化合物,其中,二氢杨梅素(又称福建茶素)为其主要活性成分,其含量可达30%[3]。现代药理研究表明:藤茶总黄酮具有增强免疫功能、抗肿瘤、抗氧化、抗动脉粥样硬化、抑菌消炎、保肝护肝、降糖降脂、改善胰岛素抵抗等多种功能及对脑缺血再灌损伤的保护作用[4-7]。然而藤茶总黄酮中主要活性成分二氢杨梅素具有邻三酚羟基结构,易被氧化,稳定性较差,有较低的水溶性和脂溶性[8-9],且其穿透肠道黏膜的能力较差,体内半衰期短,口服生物利用度低等[10-11],严重影响了体内药效和临床应用。
固体脂质纳米粒(SLN)作为一种新型的药物载体,可延长药物的半衰期,进而提高药效成分的生物利用度;同时具备降低毒性、改善药物溶解性和生物相容性、提高稳定性及靶向性、缓释控释等特点[12-15];此外,SLN可有效减少胃肠道环境对药物的破坏,当小粒径纳米粒携带药物经过胃肠道时,可以通过胃肠道及其淋巴吸收,减少肝脏首过效应[16]。基于前期藤茶总黄酮固体脂质纳米粒的研制、处方的优化及体外释药行为的考察,本研究通过大鼠在体单向肠灌流实验,考察了藤茶总黄酮原料药和固体脂质纳米粒在肠道不同部位的吸收情况。
1 材 料
1.1 试药 藤茶总黄酮固体脂质纳米粒冻干粉(课题组成员自制,批号:20181215,纳米粒中二氢杨梅素含量为40.15 mg/mL);藤茶总黄酮原料药(课题组成员自制,批号:20180402);二氢杨梅素(上海源叶生物科技有限公司,批号:160422,纯度≥98%);杨梅苷(北盈泽纳新化工技术研究院,批号:15081713,纯度为99.41%);杨梅素(北京盈泽纳新化工技术研究院,批号:15050810,纯度为98.31%);酚红(北京索莱宝科技有限公司,批号:20060767);甲醇为色谱纯(德国Merck公司);水为超纯水;氯化钠、氯化钾、磷酸二氢钠、碳酸氢钠、六水氯化镁、无水氯化钙、葡萄糖均为分析纯。
1.2 仪器 BT100-1F蠕动泵(河北保定兰格恒流泵有限公司);HH-2数显恒温水浴锅(常州普森电子仪器厂);LC-20A高效液相色谱仪、SPD-M20A紫外检测器、UV 3600紫外分光光度仪(日本岛津公司)。
1.3 实验动物 清洁级SD雄性大鼠12只,体质量(220±20)g,购自上海斯莱克实验动物有限责任公司,实验前在福建中医药大学药学院动物房适应7 d,许可证号:SCXK(沪)2017-0005,合格证编号:20170005005003。肠吸收实验需大鼠体重增长至300~330 g。
2 方 法
2.1 溶液的配制
2.1.1 Krebs-Ringer溶液的配制 称量NaCl 7.80 g、CaCl20.37g、KCl 0.35 g、MgCl20.02 g、NaHCO31.37 g、NaH2PO4·2H2O 0.32 g、葡萄糖1.40 g(临用前添加),加入适量蒸馏水溶解,并用1 mol/L磷酸溶液调pH值至6.8,加蒸馏水定容至1 L,备用。
2.1.2 酚红溶液的配制 称量20 mg酚红粉末溶解于1 L的Krebs-Ringer溶液中,搅拌并混匀。
2.1.3 灌流液的配制 将藤茶总黄酮固体脂质纳米粒冻干粉及其原料药分别溶解于酚红溶液中,得到浓度为48 mg/mL的2种灌流液。
2.1.4 混合对照品的配制 分别精密称取一定量的二氢杨梅素、杨梅苷、杨梅素置于10 mL容量瓶,甲醇溶解定容,配制浓度分别为560.00、7.31、14.24μg/mL,4℃保存备用。
2.2 肠灌流液中酚红浓度的测定
2.2.1 酚红最大吸收波长的测定 取“2.1.3”项中含酚红和药物的灌流液,以及含酚红Krebs-Ringer溶液各0.5 mL于试管中,加入0.2 mol/L NaOH溶液5 mL,摇匀,置于紫外分光光度仪400~700 nm下扫描(空白对照为0.2 mol/L NaOH溶液),测得酚红的最佳吸收波长是559 nm。
2.2.2 标准曲线的配制 配制酚红的标准溶液浓度依次为2.5、10.0、20.0、30.0、40.0、50.0、60.0μg/mL,各取0.5 mL,再加入0.2 mol/L NaOH溶液5 mL,摇匀,在559 nm下测定并记录其吸光度(空白对照为0.2 mol/L NaOH溶液),以吸光度(A)和浓度(C)分别为纵坐标和横坐标绘制标准曲线,如图1。

图1 酚红浓度测定的标准曲线
2.2.3 酚红浓度的确定 将大鼠各肠段各时间点(每15 min收集1次)流出的肠灌流液样品过滤,取续滤液0.5 mL,按照“2.2.2”项下的方法测得吸光度,按照标准曲线计算大鼠肠灌流液样品中的酚红浓度。
2.3 肠灌流液中总黄酮含量测定及方法学考察
2.3.1 色谱条件 色谱柱:TOPODS-AQ柱(4.6 mm×250 mm,5μm);流动相:甲醇(A)-0.1%磷酸水溶液(D);梯度洗脱:0~10 min,35%A;10~20 min,35%A→80%A;20~30 min,80%A。检测波长:二氢杨梅素为291 nm,杨梅苷与杨梅素为252 nm;流速:1.0 ml/min;柱温:30℃;进样量:10μL。
2.3.2 专属性 分别取混合对照品溶液、空白灌流液(酚红溶液)、藤茶总黄酮固体脂质纳米粒灌流液及原料药灌流液,按照“2.3.1”项下色谱条件进样分析,获取谱图。见图2。
2.3.3 线性关系 精密吸取混合对照品溶液0.2、0.5、1.0、2.0、4.0、8.0、10.0 mL分别置于10 mL容量瓶中,用甲醇稀释成系列浓度的对照品溶液。按照“2.3.1”项下色谱条件进样分析。以对照品峰面积(A)为纵坐标,浓度(C)为横坐标绘制标准曲线,得到二氢杨梅素、杨梅苷、杨梅素的线性回归方程,结果见“3.1.2”。
2.3.4 精密度试验 精密移取混合对照品溶液100μL置于2 mL离心管,加入200μL酚红溶液和700μL甲醇,涡旋混匀,离心,取上清液按“2.3.1”项下色谱条件检测。其中日内精密度为1 d内连续测定上清液6次,日间精密度为取上清液连续测定3 d,分别计算日内精密度和日间精密度的RSD。
2.3.5 稳定性试验 按照“2.3.4”项同法制备上清液,分别于0、2、4、6、8、12、24 h按照“2.3.1”项下色谱条件进样分析,记录峰面积以计算RSD。
2.3.6 提取回收率试验 精密移取混合对照品溶液500μL,分别置于6个10 mL容量瓶中,接着以含有酚红、空白SLN的Krebs-Ringer溶液定容,混匀,则3个成分的浓度分别为28、0.37、0.71μg/mL溶液;精密吸取6个容量瓶中上述溶液各100μL,按照“2.3.4”项下方法处理得上清液,用HPLC测定,记录峰面积为A1;另精密吸取6个容量瓶中上述溶液各100μL,加入900μL甲醇涡旋混匀,0.45μm滤膜过滤,用HPLC精密检测,记录峰面积为A2,计算回收率。公式为:

2.4 大鼠在体肠吸收试验
2.4.1 在体单向肠灌流实验模型的建立 将SD大鼠随机分为藤茶总黄酮纳米粒组、原料药组,每组6只。取自由饮水条件下禁食12 h的大鼠,腹腔注射乌拉坦溶液5 mL/kg麻醉并固定,保持大鼠37℃的体温,沿腹中线切开腹部约4 cm,寻找待分析肠段(十二指肠、空肠、回肠、结肠),在两端剪口插管,结扎;先用37℃生理盐水清洗肠道,排空;接着用37℃灌流液以0.2 mL/min的恒速灌注肠道,平衡30 min后开始计时,每15 min收集一次出口管的肠灌流液。灌注实验结束后分别测量每段肠段的长度(L)和内径(R),以计算相应灌流肠段的体积(V)与表面积(A),最后采用HPLC检测出口管肠灌流液中的药物浓度。
2.4.2 吸收参数的计算 小肠在吸收药物的同时也吸收、分泌水分,致使灌流液体积发生变化,故计算肠吸收参数采用酚红法。数据采用SPSS 28.0软件分析。公式为:
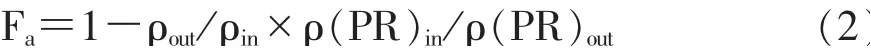
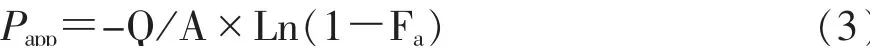
ρin和ρout分别表示进出口待测药物的浓度,ρ(PR)in和ρ(PR)out分别表示灌流液中酚红(PR)在肠段进、出口的浓度,Q为灌流速度,A为所灌流肠段的面积,Fa为各时间段样品中药物的平均吸收分数,Papp为表观通透系数。
3 结 果
3.1 灌流液中总黄酮含量测定及方法学考察结果
3.1.1 专属性 如图2所示,灌流液中其他杂质对二氢杨梅素、杨梅苷、杨梅素检测无干扰。

图2 各样品的HPLC色谱图
3.1.2 标准曲线的建立 二氢杨梅素的回归方程:y=25 908x+37 417,r=0.999 9,表明二氢杨梅素在11.2~560.00μg/mL线性关系良好;杨梅苷的回归方程:y=26 152x-3 612.5,r=0.999 2,表明杨梅苷在0.15~7.31μg/mL线性关系良好;杨梅素的回归方程:y=45 234x-1 851.8,r=0.999 5,表明杨梅素在0.28~14.24μg/mL线性关系良好。
3.1.3 精密度试验 由表1和表2可知,日内、日间精密度平均RSD均小于3%,符合要求。
3.1.4 稳定性试验 由表3可知,RSD结果在0.53%~2.77%内,符合方法学要求。

表1 灌流液中总黄酮日内精密度
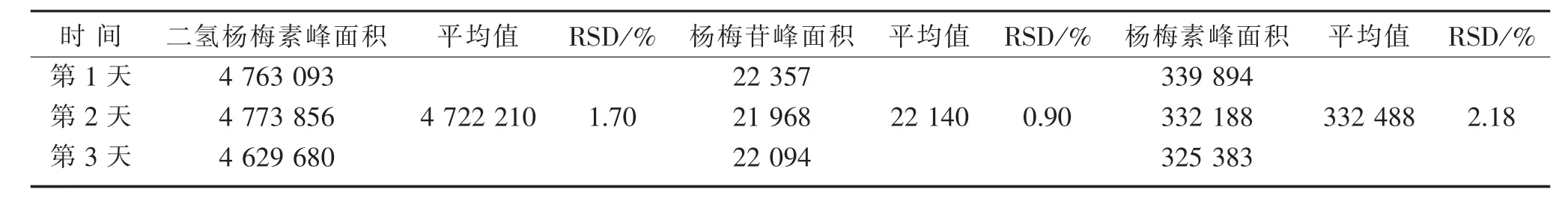
表2 灌流液中总黄酮日间精密度(n=6)

表3 灌流液中总黄酮稳定性(n=6)
3.1.5 回收率试验 由表4可知,二氢杨梅素提取回收率平均值为101.08%,杨梅苷为94.47%,杨梅素为97.80%,说明样品的处理及检测过程对3个成分的含量影响较小,符合要求。
3.2 在体单向肠灌流实验结果 见图3和图4,结果显示:总黄酮原料药及纳米粒在整个小肠肠段均有不同程度的吸收,在中上肠段的吸收尤其明显,纳米粒在4个肠段的平均吸收分数(Fa)和表观通透系数(Papp)均高于原料药。纳米粒在十二指肠、空肠、回肠、结肠的Fa值分别为原料药的1.89、2.07、1.47、1.84倍,在四个肠段的Papp分别是原料药的1.80、3.02、1.65、1.95倍。经两样本t检验,与原料药相比,纳米粒在十二指肠、空肠的Fa有非常显著升高(P<0.01),在回肠和结肠明显升高(P<0.05),纳米粒在空肠的Papp显著升高(P<0.05),而在其他3个肠段的Papp均无差异(P>0.05)。
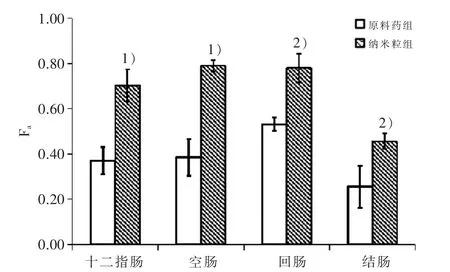
图3 纳米粒组及原料药组总黄酮在不同肠段F a比较
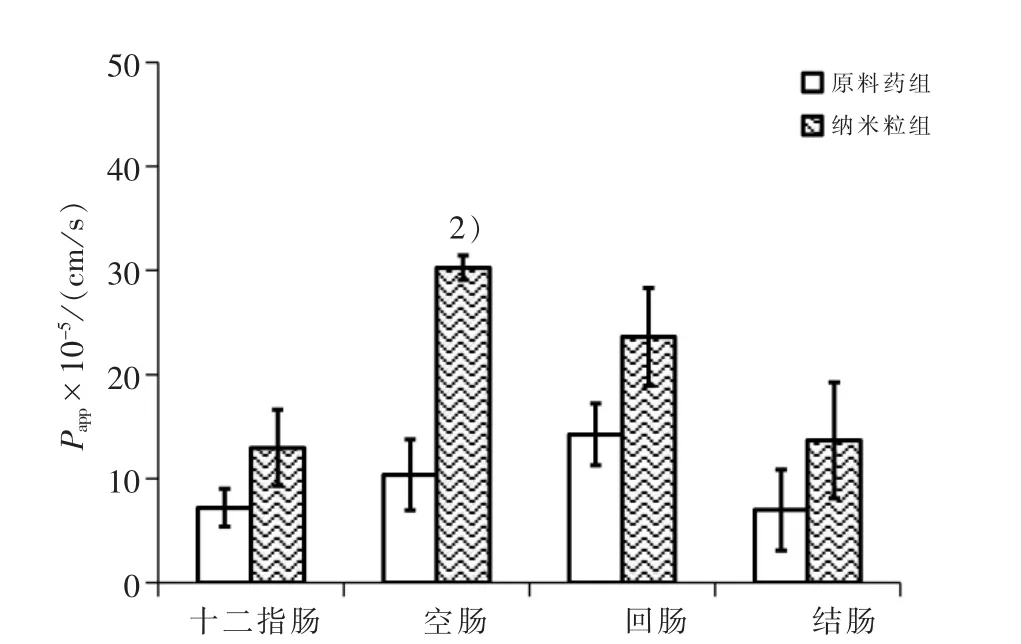
图4 纳米粒组及原料药组总黄酮在不同肠段P app比较
综合平均吸收分数和表观通透系数的结果来看,藤茶总黄酮固体脂质纳米粒在空肠的吸收较好,其次是回肠、十二指肠、结肠;而总黄酮原料药的最大吸收在回肠,其次是空肠、十二指肠和结肠,说明将藤茶总黄酮制备成固体脂质纳米粒口服制剂,可增强总黄酮在肠道的吸收,甚至改变了最佳吸收肠段。
4 讨 论
口服给药是中药最主要的传统给药方式,肠吸收是其最主要的吸收途径。研究药物口服后肠道的吸收情况对评价药物的生物利用度、改进药物的剂型、提高疗效具有非常重要的意义[17]。本实验采用在体实验法,向大鼠肠道单向灌流药物溶液,以评价藤茶总黄酮固体脂质纳米粒及其原料药在不同肠段的吸收。相较于外翻肠囊法,在体单向肠灌流能够保证肠道神经和内分泌输入的完整性,同时也保证血液和淋巴液的供应。药物透过上皮细胞后被血液运走,避免了胃内容物、消化管固有运动等生理影响。
对照组藤茶总黄酮溶液在4个肠段的平均吸收分数和表观通透系数均低于纳米粒组,可能是因为总黄酮的水溶性差,被肠道吸收困难。而纳米粒组的平均吸收分数和表观通透系数均有所提高,推测可能与纳米粒所带电荷有关,带负电荷的纳米粒,具有较好的生物黏附特性,更容易透过肠道的粘液层,有效增加了其与肠道的接触,从而以被动扩散或内吞的方式被小肠上皮细胞吸收。这需要通过Caco-2细胞摄取和转运实验进一步确证[18-21]。另一方面,制备固体脂质纳米粒所用脂质载体和乳化剂的特殊性,以及制备过程中水油两相混合乳化充分,再经过探头超声后减小粒径,增强总黄酮纳米粒的渗透性,从而能迅速穿过黏液层接触肠细胞被吸收。
本实验借助大鼠在体单向肠灌流模型,以酚红作为指示方法来检测比较纳米粒制剂和其原料药在体内不同肠段的吸收程度,该法稳定、可靠,实验的可操作性强,可以普遍应用。经实验考察发现,将藤茶总黄酮制备成固体脂质纳米粒口服制剂,可增强总黄酮在肠道的吸收,甚至改变了最佳吸收肠段,即纳米粒的最佳吸收肠段为空肠肠段,而原料药为回肠。