栝楼桂枝汤对脑缺血/再灌注损伤大鼠小胶质细胞极化的影响
2021-05-07程伟能南丽红张玉琴赖文芳陈亚萍
程伟能,南丽红,张玉琴,赖文芳,陈亚萍,黄 枚
(福建中医药大学药学院,福建 福州350122)
脑卒中是一种由脑血管破裂或阻塞所引起的脑部血液循环障碍性疾病,据其发病机制不同可分为缺血性脑卒中及出血性脑卒中[1],其中缺血性脑卒中是临床最常见的脑卒中类型,约占脑卒中发生的70%~80%[2]。栝楼桂枝汤(GLGZD)出自《金匮要略》有补阴阳,调气血,养营生津,柔润筋脉之功效,主治痉证[3]。现代临床将该方用于脑卒中后肢体痉挛的康复治疗,疗效确切[4]。研究表明,脑卒中后肢体痉挛是由于上运动神经元损伤所致,而脑缺血后的持续炎症反应,可引起神经元死亡,是导致神经元功能障碍的关键因素[5]。小胶质细胞作为大脑常驻免疫细胞,在神经炎症中扮演重要角色[6]。课题组前期研究发现GLGZD可通过多途径抑制大脑皮层神经细胞的缺血性凋亡,改善缺血区神经细胞的病理状态,减少脑梗死体积,发挥神经保护作用[7-9],但作用机制尚未完全阐明。故本研究以小胶质细胞极化为切入点,进一步探索GLGZD缓解脑卒中后肢体痉挛的可能机制,为GLGZD的临床应用提供科学依据。
1 材 料
1.1 实验动物 无特定病原体(SPF)级雄性SD大鼠36只,体质量为(260±10)g,购自上海斯莱克实验动物责任有限公司,许可证号为SCXK(沪)2017-0005,饲养于福建中医药大学实验动物中心,合格证号为SYXK(闽)2019-0007。
1.2 实验药物 栝楼(北京本草方源药业科技有限公司,生产批号:190101);白芍(厦门燕来福制药有限公司,生产批号:180803);桂枝(安徽孚众药业有限公司,生产批号:191101);甘草(渭源衡顺堂药业有限公司,生产批号:006191217);大枣(麻城九州中药发展有限公司,生产批号:E1910311206);生姜购买于福建承创堂药店。
1.3 主要试剂 特超敏化学发光液(大连美仑生物技术有限公司);抗荧光淬灭剂(美国Vecta公司);DAPI染液(上海碧云天生物技术有限公司);牛血清白蛋白(德国Biofroxx公司);离子钙结合衔接分子1(Iba1)一抗(美国Thermo Fisher公司);精氨酸酶-1(Arg1)一抗(美国Affinity公司);白细胞介素-4(IL-4)一抗(武汉三鹰生物技术有限公司);白细胞分化抗原86(CD86)一抗、白细胞介素-6(IL-6)一抗(武汉爱博泰克生物科技有限公司);β-actin一抗、HRP二抗、核转录因子κBp65(NF-κBp65)一抗、兔荧光二抗、鼠荧光二抗(英国Abcam公司);DAB显色试剂盒、内源性过氧化物酶阻断液、免疫组化试剂盒(武汉博士德生物工程有限公司)。
1.4 主要仪器 PVDF膜(美国Millipore公司);尼龙线栓(广州佳灵生物技术有限公司);石蜡切片机(美国ThermoFisher公司);DM IL LED型倒置相差显微镜(德国Leica公司);SZ760型体视显微镜(重庆奥特光学仪器有限公司);生物组织自动脱水机、生物组织石蜡包埋机、生物组织摊烤机(湖北孝感宏业医用电子技术有限公司)。
2 方 法
2.1 GLGZD的制备 称取栝楼30 g,桂枝9 g,白芍9 g,大枣9 g,生姜9 g,甘草6 g,置于2 000 mL圆底烧瓶中,加入10倍量饮用水,室温浸泡30 min后加热回流提取1.5 h。提取结束后用纱布过滤药渣,再次加入8倍量的水并重复上述步骤。合并两次滤液并浓缩至50 mL(药物浓度为1.44 g/mL)。
2.2 造模、分组与给药 将36只健康雄性SD大鼠随机分为假手术组12只及造模组24只。造模组大鼠采用线栓法制备MCAO模型,术前禁食不禁水12 h,腹腔注射戊巴比妥钠(60 mg/kg)麻醉大鼠;将大鼠颈部中线开一切口,钝性分离直至暴露出颈总动脉(CCA)、颈内动脉(ICA)及颈外动脉(ECA);线栓从CCA插入直至栓塞大脑中动脉,栓塞2 h后拔出部分线栓进行再灌注。假手术组除不栓塞大脑中动脉,其余操作与上述一致。待大鼠完全清醒,参照改良神经功能缺损评分(mNSS)[10]对大鼠的运动、感觉、平衡及反射进行综合评价,mNSS评分在7~15分的大鼠为造模成功大鼠。将造模成功的大鼠按分层随机原则分为模型组及GLGZD组,每组12只。各组大鼠均按1 mL/100 g体质量灌服给药,GLGZD组灌服1.44 g/mL的GLGZD(即14.4 g/kg,相当于临床人日用量的12倍),模型组及假手术组灌服蒸馏水,每天1次,连续7 d。
2.3 神经功能缺损评分采用mNSS评分法,分别在给药前及给药后第3、5、7天对各组大鼠神经功能缺损情况进行评价。
2.4 组织石蜡切片的制备 大鼠末次给药2 h后,麻醉大鼠,用生理盐水和4%多聚甲醛进行心脏灌注,以此除去组织内的血液并对组织进行初步固定。取脑并置于4%多聚甲醛固定24 h,用大鼠脑模具将大脑制成2 mm切片,并进行常规脱水、石蜡包埋、切片。
2.5 免疫荧光法检测缺血侧大脑皮层分化抗原86/离子钙结合衔接分子1(CD86/Iba1)及精氨酸酶-1/离子钙结合衔接分子1(Arg1/Iba1)阳性细胞率 石蜡切片常规脱蜡复水、抗原修复及封闭。滴加相应的一抗(Iba1、CD86、Arg1稀释比均为1∶300),4℃条件下孵育12 h。滴加二抗(兔荧光二抗、鼠荧光二抗稀释比均为1∶500),孵育2 h。滴加DAPI孵育15 min。吸弃切片上残留的液体并用抗荧光淬灭剂封片。各样本于倒置荧光显微镜400倍镜下随机摄取5个视野,并采用Image J图像分析软件计算同一视野下各指标阳性细胞率(即红色荧光、绿色荧光与蓝色荧光重叠的细胞占绿色荧光与蓝色荧光重叠的细胞的百分率)。
2.6 免疫组化法检测缺血侧大脑皮层白细胞介素-6(IL-6)及白细胞介素-4(IL-4)蛋白的表达 石蜡切片常规脱蜡复水、阻断内源性过氧化物酶活性、抗原修复及封闭。滴加相应的一抗(IL-6、IL-4稀释比均为1∶200),4℃条件下孵育12 h。滴加二抗,孵育2 h。滴加SABC,孵育1 h。DAB显色,并用苏木素复染,封片。各样本于倒置荧光显微镜400倍镜下随机摄取5个视野,并采用Image J图像分析软件计算同一视野下各指标蛋白表达(即棕黄色区域面积占图片总面积的百分率)。
2.7 Western blot检测缺血侧大脑皮层核因子κBp65(NF-κBp65)蛋白的表达 大鼠末次给药2 h后,立即处死大鼠并取缺血侧大脑皮层组织。用裂解液提取组织中总蛋白,BCA法测定蛋白浓度后,加入上样缓冲液制成蛋白样品。制备SDS-PAGE凝胶,进行电泳、转膜、封闭,于4℃条件下孵育一抗(β-actin、NF-κBp65稀释比均为1∶1 000)过夜。孵育HRP二抗(稀释比均为1∶3 000)2 h,以特超敏ECL显影液进行显影拍照。结果使用Image Lab 4.1软件对蛋白条带进行定量分析。本实验以β-actin为内参,目的蛋白相对表达量=目的蛋白灰度值/β-actin灰度值,并参照假手术组对所得目的蛋白相对表达量的值进行归一化处理。
2.8 统计学方法 采用SPSS 22.0软件进行数据分析。计量资料属正态分布的以表示,采用单因素方差分析,非正态分布的采用非参数检验。
3 结 果
3.1 3组大鼠mNSS评分比较 见表1。
表1 3组大鼠mNSS评分比较(±s) 分

表1 3组大鼠mNSS评分比较(±s) 分
注:与假手术组比较,1)P<0.01;与模型组比较,2)P<0.05,3)P<0.01。
?
3.2 3组大鼠缺血侧大脑皮层CD86/Iba1及Arg1/Iba1阳性细胞率比较 见图1及图2。
3.3 3组大鼠缺血侧大脑皮层IL-6及IL-4蛋白表达比较 见图3及图4。
3.4 3组大鼠缺血侧大脑皮层NF-κBp65蛋白表达比较 见图5。
4 讨 论
本实验采用线栓法制备MCAO模型大鼠并用mNSS评分法对各组大鼠神经功能缺损程度进行评价。实验结果表明,模型组大鼠mNSS评分明显高于假手术组(P<0.01),提示造模成功。经GLGZD干预后,GLGZD组大鼠mNSS评分在给药后第3天、5天、7天与模型组比较均明显降低(P<0.05或0.01),提示GLGZD可显著改善MCAO模型大鼠神经功能缺损,对缺血性脑损伤具有较好的保护作用。
目前研究认为,脑缺血后的急性炎性反应是导致脑组织缺血损伤加剧的重要因素。而小胶质细胞在脑卒中发生后,会迅速活化并被募集至病变部位,是启动脑缺血炎性反应的关键[11]。研究表明,活化后的小胶质细胞有两种极化表型,分别为M1表型(促炎型)及M2表型(抗炎型)。而M1型小胶质细胞是神经炎症反应的核心,M2型小胶质细胞具有抑制炎症反应、促进组织修复等功能,在脑卒中后发挥神经保护功能[12]。

图1 3组大鼠缺血侧大脑皮层CD86/Iba1阳性细胞率比较(×400)
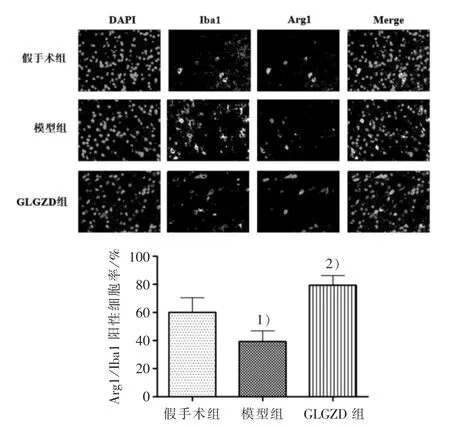
图2 3组大鼠缺血侧大脑皮层Arg1/Iba1阳性细胞率比较(×400)
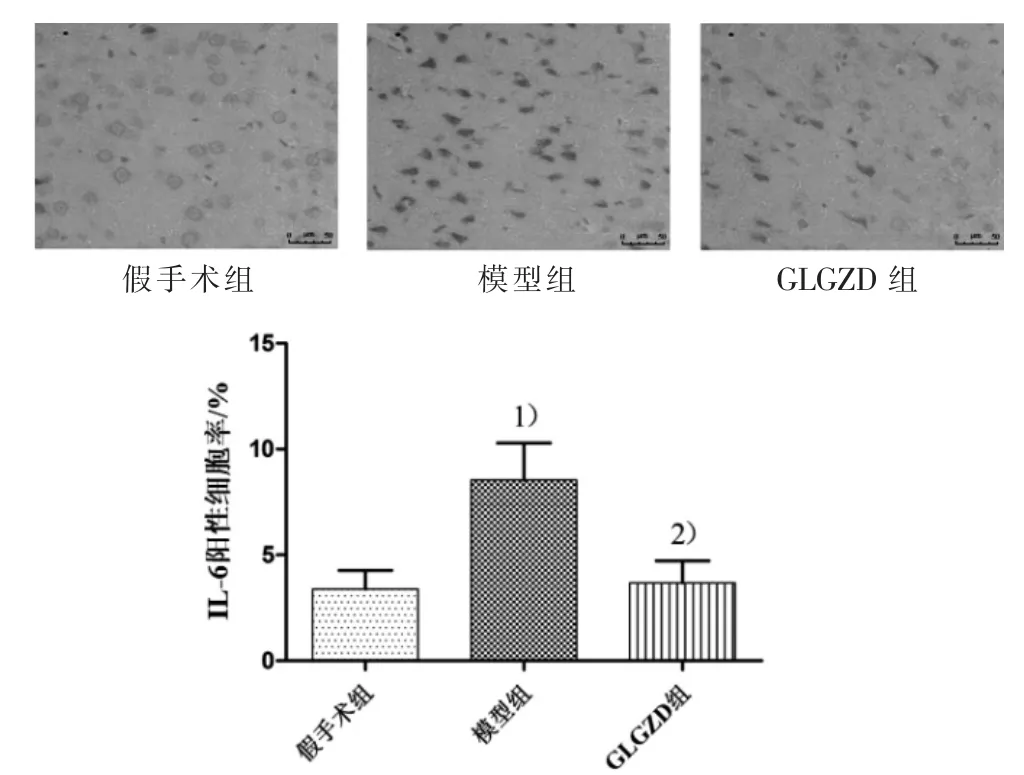
图3 3组大鼠缺血侧大脑皮层IL-6蛋白表达比较(×400)

图4 3组大鼠缺血侧大脑皮层IL-4蛋白表达比较(n=6)
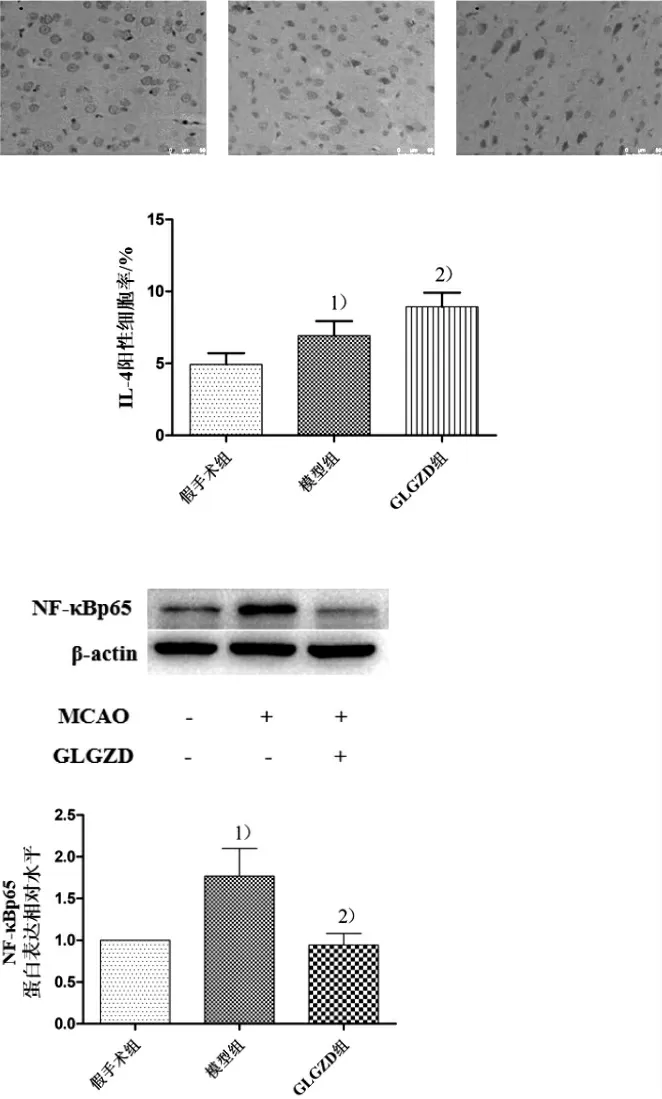
图5 3组大鼠缺血侧大脑皮层NF-κBp65蛋白表达比较
CD86是M1型小胶质细胞的标记物,常被用来评估小胶质细胞M1型极化情况。在缺血性脑损伤中,IL-6作为M1型小胶质细胞释放的神经炎症因子之一,可导致神经元进一步受损[13],通过检测IL-6的表达,可反映M1型小胶质细胞的极化情况,评估大脑中的炎症进程。Arg1作为M2型小胶质细胞的标记物[14],在组织修复等过程中发挥关键作用。IL-4是M2型小胶质细胞释放的抗炎因子之一,能减轻脑缺血/再灌注损伤后的炎症反应[15],可用来评估M2型小胶质细胞的极化水平。本实验采用免疫荧光法将CD86、Arg1分别与小胶质细胞活化标志物Iba1共染,通过CD86、Arg1阳性细胞数与Iba1阳性细胞数的比值来观察活化小胶质细胞的极化状态;采用免疫组化法观察大鼠缺血侧大脑皮层IL-4、IL-6蛋白的表达情况。结果显示:模型组较假手术组M1型小胶质细胞数和IL-6的蛋白表达明显增加,而M2型细胞数和IL-4的蛋白表达明显减少(P<0.01),提示脑缺血/再灌注损伤后小胶质细胞异常活化并向M1型转化,介导神经炎症反应;GLGZD干预后能明显减少M1型小胶质细胞数和IL-6的蛋白表达,增加M2型细胞数和IL-4的蛋白表达(P<0.01),提示GLGZD可促进活化的小胶质细胞向M2型转化,从而减轻神经炎症反应,促进缺血性脑卒中后的康复。
NF-κB是炎症反应中发挥中心调控作用的关键因子,由p50和p65亚基组成,其中p65亚基在蛋白的C末端含有转录激活区域,可与胞核DNA上的κB序列结合位点特异性结合,从而启动一系列基因的转录[16],NF-κBp65的表达上调可促使小胶质细胞向M1型转化[17]。本实验采用Western blot检测NF-κBp65蛋白表达水平,结果显示,GLGZD能明显减少缺血侧大脑皮层中NF-κBp65蛋白表达水平(P<0.01)。提示GLGZD可通过下调NF-κBp65蛋白的表达,调控小胶质细胞的极化,从而减轻脑缺血诱导的神经炎症,发挥治疗作用。