花期低温胁迫及喷施烯效唑对绿豆光合特性和保护酶活性的影响
2021-05-07单莹丁凯鑫郑殿峰2冯乃杰2项洪涛梁喜龙
单莹,丁凯鑫,郑殿峰2,,冯乃杰2,,项洪涛,梁喜龙
(1.黑龙江八一农垦大学农学院,大庆163319;2.广东海洋大学滨海农业学院;3.黑龙江省农业科学院耕作栽培研究所)
起源于亚热带的绿豆是对温度极为敏感的喜温性作物[1],随着全球极端性的低温冻害事件频繁发生,低温冻害成为制约绿豆生产的重要因素[2]。据统计,每年全球豆类作物因冷害减产6%~10%,严重时甚至可达到23%~40%[3]。当环境温度低于15 ℃时,绿豆就不能开花结荚,低于0 ℃时就会导致绿豆死亡[4]。低温胁迫还会使绿豆植株体内细胞的结构以及新陈代谢过程发生变化,如叶绿体、线粒体、细胞核、液泡等细胞器的损伤,胞内蛋白质及膜脂的降解,使绿豆光合作用与呼吸作用发生改变[5]。绿豆作为主要的食用豆类作物之一,也是我国重要的种植结构替代作物,绿豆产业的发展对我国农业的可持续发展至关重要。黑龙江省纬度高,在夏季也极易发生低温冷害类的灾害性天气事件,因此,提高低温条件下初花期绿豆的耐寒能力对提高绿豆产量有重要作用。
植物有90%左右的干重来自于光合作用,且光合系统对低温胁迫最为敏感[6],而低温胁迫会降低植物叶片光合作用效率,抑制植株生长发育进程从而造成植株的个体生理差异,最终导致作物减产。而植物叶片的胞间CO2浓度(Ci)、蒸腾速率(Tr)、净光合速率(Pn)和气孔导度(Gs)这四个光合参数是植物在低温胁迫下光合生理响应的重要指标[7]。低温胁迫会使植株的叶绿素含量降低并且加深细胞的膜质过氧化程度以及丙二醛(MDA)含量增加[8]。低温胁迫还会使植物保护酶系统发生变化,高冬冬等[9]指出,在一定胁迫时间内,低温会导致植物体内过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)等酶的活性得到提高。通过化控技术调控作物的生理代谢、提高作物的光合效率最终增加作物的产量已被广泛使用。烯效唑(S3307)是一种新型高效植物生长调节剂,具有范围广、低残留等特点[10]。郑春芳等[11]报道,烯效唑可以增强植物体叶绿素合成的相关酶活性,进而提高净光合速率以及叶绿素含量。初花期喷施S3307 能降低低温胁迫条件下大豆的MDA含量并提高POD 和SOD 活性[12]。黄玉兰等[13]也指出,喷施S3307 可有效提高低温胁迫下薏苡幼苗的生理功能进而降低减产幅度。而当绿豆受到低温胁迫时,会阻碍叶片的生理代谢并影响植株生长发育,最终导致减产。近年来,关于低温胁迫对绿豆影响的研究较少,且关于S3307 如何缓解低温胁迫对初花期绿豆的研究少见报道。因此,试验于初花期对绿豆进行低温处理,开展低温胁迫及预喷施S3307 对绿豆叶片抗逆生理、光合作用效率以及产量的影响研究,旨在分析S3307 抵御绿豆初花期低温胁迫的作用,以期为绿豆抗寒栽培提供科学依据。
1 材料和方法
1.1 材料与试剂
供试绿豆[Vigna radiata(L.)Wilcz]品种:绿丰2号(用“L2”表示)和绿丰5 号(用“L5”表示)为两个有差异基因型的绿豆品种,由黑龙江八一农垦大学国家杂粮工程技术研究中心种质资源库提供。
烯效唑(S3307)原液由黑龙江八一农垦大学化控实验室提供,供试浓度为50 mg·L-1。
1.2 试验设计
试验于2020 年在黑龙江省农业科学院盆栽场及人工气候室内进行盆栽试验。试验采用上口直径×下底直径×盆高为30×23×32 cm 的聚氯乙烯树脂(PVC)盆,盆底部带有出水孔,以便排水之用。试验所用土壤的基本理化性状如表1 所示。盆栽用土比例为栽培土与细沙3∶1 混合均匀使用,并根据实际天气情况浇水。于5 月10 日进行播种,播种前挑选大小均匀一致、品质优良的绿豆种子,等距离播种5 穴,每穴3 粒种子,生长到V2 期进行间苗,每穴保留1 株幼苗,每盆定苗5 株,在试验期间及时除草并喷洒农药来防治病虫害。

表1 供试土壤基本理化性状Table 1 The basic physical and chemical properties of soil
试验统筹见表2。试验采用完全随机试验设计,以单盆为单位确定为一个重复,一个试验处理4 个重复。于始花期(6 月29 日)叶面喷施S3307,对照喷施等量清水。在喷施S3307 和清水36 h 后将待处理的盆栽搬进人工气候室进行低温处理,低温胁迫伤害持续5 d。低温条件为昼夜恒温15 ℃,光照条件正常。其中,在胁迫处理的1~4 d,每天分别将每个处理的植株搬至室外相同盆数,供成熟期进行收获测产使用。

表2 试验设计统筹表Table 2 Test design plan
1.3 项目测定与方法
1.3.1 光合色素含量测定
在绿豆低温处理第1、2、3、4 天,以绿豆第一片完全展开的复叶为研究对象,每天称取0.1 g 功能叶片浸泡于10 mL 无水乙醇中,避光常温条件下放置24 h 后,参照Lichtenthale 等[14]方法采用乙醇比色法,测定叶绿素a(Chl a)含量、叶绿素b(Chl b)含量、总叶绿素含量Chl(a+b)和类胡萝卜素(Car)含量。
1.3.2 光合参数测定
在绿豆期低温处理的第1、2、3、4 天,于每天上午9:00~11:00 进行取样,选取相同处理条件下长势相似的绿豆功能叶片(倒三叶),采用美国Li-Cor 公司生产的Li-6400 便携式光合仪(参数设定:光照强度为1 000 μmol·m-2·s-1、空气流速为500 μmol·s-1,CO2供应浓度400 μmol·mol-1),测定其Pn、Tr、Gs和Ci,每处理测定4 次重复并取平均值记录整理。
1.3.3 氧化酶与丙二醛测定
于绿豆R1 期冷害处理后第1 天开始第1 次取样,连续4 d。每次选取5 株植株并取其功能叶片速冻于液氮中,随后转入-80 ℃超低温冰箱中保存,待样品全部收集完毕后,统一测定和过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性以及丙二醛(MDA)含量。
1.4 数据分析
试验原始数据通过Microsoft Excel 2016 软件进行录入和整理,采用SPSS 23.0 版本对数据进行方差分析,并使用Microsoft Excel 2016 软件进行绘图。
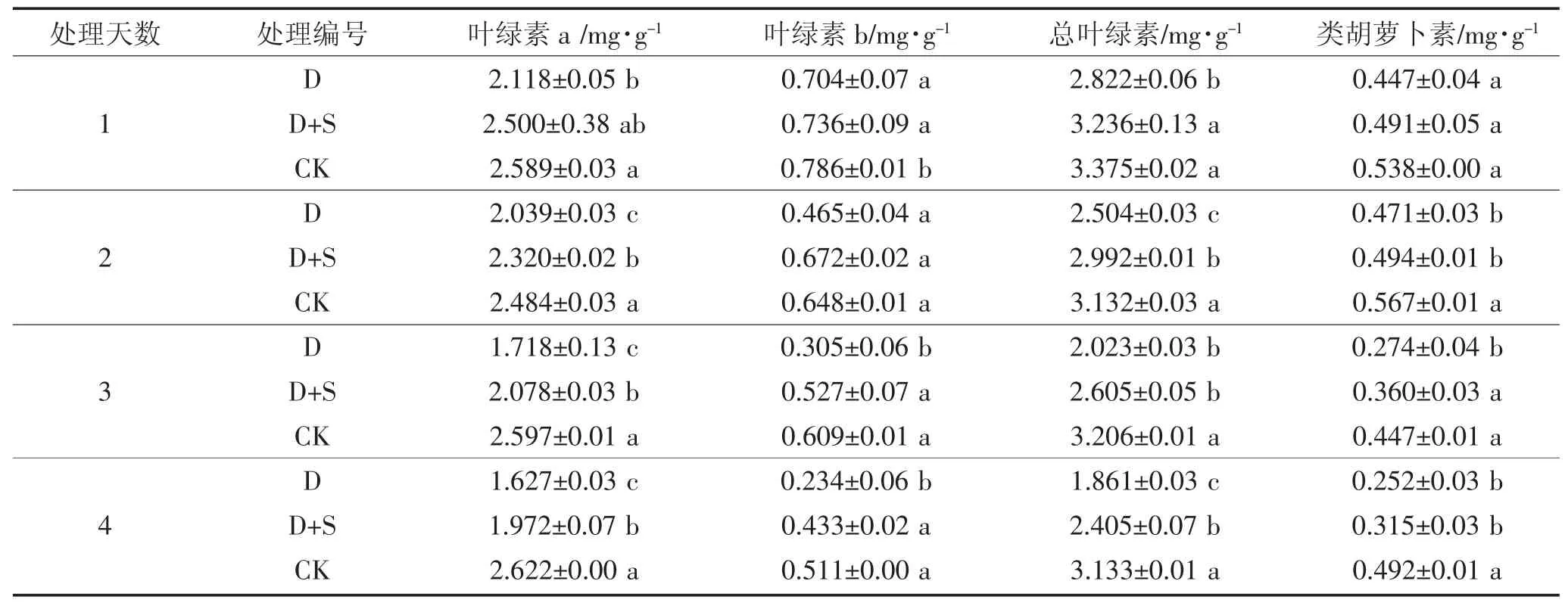
表3 低温胁迫下喷施烯效唑对绿丰2 号叶片光合色素含量的影响Table 3 Effects of uniconazole on the contents of photosynthetic pigments in Lvfeng 2 under low temperature stress
2 结果与分析
2.1 初花期低温及喷施烯效唑对绿豆叶片叶绿素含量的影响
如表3、4 所示,在初花期受到低温胁迫后,两品种绿豆叶片内的Chl a、Chl b、Ch(la+b)和Car 含量呈逐渐降低趋势。与对照(L2-CK 或L5-CK)相比,绿丰2 号上述指标的减少幅度依次为17.91%~38.04%、10.51%~54.30%、16.38%~40.61%、17.00%~48.68%,绿丰5 号上述指标的减少幅度依次为13.52%~30.20%、6.43%~47.21%、12.80%~34.82%、26.01%~44.35%,处理与对照间差异显著;而外源喷施烯效唑可以有效缓解低温胁迫对初花期绿豆叶片Chl 含量和Car 含量的减少,与对照(L2-CK 或L5-CK)相比,绿丰2 号上述指标的减少幅度依次为3.45%~24.81%、3.65%~15.32%、4.15%~23.26%、8.85%~35.93%,绿丰5 号上述指标的减少幅度依次为10.23%~18.51%、8.38%~45.21%、10.08%~25.79%、7.28%~43.29%,处理与对照间差异显著。
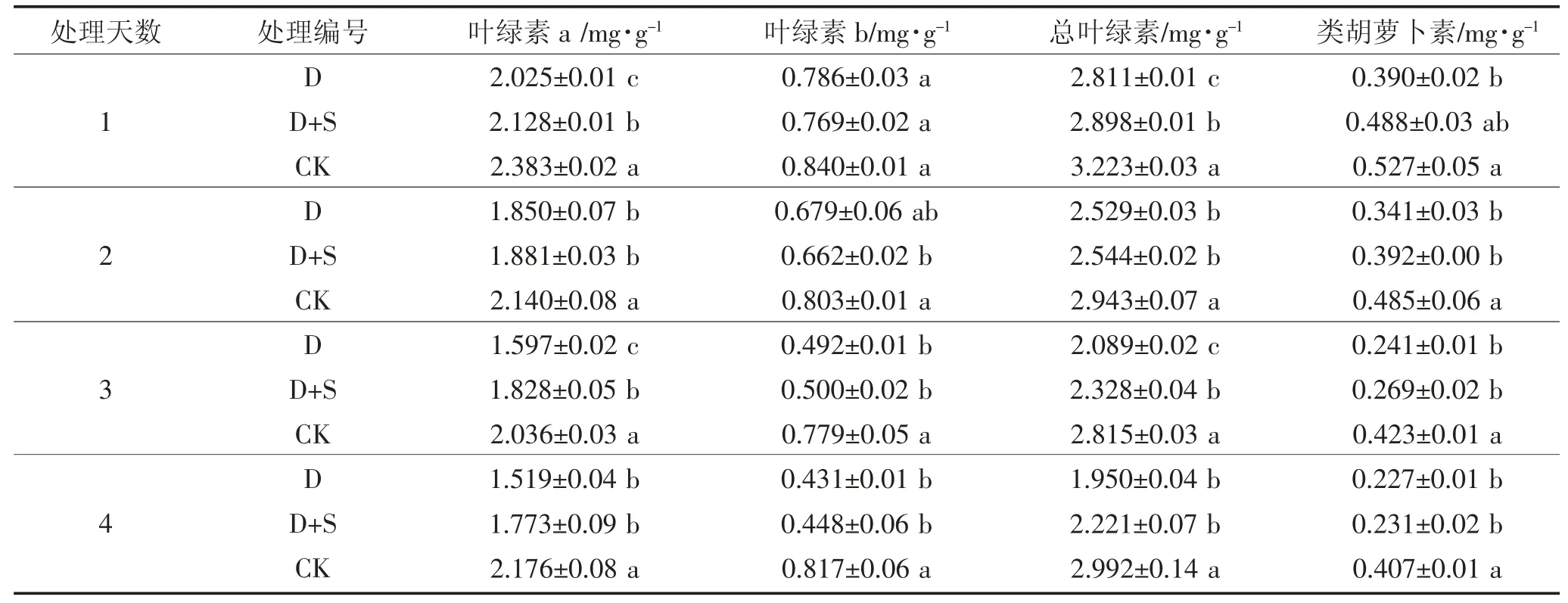
表4 低温胁迫下喷施烯效唑对绿丰5 号叶片光合色素含量的影响Table 4 Effects of uniconazole on the contents of photosynthetic pigments in Lvfeng 5 under low temperature stress
2.2 初花期低温及喷施烯效唑对绿豆叶片光合参数的影响
2.2.1 对叶片净光合速率(Pn)的影响
由图1 分析可得,初花期低温胁迫后,绿豆叶片的Pn呈逐渐降低趋势,与对照(L2-CK 和L5-CK)相比,L2 和L5 均表现为低温胁迫处理显著低于CK。喷施S3307 后,有效提高了低温胁迫下的绿豆叶片的净光合速率(Pn)。L2 处理第1、2、4 天时,L2-D+S 较L2-D 分别显著提高32.05%、39.97%和61.49%。L5处理第1、2、4 天时,L5-D+S 较L5-D 分别提高了34.99%、41.87%和34.04%。
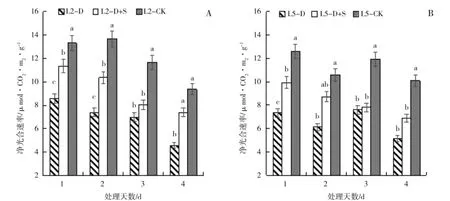
图1 低温胁迫及喷施烯效唑对绿豆叶片净光合速率(Pn)的影响Fig.1 Effects of uniconazole on net photosynthetic rate(Pn)of mungbean under low temperature stress
2.2.2 对叶片胞间CO2浓度(Ci)的影响
由图2 可知,L2 和L5 于初花期受到低温胁迫后,D 较CK 均有不同程度的降低,喷施S3307 后可缓解Ci的降低。L2 处理第1、2、4 天时,D+S 较D 显著提高,分别提高2.64%、11.81%、2.11%。L5 处理第2、3 天时,D+S 处理较D 处理分别显著提高了6.03%和3.80%。

图2 低温胁迫及喷施烯效唑对绿豆叶片胞间CO2 浓度(Ci)的影响Fig.2 Effects of uniconazole on intercellular CO2 concentration(Ci)of mungbean under low temperature stress
2.2.3 对叶片气孔导度(Gs)的影响
气孔导度是限制作物叶片光合作用提高的重要因素之一。从图3 分析得出,随胁迫时间延长,两绿豆品种的Gs整体呈下降趋势,在第4 天时达到最小值,L2 处理第1~4 天时,D 较CK 分别显著下降29.11%、70.36%、76.09%和69.01%。L5 处理第1~4 天时,D 较CK 分别显著下降73.05%、61.35%、55.63%和18.58%。喷施S3307 后并未使两品种叶片气孔导度有显著变化。

图3 低温胁迫及喷施烯效唑对绿豆叶片气孔导度(Gs)的影响Fig.3 Effects of uniconazole on stomatal conductance(Gs)of mungbean under low temperature stress
2.2.4 对叶片蒸腾速率(Tr)的影响
由图4 可以看出,初花期低温胁迫后,绿豆叶片的Tr大致呈降低趋势。L2 处理1~4 d 时,D 较CK 均显著降低;而D+S 均显著高于D,增幅分别为14.13%、48.52%、65.79%和37.96%。L5 处理1~4 d时,D 较CK 均显著降低;处理第3 天时,D+S 较D 之间差异不显著,第1、2、4 天,D+S 较D 分别显著提高了62.26%、35.31%和10.96%。
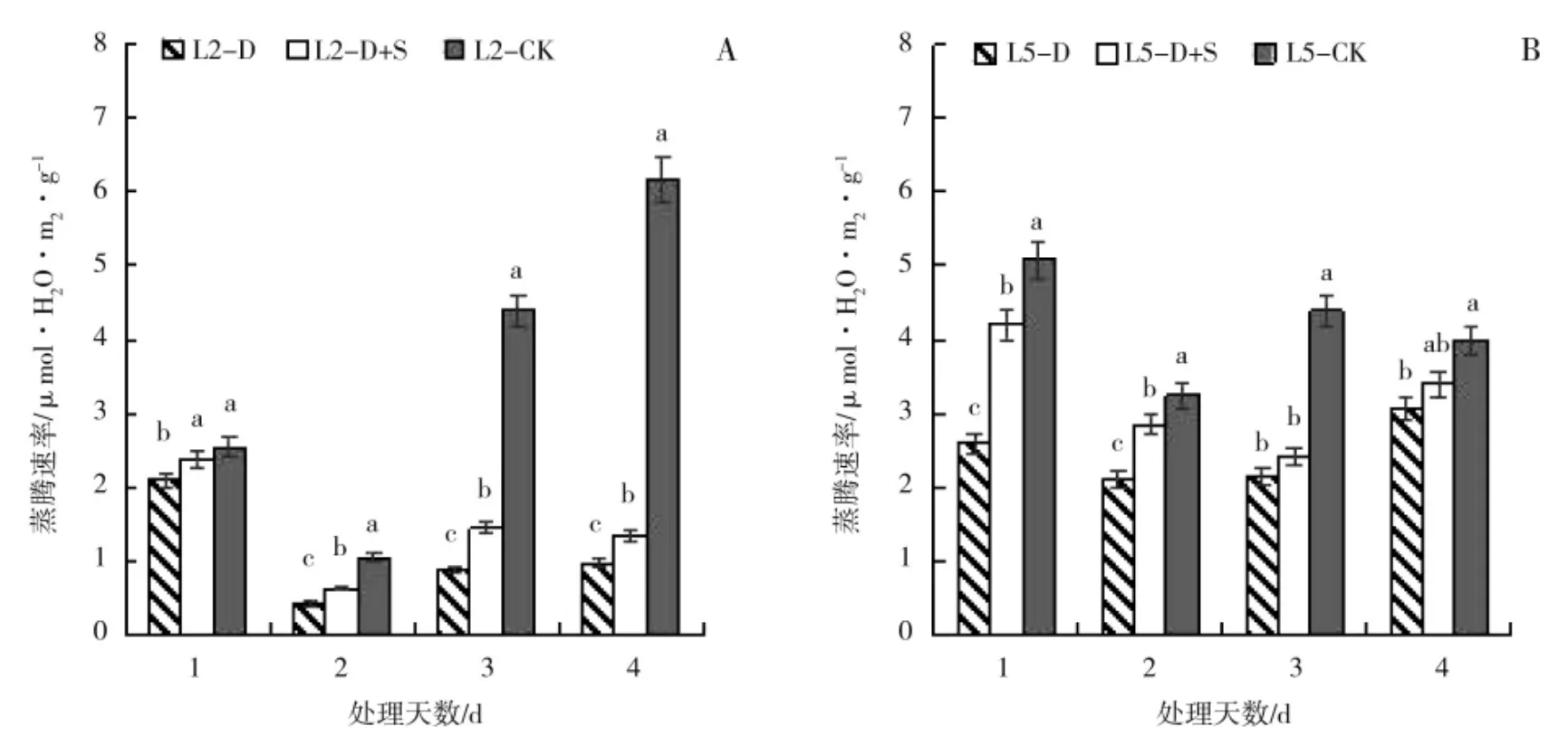
图4 低温胁迫及喷施烯效唑对绿豆叶片蒸腾速率(Tr)的影响Fig.4 Effects of uniconazole on transpiration rate(Tr)of mungbean under low temperature stress
2.3 初花期低温及喷施烯效唑对绿豆叶片保护酶活性和丙二醛含量的影响
2.3.1 对叶片超氧化物歧化酶(SOD)活性的影响
由图5 可知,绿豆低温胁迫及S3307 处理后,叶片SOD 活性整体呈逐渐升高趋势。L2 处理1~4 d时,D 较CK 分别提高12.21%、18.86%、17.80%和19.04%,喷施S3307 较低温胁迫相比提高了SOD 活性,处理1~3 d 时,D+S 较D 分别显著提高5.05%、2.70%和4.95%。L5 处理1~4 d 时,D 较CK 分别显著提高了18.14%、17.69%、6.44%和9.67%,低温胁迫下喷施S3307 能有效提高L5 的SOD 活性,处理1~4 d时,D+S 较D 分别显著提高了6.85%、7.30%、7.75%和8.24%。
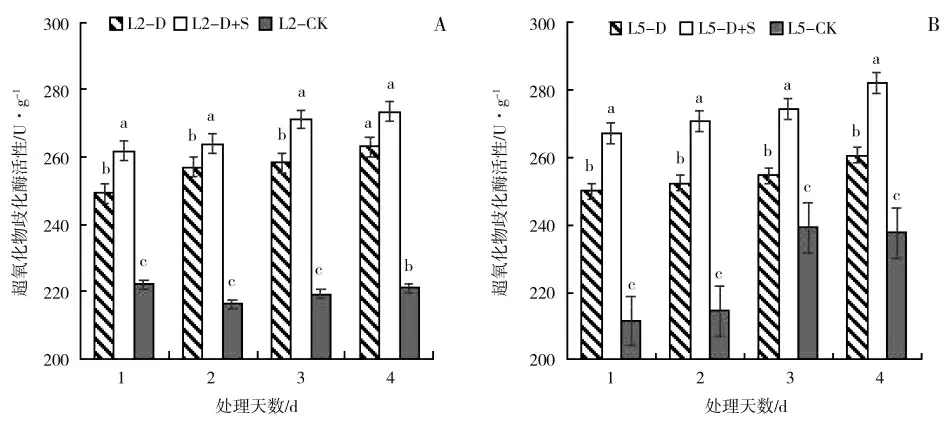
图5 低温胁迫及喷施烯效唑对绿豆叶片超氧化物歧化酶(SOD)活性的影响Fig.5 Effects of uniconazole on superoxide dismutase(SOD)of mungbean under low temperature stress
2.3.2 对叶片过氧化物酶(POD)活性的影响
由图6 可以看出,绿豆叶片POD 活性随着胁迫时间的延长而逐渐升高。喷施S3307 可以进一步提高POD 活性。L2 各时期均表现为D+S>D>CK,处理1~4 d 时,D 较CK 分别显著提高了13.03%、17.49%、81.63%和90.64%,D+S 较D 分别显著提高了50.10%、36.28%、37.30%和54.42%。L5 各时期均表现为D+S>D>CK,处理1~4 d 时,D 较CK 分别显著提高了27.61%、28.03%、59.55%和82.67%,处理1、4 d,D+S 较D 分别显著高出14.62%和78.91%。
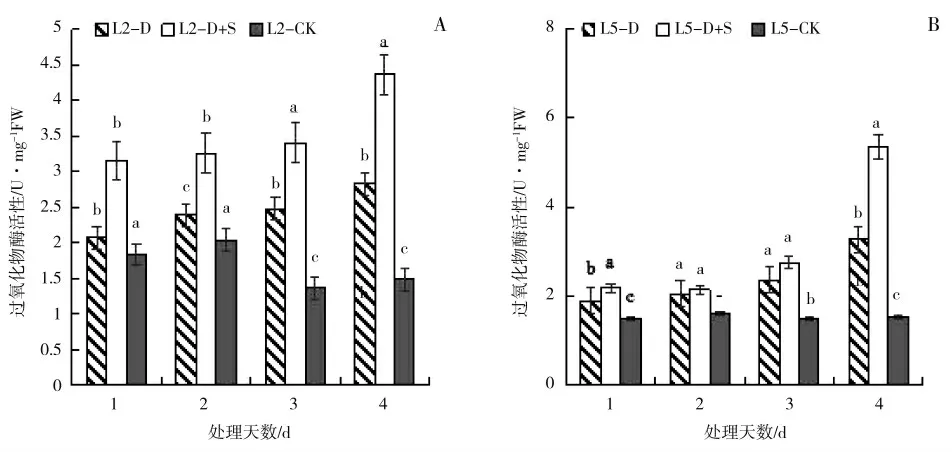
图6 低温胁迫及喷施烯效唑对绿豆叶片过氧化物酶(POD)活性的影响Fig.6 Effects of uniconazole on peroxidase(POD)of mungbean under low temperature stress
2.3.3 对叶片过氧化氢酶(CAT)活性的影响
由图7 可以看出,初花期低温及喷施S3307 处理后,L2 和L5 的CAT 活性随胁迫时间的延长逐渐升高。L2 处理第1~3 天,D 较CK 显著高出8.33%、4.88%和8.69%,处理1~4 d,D+S 较D 显著高出11.11%、19.51%、17.39 和16.67%。L5 处理第4 天时,D 较CK 显著高出33.33%,D+S 较D 显著高出20.00%。
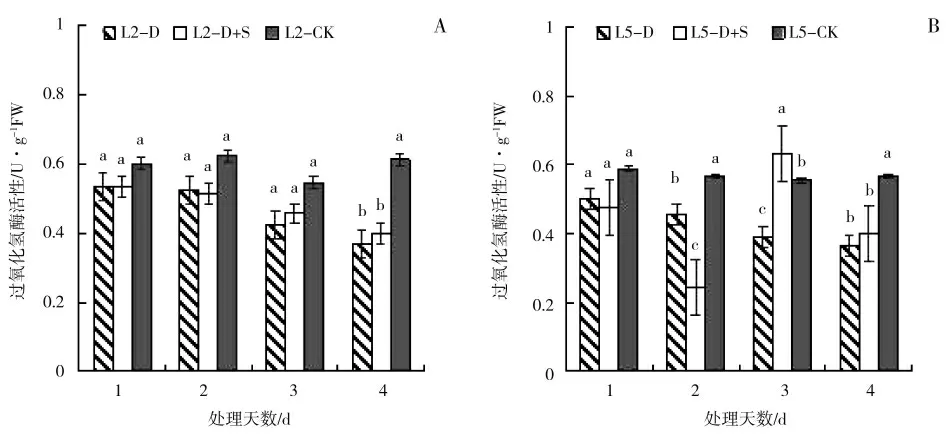
图7 低温胁迫及喷施烯效唑对绿豆叶片过氧化氢酶(CAT)活性的影响Fig.7 Effects of uniconazole on catalase(CAT)of mungbean under low temperature stress
2.3.4 对叶片丙二醛(MDA)含量的影响
由图8 可以看出,初花期低温胁迫后,绿豆叶片MDA 含量总体呈上升趋势。绿丰2 号和绿丰5 号均表现为低温胁迫显著高于对照处理。喷施S3307 能明显缓解低温胁迫下MDA 含量的提高。L2 处理第1~3 天时,D+S 较D 分别显著下降9.54%、41.78%和19.81%。L5 处理第4 天时,D+S 较D 处理显著下降20.97%。
2.4 初花期低温及喷施烯效唑对绿豆籽粒产量的影响
由表5、6 可知,初花期低温胁迫引起绿豆单株荚数、单荚粒数降低并导致产量下降。方差分析结果表明,两绿豆品种结果基本一致。L2 处理1~4 d,D均显著低于CK,单株产量分别降低13.31%、21.66%、28.50%和58.25%。L5 处理1~4 d 时,D 均低于CK,单株产量分别显著降低8.53%、19.50%、32.61%和46.60%。S3307 可一定程度缓解单株荚数、单荚粒数的降低并提高产量,绿丰2 号处理1~4 d,D+S 均显著高于D 处理,单株产量分别显著提高8.06%、12.13%、6.36%和20.12%。绿丰5 号处理第1、3 天时,D+S 与D 之间差异不显著;处理第2、4 天时,单株产量分别显著提高13.42%和10.65%。
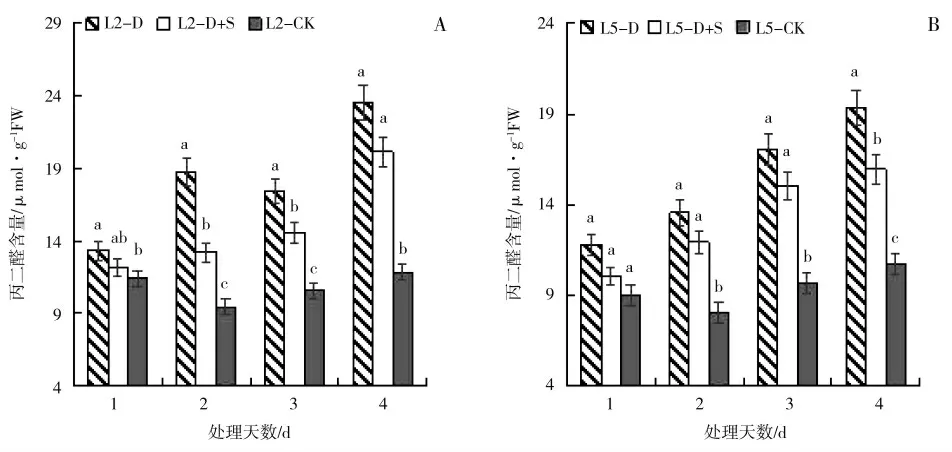
图8 低温胁迫及喷施烯效唑对绿豆叶片丙二醛(MDA)含量的影响Fig.8 Effects of uniconazole on malondialdehyde(MDA)of mungbean under low temperature stress
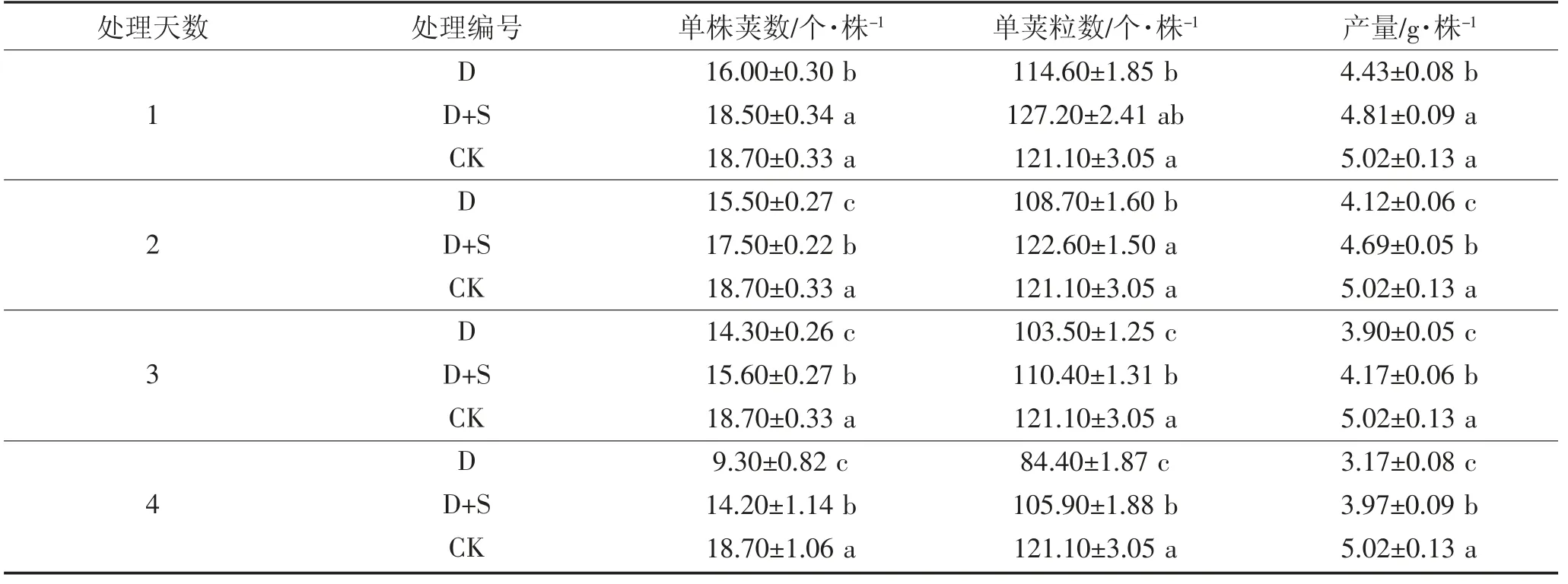
表5 低温胁迫下喷施烯效唑对绿丰2 号产量及产量构成因素的影响Table 5 Effects of uniconazole on yield and yield components of LvFeng 2 under low temperature stress
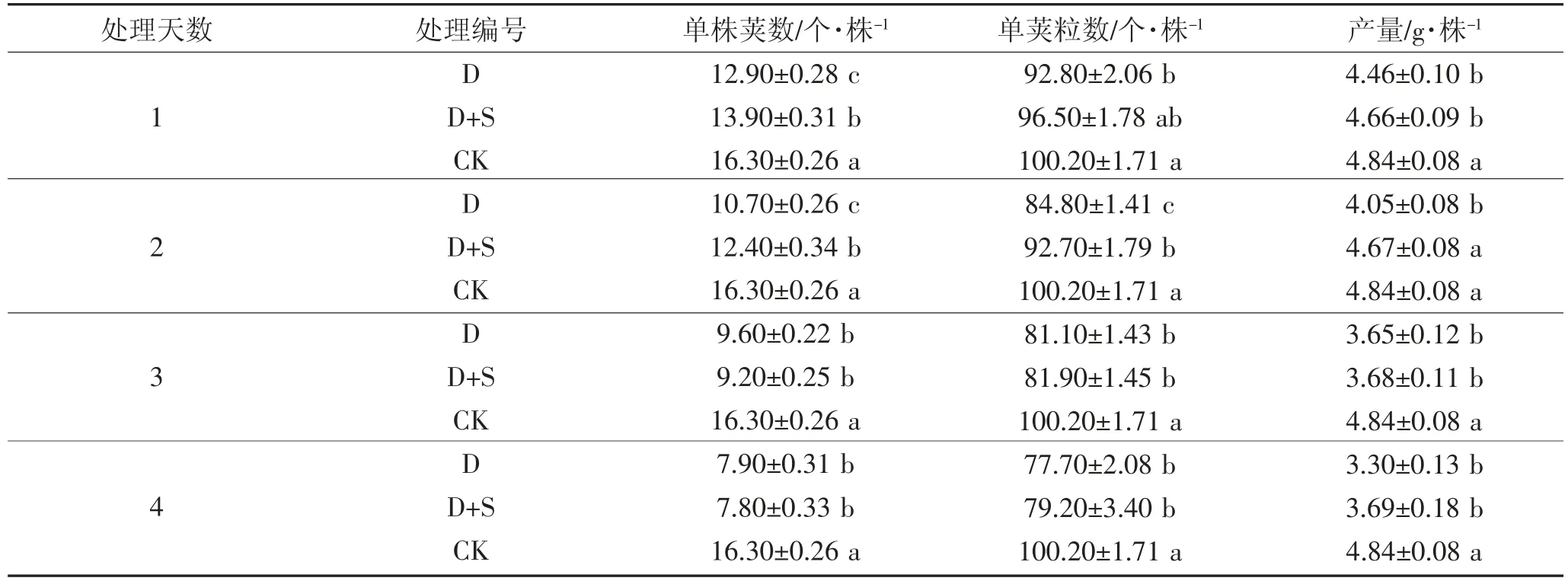
表6 低温胁迫下喷施烯效唑对绿丰5 号产量及产量构成因素的影响Table 6 Effects of Uniconazole on yield and yield components of LvFeng 5 under low temperature stress
3 讨论
低温胁迫会影响植物的生长和生理代谢,并且随着胁迫时间的延长,对植物的损害程度持续加深。叶绿素是作物生长发育进程中重要的光合色素[15],叶绿素含量的变化是植物响应低温胁迫较为敏感的一项指标,它能有效体现植物光合作用的强弱以及叶片衰老程度[16]。丙二醛(MDA)是用于检测植株膜脂过氧化程度的一个重要指标[17],MDA 含量的高低可以体现绿豆抵抗低温能力的强弱[18]。绿豆在初花期将叶绿素含量和光合速率维持在一个较高水平对提高作物产量有重要意义[19]。试验结果表明:绿豆在初花期进行低温胁迫会使其体内叶绿a、叶绿素b、总叶绿素、类胡萝卜素等光合色素含量降低、MDA 含量增加。这与陆新华等[20]的研究结果相似。在逆境条件下喷施S3307 可有效缓解冷害胁迫对植株的伤害。前人研究发现[21-22],低温条件下,S3307 处理可以增加小豆叶片的叶绿素含量,降低小豆叶片的MDA 含量,减轻低温胁迫对小豆叶片细胞膜的伤害。研究发现,低温胁迫下,S3307 处理可明显提高绿豆叶片的叶绿素含量,降低MDA 含量,缓释绿豆叶片的膜脂过氧化反应,从而促进冷害胁迫条件下绿豆正常的生理代谢,这也是S3307 增强绿豆植株耐寒性的原因之一。
植株在正常生长条件下的光合作用是由其内源特性所决定的[23],但胁迫条件会干扰植物的内源特性从而引起光合作用效率的降低。而外源喷施S3307可以减轻胁迫对植株的伤害,并保持植株正常的光合作用活性。研究发现,与低温胁迫处理相比,喷施S3307后能显著提高绿豆的Ci、Pn和Tr。有研究发现[24-25],在中度的非生物胁迫条件下,植物净光合速率的下降是仅由气孔限制引起的,而在严重的非生物胁迫条件下,植物的净光合速率的下降是由气孔和非气孔因素共同限制的结果。研究发现,低温胁迫下喷施S3307 后各处理较低温胁迫处理气孔导度未达到显著差异,分析由于试验的低温胁迫达到了重度低温胁迫水平,因此S3307 对于光合作用的调控极有可能集中在非气孔限制因素上,对气孔导度仅有小部分调控作用,且不显著。
植物的抗氧化酶系统具有很强的抗氧化能力,可以有效清除自由基,抵抗低温胁迫条件下ROS 的毒害作用。有报道指出[26-27],在逆境情况下作物的抗氧化酶活性显著降低。还有研究表明[28],S3307 能提高植物的SOD、POD、CAT 活性,说明S3307 可以在逆境条件下提升作物抗氧化酶活性进而增强作物抗逆性。试验发现,与CK 相比,喷施S3307 后绿豆体内的SOD、POD、CAT 活性均有不同程度的提高,且效果显著,这说明S3307 能够激活植物的抗氧化系统,减轻或防止植物体受到ROS 损伤。
在逆境胁迫条件下,作物的产量因子会有不同程度的变化。研究结果表明,初花期低温胁迫显著降低了绿丰2 号的单株荚数和单荚粒数,产量显著降低了13.31%~58.25%。前人研究发现[29],在大豆始花期喷施S3307 后会增加大豆的单株荚数和单荚粒数并提高产量。试验在喷施S3307 后均能显著提高低温条件下绿丰2 号和绿丰5 号的产量,但对两品种的调控效应不同,在低温胁迫下,L2 在S3307 处理后能显著提高单株荚数、单荚粒数,最终增产;由于L5品种对逆境条件并不敏感,所以L5 在S3307 处理后仅对单株荚数效果显著。试验结果在一定程度上能说明绿丰2 号在低温胁迫下的减产率高于绿丰5号,同时S3307 对低温胁迫下L2 的调控效果优于L5。有关喷施S3307 缓解缓解低温胁迫下绿豆的非酶抗氧化剂含量、细胞结构、以及相关耐寒基因启动和表达调控等生理和分子机制还需进一步研究。
4 结论
初花期低温胁迫引起绿豆叶片内MDA 含量显著增加,增强SOD、POD、CAT 活性,同时显著降低绿豆的叶绿素含量、显著降低光合参数指标(Pn、Ci、Tr),并最终导致绿豆产量下降。喷施S3307 可以有效缓解绿豆的损伤,相对降低了绿豆叶片内MDA 含量;增强绿豆叶片的SOD、POD、CAT 活性;提高了绿豆的叶绿素含量及光合性能,整体提高了绿豆对低温胁迫的抗性,进而减缓了绿豆因低温胁迫造成的产量降低。S3307 处理对不同品种的绿豆调控效应有所不同,但可用于绿豆抗寒生产,缓解低温冷害造成的危害。
