2015—2016 年中国部分地区PBoV 检测及遗传进化分析
2021-05-07许雅茹苏明俊孙东波
许雅茹,苏明俊,孙东波
(黑龙江八一农垦大学,大庆 163319)
猪博卡病毒(Porcine bocavirus,PBoV)是细小病毒科的博卡病毒属下的一种病毒,属于DNA 病毒的一种[1]。可引发猪的呼吸道与消化道感染,使患猪出现与传染性胃肠炎类似的症状,例如猪支气管炎、肺炎、慢性肠胃炎等[1],母猪在怀孕期间感染该病毒后,会出现流产、胎儿死亡等情况[2]。感染该病毒的哺乳仔猪大部分在出生三天左右出现呕吐并严重腹泻、排水样便的症状。成年猪与仔猪在受病毒感染后症状不同,哺乳仔猪主要表现为腹泻,死亡率高达80%左右,成年猪的死亡率较低,但感染率较高[3]。给养猪业造成了严重的影响。根据已经有的报道可以了解,PBoV 大量存在于猪粪便中,部分猪的血液、肺及淋巴组织中可能少量存在,而对于有腹泻、呼吸困难等症状的猪,检查出PBoV 阳性的概率相对较高。PBoV在病猪中的感染率远远高于健康猪,断奶后的仔猪常常同时感染PCV2、PRRSV 和PTTV2[4]。从2009 年以后[5],此病毒广泛地存在于中国和韩国等多个国家和地区,瑞典的研究人员第一次发现了这种病毒。PBoV1 型最开始是在患有PMWS 的仔猪体内发现的,研究人员从仔猪的淋巴组织中提取出了该病毒[6],PBoV2 型最早是在美国发现的,北卡罗来纳州的研究者在病猪的体内发现并提取出了该病毒。从那时起,多种PBoVs 在亚洲、欧洲和美国被发现和研究。自2010 年以来PBoV 在江苏、上海、山东等多个地区被检测到[7-8],并且相关研究人员对这种病毒的全基因组进行测序。在之后的两三年里,越来越多的PBoVs 被发现。Cheng 等[9]在中国发现了PBoV1 型和PBoV2 型的存在,另外两种PBoV3 型和PBoV4 型则由香港学者Lau 等[10]发现并命名,几乎同时北爱尔兰研究人员McKillen 等[11]也分离出该病毒并命名。最近几年在中国猪中发现了一种新型PBoV 并命名为PBoV5。邓波等[12]对于该病毒传播进行了研究,结果发现不同部位的传染率有很大的不同,其中肺部感染的概率最大。且随着研究的深入,邓波等人发现,从感染的猪的血液和粪便中发现该病毒的概率越来越高。根据研究得到不同种类的带毒猪体内含有的病毒量是不同的,不同基因型的PBoV 感染的组织也不完全相同。如PBoV SX 型毒株在组织粪便和血清中均有报道,而另一基因型的毒株在粪便的检出率远远高于肺组织中[13]。该病毒自2010 年在国内初次被发现以来,PBoV 感染猪群的数量越来越多,并且传播范围广泛。Shan 等[8]检测了多地区样品,共搜集300 多份,分析后发现PBoV 阳性概率在45%~75%之间。Liu 等[14]对从五个地区采集的403 份样品进行检测,猪博卡病毒平均阳性感染概率约为12%,其中山东的阳性率最高,其次是河北,辽宁和河南部分地区的感染率较低,天津的感染率最低。Zhai 等[4]对北京、江苏、河北、上海等九个城市的组织样品进行检测,结果显示,有呼吸道症状的断奶仔猪较其他样本更容易被PBoV 所感染。结合上述调查结果可以发现,PBoV 在国内猪场流行较为广泛,阳性率比较高,并且存在几种基因型的混合感染。Zhang 等[15]研究发现猪博卡病毒与PRRSV、PCV2 和CSFV 的共同感染情况广泛存在,这表明PBoV 与多种疾病的发生有一定的联系。因此,通过对PBoV 流行情况的调查可为该病的进一步深入研究提供基础。
PBoV 作为一种不含囊膜的单股线状DNA 病毒,从显微镜下可以看到,该病毒的形状为24 面对称体,其直径一般在25~30 nm 之间,单个基因组大小约为5 kb,并且有类似于回文序列所形成的像发夹的构造,存在序列的左右两端[16]。在病毒中,能够进行编码的基因存在于三个开放式的阅读框中,分别是ORF1、ORF2 和ORF3,这三个阅读框分别对病毒的结构蛋白和非结构蛋白进行编码,PBoV 病毒中的ORF1 和ORF3 分别对NS1 和NP1 非结构蛋白进行编码,而ORF2 则对结构蛋白VP1 和VP2 进行编码[18]。在研究中发现,当机体中出现NS1 蛋白的缺失,机体中人博卡和犬博卡病毒的复制能力会表现为显著低下,甚至造成病毒的复制能力丧失。NP1 基因的功能尚未明确,有报道说明,犬博卡病毒被NP1 蛋白影响了复制能力,其中主要的抗原基因有VP1、VP2 基因,由于VP1 在N 端比VP2 多出一段氨基酸组成的区域,所以VP2 成为截短蛋白[11]。就当前的报道来看,随着病毒基因组与日俱增的被扩增特定基因、测序,发现猪博卡病毒的基因序列间有较大不同,而且基因型类别很多,到现今为止尚未有公认或统一的基因分型方式。最开始,经过氨基酸和核苷酸序列构建进化树详细分析,将猪博卡病毒分为三个支系。之后有关研究以VP1 基因作为病毒分类的标准,将PBoV 分为四个基因型。之所以是用VP1 基因作为分类标准是因为VP1 基因编码的病毒蛋白对病毒的组织嗜性起决定作用并且对病毒的致病性产生了影响。这种分类办法曾经得到了一致同意。近几年,根据国际病毒分类委员会依据NS1 核苷酸同源性的研究发现,可以将PBoV 的类型进行重新划分,共可以分成5 个基因型[19-21]。我国国内也有很多学者对PBoV 的类型进行研究,根据其全基因组序列的遗传演化情况,将其划分为7 个基因型[22]。
研究通过普通PCR 方法,对2015—2016 年华东地区采集的仔猪腹泻样品进行PBoV 检测,并对该病毒在华东地区流行情况及基因型进行分析,为PBoV的流行情况和遗传进化情况提供基础数据,也为该病毒在我国的预防提供了可参考数据。
1 材料与方法
1.1 材料
1.1.1 样品采集
样品是从我国6 个地区(山东、江苏、福建、上海、安徽、江西)的腹泻病猪粪便样品共计89 份。标记采集地点、时间,放置于-80 ℃冰箱内备用。
1.1.2 仪器设备

表1 仪器设备Table 1 The detail information of machines
1.1.3 主要试剂

表2 主要试剂Table 2 The detail information of reagents
1.1.4 引物设计
引物序列引用于已发表文献[23],提交至相关公司合成并使用。引物具体信息见表3。
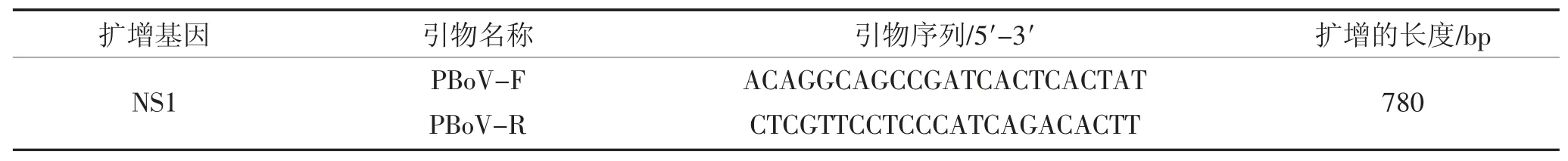
表3 PBoV NS1 基因引物序列Table 3 Primers for the amplification of PBoV NS1 genes
1.2 方法
1.2.1 样品处理及病毒DNA 的提取
(1)取粪便200 mg 左右放入2 mL 的EP 管中,并将管放置在冰上。(2)分别向管中加入500 μL SA、100 μL SC、15 μL Proteinase K。(3)将样本试管放在涡旋仪中振荡15 s,然后将离心机调到12 000 转离心;将离心后的上清液取出加入到另一个EP 管中,向其中加入10 μL RNanase A,将EP 管置于室温中静置5 min。(4)加入适量SH,将上清液与SH 混合均匀后再次置于冰上静置5 min,然后置于12 000 转的离心机中离心3 min。(5)将再次得到的上清液取出加入EP 管中,然后加入与上清液体积相同的加入异丙醇的GFA。(6)将所得溶液放到柱内,12 000 转,短暂离心,弃掉废液。(7)向GD 溶液中加入无水乙醇,然后将混合后的溶液与离心液混合,再次在12 000转速下离心30 s,去除底部液体。(8)添加定量漂洗液体,短暂离心,去除底部离心出的液体。(9)将(8)反复一次。(10)重新放到管里,12 000 转,瞬时离心,去掉底部液体,将吸附柱放置于规定温度,约2 min左右。(11)把柱放到新样品管中,往膜正中位置滴入20~30 μL 液体,使DNA 溶入液体方便洗脱下来,室温搁置柱内膜略干后,离心适当时间,保存离心管中液体(-20 ℃)。
1.2.2 NS1 基因扩增
取出PCR 反应所需试剂(试剂应在-20 ℃环境中保存),放置于室温待其自然融化。(25 μL PCR 反应体系详见表4,反应条件见表5)。将表中各成份根据反应体系依次混合均匀,加入PCR 管中,离心后放入PCR 仪。

表4 PCR 反应体系Table 4 PCR reaction system
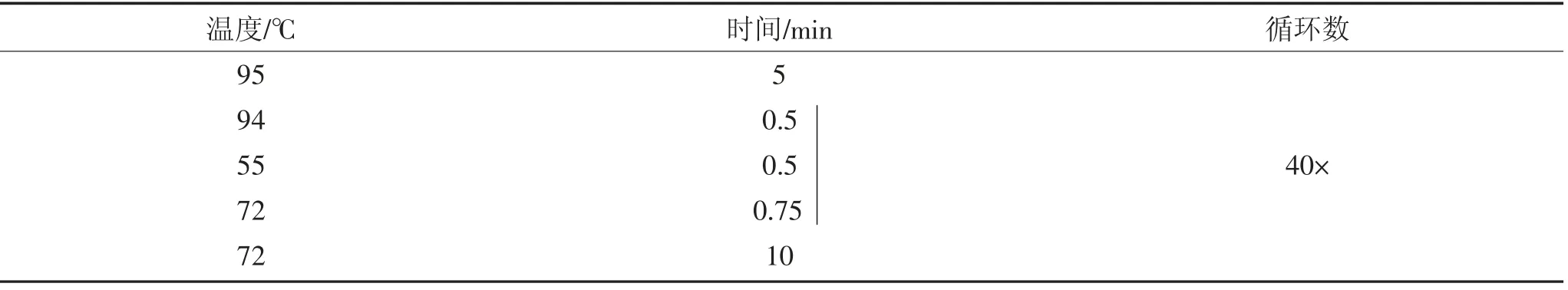
表5 PCR 反应条件Table 5 PCR reaction condition
1.2.3 目的基因的克隆及测序
1.2.3.1 目的基因纯化
(1)通过PCR 仪器处理后,将产物经由电泳,得到所需琼脂糖凝胶,通过紫外光线照射,去除多余凝胶后,切碎,塞入准备好的离心管中,并记录目的片段凝胶重量。(2)向吸附柱CB2 中添加溶液,适量BL,离心,去除管底部液体,将处理好的柱重新置于管内。(3)称重后的琼脂凝胶放入离心管中,向其中加入与凝胶体系相同的PC,融合混合后置于50 ℃的环境中隔水加热8 min,上下匀速摇晃,溶解胶块。(4)将上步所得溶液放入平衡柱中,12 000 转,短暂离心,除去液体。(5)添加定量PW(提前加入规定量无水乙醇),离心后将管中的杂物清除。(6)再次重复该操作。(7)将之前清除的液体再次加入管中,离心,尽量将漂洗液体清除干净,把柱子放在合适温度,直到完全晾干。(8)将柱子放在全新样品搜集管中后,膜中央位置加入适量液体,进行洗脱,适当温度放置液体与膜充分融合,放入离心机离心,收集产物,并且标记地点、时间,妥当保存(-20 ℃)。
1.2.3.2 NS1 基因片段克隆
将胶回收产物与T 载体进行连接,根据连接体系(见表6),按顺序滴加到管底部,放入接仪,连接16 h(16 ℃)。将10 μL 按顺序添加好的连接产物中加入感受态细胞(50 μL DH-5α),混匀,放到含有冰水混合物的盒内,放到4 ℃环境下,在冰水混合物中,约30 min;之后迅速隔水加热约1 min(42 ℃),加热后,再次放入冰水混合物中,约2 min;向其中添加1 mL 的SOB,摇晃均匀;溶液放置在摇床上,转速190 r·min-1,温度37 ℃,约45 min;将溶液取出,置于5 500×g 的转速中离心5 min,将上清液去除;剩余溶液放置在操作台中(超净),去除200 μL 留存,其余溶液涂在琼脂糖固体培养基上并将其放置在培养箱中,温度设置为37 ℃,培养12~16 h。从其中选择适量的单菌落,在每个平板中放置约5 个左右的菌落,对这些菌落的PCR 进行检测,然后用1%的琼脂糖凝胶电泳进行阳性或阴性鉴定;取出1 mL 的阳性菌落进行测序,然后将剩余阳性菌落放在培养基中进行培养,经由公司对菌液进行处理,得出结果。剩余菌液按9∶1 加入甘油共1 mL,-80 ℃保存。

表6 连接反应体系Table 6 Connection reaction system
1.2.4 同源性及系统进化树构建分析
为了对PBoV 的遗传演化有更清晰的认识,研究将成功测序所得毒株与参考毒株用Lasergene DNASTARTM5.06 进行比对,并对其同源性进行分析。遗传演化结果经由NJ 法制作得到,利用MEGA 6.0,进化树的构建采用p-distance 模型。
2 结果
2.1 PBoV NS1 基因扩增结果
通过PCR 方法对采集的89 份样品进行PBoV检测,扩增得到大小约780 bp 的片段,与预期大小相符(见图1)。
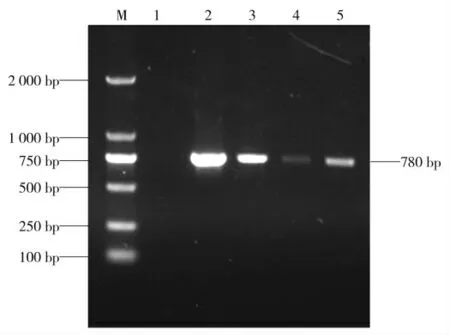
图1 NS1 基因扩增结果Fig.1 The amplification of the PBoV NS1 genes
2.2 菌落PCR 扩增结果
将挑选出的单个菌群进行PCR 验证时,需要保证该菌落中含有NS1 基因的阳性质粒(图2)扩增片段与目的片段相符约为780 bp。
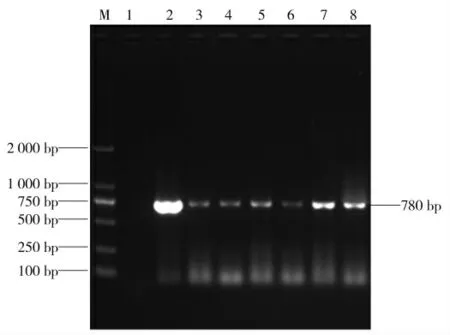
图2 菌落PCR 结果Fig.2 The result of individual bacterial colonies PCR
2.3 中国部分地区PBoV 分布情况
根据PCR 检测结果,所有的89 份检测样本中,检测出PBoV 的样本共42 分,约占比47.19%;在所有6 个地区的检测为阳性样本中,山东、江苏、福建、上海、安徽、江西地区阳性数量分别为9、2、7、9、6、9,分别占当地检测总样本数量的37.5%、40%、41.18%、56.25%、54.55%、56.25%(见图3)。
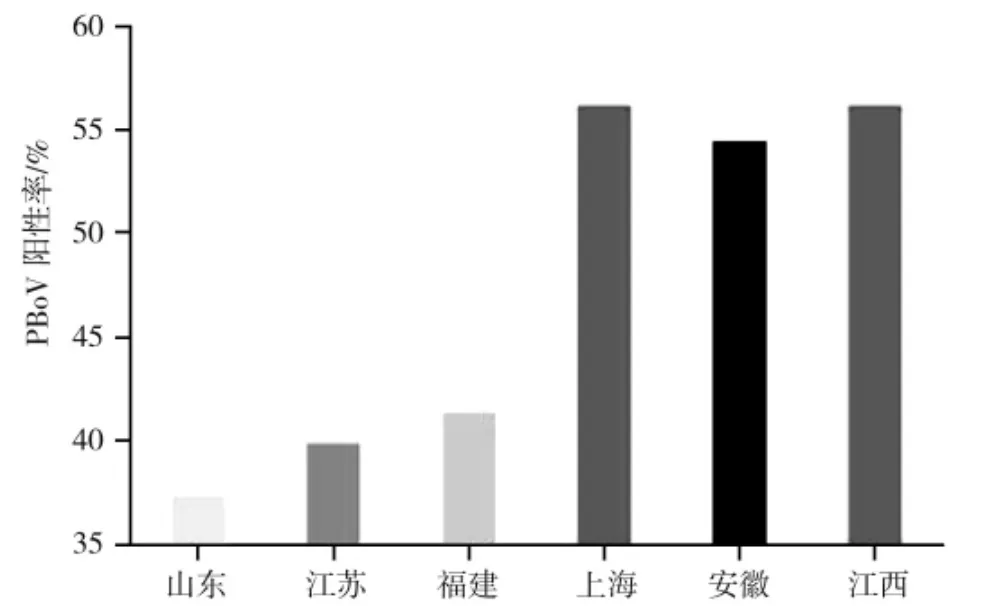
图3 中国部分地区PBoV 检测结果Fig.3 The results of PBoV in parts of China
2.4 同源性及遗传进化分析
对鉴定为阳性的PCR 产物进行克隆和测序,并将所得结果经过处理上传至GenBank,具体信息(见表7)。
基因序列分析结果显示,这5 株PBoV 的核苷酸同源性达到了80.0%~85.6%,因此,可以预测其氨基酸的同源性在82.9%至87.9%之间。且鉴定的5 株P BoV 均属于PBoV 3 型,并且被进一步划分为了3 个分支(G3a、G3b、G3c)。与PBoV 1 型和2 型参考毒株相比,核苷酸同源性和氨基酸同源性较远(见图4、5)。
通过MEGA 6.0 软件对试验鉴定的PBoV 毒株和GenBank 数据库中选择的15 个毒株进行对比,利用NJ 法建立了遗传基因树进行遗传基因分析,分析结果显示:试验鉴定的PBoV 与PBoV 3 型参考毒株构成一个大分支,基于系统演化分析,鉴定所得序列分布在PBoV 3 型的3 个亚型中:PBoV G3a、G3b 和G3c 中,其中MH822023、MH822025 属于G3a 分支,MH822024、MH82022 属于G3b 分支,MH82026 属于G3c 分支(见图6)。

表7 部分地区PBoV 流行毒株信息Table 7 PBoV isolates obtained in some areas

图4 NS1 基因核苷酸同源性分析Fig.4 Nucleotide homology analysis of NS1 genes

图5 NS1 基因氨基酸同源性分析Fig.5 Amino acid homology analysis of NS1 genes
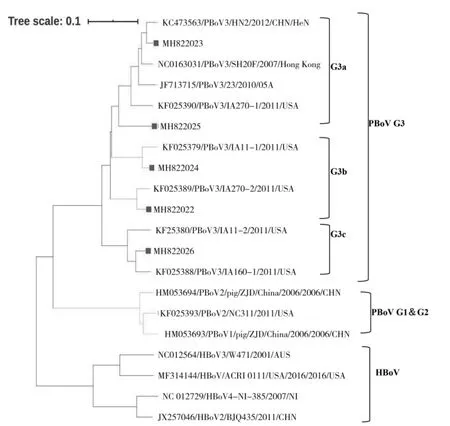
图6 NS1 基因系统进化树Fig.6 Phylogenetic tree of PBoV NS1 genes
3 讨论
当前,国内PBoV 流行情况比较复杂。在不同省份,PBoV 感染率从7.3%到64%不等,具体取决于感染是发生在仔猪,成年猪还是健康或患病的猪上[24]。Shan 等[8]研究了从多地搜集的健康样品,共有300 多份,发现该病毒感染率约在50%到80%之间。Liu 等[17]检测了五个省区的所有样品,发现总感染率在11%左右,其中山东的感染率最高,其次是河北,天津的感染率最低为。Zhai 等[4]检测了九个城市所采集到的组织样品,发现PBoV 的感染率大约在12%到90%之间。Zhang 等[25]根据现有数据发现PBoV 的地理分布主要位于中国的东部和南部沿海地区以及美国的中部各州,江苏省和明尼苏达州是PBoV 高发频率的中心。Meng 等[26]对新疆地区156 份仔猪进行PCR 检测,结果发现其中约有5.77%的仔猪感染了PBoV 病毒,并且同时患有其他疾病的仔猪的感染率明显较高。研究中PBoV 感染率与Shan 和Zhai 研究结果大致相符[4,8]。
根据感染率结果发现,山东地区PBoV 感染率最低,而上海和江西两个地区感染率最高。推测可能有以下原因:
(1)环境因素:PBoV 对生存环境的需求不同。据相关资料报道,PBoV 在冬季与春季气温骤变时节感染率较高[27],其他季节感染率相对较低。
(2)样品采集:研究采集的样品较少,未能全面覆盖搜集样品的地区,且不同地区样品采集数量和时间均不同,采集猪场规模差距较大,部分地区只在单一猪场采集样品,导致不同地区结果差异较大。
随着猪群感染数量的不断增多,发现PBoV 的感染过程非常复杂,Xiong 等[28]研究表明鼠类啮齿动物可以作为PBoV 的天然宿主,这一结果表明鼠类啮齿动物在PBoV 传播中具有潜在作用。因此,对防治普通鼠类中由啮齿动物传播所引起疾病的预防和控制应该引起更多重视。当前,对于PBoV 的传播方式,发病原理没有更深层次的了解。目前对猪博卡病毒的理解和分析依然在表面,个体感染通常没有明显的临床症状,而PBoV 的共感染可以使临床症状更加明显[29],因此很难区分PBoV 的独特致病性以及与其他共同感染病毒的致病性。随着源源不断的全基因组序列被研究人员检测、分析,发现PBoV 的遗传呈现多种类型,由此推测可能与基因序列的改变有很大关系,现阶段主要是通过研究病毒形态结构以及核苷酸序列的同源性比对和进化树的分析研究PBoV的遗传演化。试验测序所得的5 个毒株全部属于PBoV G3 型,并且分布于G3a、G3b、G3c 分支中。将测序所得基因序列与参考毒株进行比较,得出结果,PBoV G3a 毒株间的同源性在84.7%至96.1%之间,PBoV G3b 和PBoV G3c 的同源性分别为82.8%~95.3%和91.%~94.6%。PBoV G3 型毒株和G1、G2 型因为分支不同,因此具有较低的同源性,且和HBoV的同源性检测显示,两类型毒株的同源性在45%至48%之间,同源性较低。在对MH822025 和KF025390对比发现,两毒株的同源性高达86.6%,MH822023与KC473563 同源性高达96.1%;MH822022 与MH822024 虽然同属于G3b 分支,但是与同源性较高的参考毒株分别独立于小分支。由此推测猪博卡病毒的毒株随着时间在不断变化且变化差异较大,并且同一时期不同地区间毒株也具有明显差异。表明PBoV 在遗传演化过程中可能存在地域差异,可能与不同地区地理位置及气候有关或者与猪场养殖和管理方式有密切关系。
4 结论
通过PCR 方法对我国部分地区89 份猪群粪便样品进行检测以及测序,发现所采集样品的地区均存在PBoV 的流行,根据不同地区间阳性率结果可以得出上海和江西阳性率最高。同时将测序所得5 个毒株与参考毒株经遗传进化树分析可知,5 个毒株被划分为PBoV 3 型分支中,并且5 个毒株与参考毒株的同源性存在较大差异,分别与不同地区、不同年份的参考毒株具有较高的核苷酸、氨基酸同源性。表明PBoV 存在遗传多样性,可能与地区间的气候差异或者猪场的饲养管理方式有关。
