黑龙江省某猪场猪传染性胃肠炎病毒的分离鉴定
2021-05-07颜子涵原冬伟李明月王一孙东波
颜子涵,原冬伟,李明月,王一,孙东波
(黑龙江八一农垦大学动物科技学院,大庆 163319)
猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)感染猪可导致猪患猪传染性胃肠炎(Transmissible gastroenteritis,TGE),是养猪业中常见的猪腹泻疾病,病猪是该病的主要传染源并向环境中扩散和传播病毒,如果该病毒侵入仔猪肠道内便会造成仔猪出现严重的腹泻症状,传播方式是粪-口[1]。患病的仔猪死亡率极高。
TGEV 是单股正链RNA 病毒,包含4 种结构蛋白依次为:纤突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)。S 蛋白是糖基化蛋白位于病毒表面,在病毒的侵入过程中发挥作用[2]。N 蛋白具有高度保守的特点,常作为检测TGEV 的靶蛋白[3]。M 蛋白在病毒粒子装配的过程中发挥作用。像其他冠状病毒一样,共价连接的Poly(A)尾部结构存在于TGEV 基因组的3′端,而帽子结构连接在5′端[4]。TGEV 感染猪主要通过猪的口鼻及黏膜,当外界环境中存在病毒粒子时,病毒从鼻腔进入猪的呼吸系统,在呼吸道的黏膜中繁殖,经血液循环进入猪的消化系统,其中小肠黏膜上皮细胞是病毒主要入侵的部位,宿主细胞的受体被TGEV S 蛋白识别后病毒吸附于小肠黏膜上皮细胞表面,随后通过内吞的方式进入到猪小肠粘膜上皮细胞中[5]。致使其无法发挥其正常生理功能,降低其对营养物质的吸收。猪传染性胃肠炎病毒在猪体内的潜伏期与其生长情况存在密切联系。一般状况下仔猪的日龄较小相应潜伏期就短;相反仔猪日龄越大那么其潜伏期长。新生仔猪从感染到发病通常需要15~20 h,而大型猪则需要2~3 d。这种疾病传播很快,短时间内就可在整个猪群中大面积传播且难以控制。新生仔猪临床症状最明显,通常情况下疾病发生时仔猪突然呕吐出未消化的乳凝块,尤其在仔猪吃完母乳后半个小时呕吐的频率更高,进而出现腹泻现象,起初粪便较少,随后大量排泄水样粪便。腹泻会导致身体脱水,受影响的猪失去食欲,甚至食欲废绝,缺乏能量。而后导致体重减轻和皮毛粗糙。在疾病后期,患病的仔猪因严重脱水和营养不良而体重减轻,体重迅速下降,体温下降而瑟瑟发抖,哺乳仔猪从发病到死亡通常2~5 d[3,6]。少数耐受过后的仔小猪发育迟缓。保育期的猪群主要表现为水样腹泻,体重减轻,由于严重营养不良,饲料转化率低变为僵猪。肥育阶段的猪对该病的抵抗能力更强,临床症状为腹泻、食欲不振、发冷。病情较轻的猪通常都会挤在一起来维持体温,病得严重的猪会全身和肌肉颤抖,严重腹泻,粪便中含有少量未消化固体。与哺乳仔猪比较,育肥猪极少出现呕吐,从发病到转归大概在1 周左右,育肥阶段的猪死亡率较低,但转归后体重减轻[7]。将病死的猪剖检,除严重脱水外,与健康猪相比无明显的区别,小肠是主要的病变组织。小肠肿胀,肠壁透明,肠腔内常常充满大量灰白色或黄绿色内容物。空肠和回肠的绒毛存在不同程度的萎缩或脱落现象,猪肠道绒毛长度和隐窝深浅二者之间的比(VH∶CD)将减小,肠系膜充血和肠系膜淋巴结肿大,表明猪的消化系统遭到了破坏。组织病理学的主要特征是小肠绒毛明显萎缩,小肠黏膜上皮细胞发生病理变化,如:固有结构的丧失,并伴随着空泡变性,坏死的上皮细胞有炎性细胞浸润[1]。
TGEV 于1946 年美国首次报道,随后在一些欧洲国家相继报道,20 世纪60 年代传入我国后对我国养猪业造成巨大损失[1,8]。也有报道TGEV 常与其他肠道病毒混合感染,这可能增加对仔猪的危害[9-10]。目前TGEV 病原学诊断的技术包括:胶体金技术、抗原ELISA 检测和病毒核酸RT-PCR 检测等。TGEV胶体金试剂盒、ELISA 试剂盒可以捕获粪便中的TGEV 抗原,已经在临床中广泛应用[3]。研究人员利用特异性引物对TGEV 基因的目标区域进行扩增,然后在琼脂糖凝胶中进行电泳观察扩增片段。已经有数个TGEV 的传统RT-PCR 检测方法,这些方法现在大多被更为敏感的实时RT-PCR 方法取代[11]。以上方法都能够对TGEV 临床提供快速、准确的检测结果。TGEV 的分离较为困难,选择病毒敏感的分离细胞尤为重要。前人的研究表明,猪甲状腺细胞、猪肾细胞(PK-15)以及猪睾丸细胞(ST)等均可用于TGEV 分离,但是各个细胞系培养TGEV 时适应情况不同。TGEV 在体外感染细胞后,可导致细胞出现细胞核聚集、胞浆有空泡生成,最后细胞脱落,在显微镜下观察细胞呈现拉丝状。TGEV 不耐热,将病毒置于60 ℃的环境中10 min 可使病毒失活。但病毒可在低温条件下长久保存。在光照或有机溶剂等不利因素下,病毒失活较快。因此在分离TGEV 时选用的猪腹泻粪便及肠段应保存于低温环境并避免紫外照射[12]。TGEV 野毒在分离过程中病毒丢失的现象时有发生,也会出现CPE 不明显的现象,一些毒株在分离之初病变轻微,不易察觉。这为病毒的分离培养带来难度。目前实验室常用于TGEV 分离的细胞是PK-15 细胞和ST 细胞,研究人员通过对ST 细胞和PK15 细胞进行TGEV 分离培养,结果表明随着传代次数的增多ST 细胞病毒滴度上升较快且适应性更强[13]。我国学者通过这些细胞系相继分离了一些TGEV,如JS2012,H16,SC-Y 等[14-15]。这些分离株的出现为了解TGEV 的流行病学与该病的防控奠定了一定基础。
研究旨在分离并鉴定黑龙江省TGEV。将黑龙江省齐齐哈尔市某猪场猪腹泻样品鉴定为TGEV 阳性后接种PK-15 细胞并对其培养物进行细胞传代培养,通过细胞病变(cytopathic effect,CPE)、RT-PCR、间接免疫荧光(indirect immunofluorescence,IFA)以及电镜观察等方法对传代细胞毒进行鉴定,最后成功获得了一株TGEV,命名为HQ2016。该毒株的成功分离鉴定对黑龙江省TGEV 流行病学调查提供前期基础,并为进一步研究其致病性,疫苗研发及诊断产品研制提供前期基础。
1 材料与方法
1.1 样品采集与处理
病料取自实验室保存的2016 年黑龙江省齐齐哈尔市某猪场TGEV 疑似粪便及肠段。用剪刀将上述病料剪成小块放入研钵中,缓缓倒入液氮充分混匀将其研磨成细小的粉末状。称量后再加入3 倍样本体积的PBS 溶液,接着利用震荡器持续震荡15 min,4 ℃6 000 rpm 离心15 min,取上清液直接进行病毒RNA 提取或保存于-80 ℃。
1.2 引物设计
引物参考GenBank 中登陆的TGEV JS2012 株(KT696544.1)针对N 基因设计巢式RT-PCR 引物,引物由哈尔滨擎科生物技术有限公司合成。
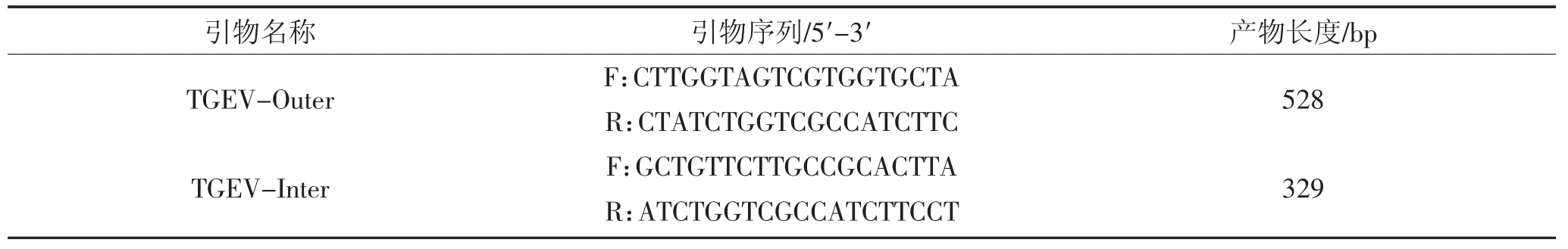
表1 引物序列Table 1 Primer sequences
1.3 主要试剂及设备

表2 主要试剂Table 2 The detail information of reagents

表3 主要仪器Table 3 The detail information of machines
1.4 病毒RNA 提取与cDNA 合成
按照病毒RNA 提取试剂盒操作指导提取病毒RNA。反转录体系:RNA 2 μL,随机引物0.5 μL,Buffer 2 μL,RNA 酶抑制剂(40 U·μL-1)0.25 μL,dNTP(10 mol·L-1)1 μL,反转录酶(200 U·μL-1)0.5 μL,随后在反应体系内加入ddH2O 将体积升高到10 μL。将上述液体放置在42 ℃水浴锅中持续30 min,最后将液体迅速取出并放入70 ℃水浴锅中抑制其继续反应。反转录成功后的cDNA 直接用于巢式RT-PCR鉴定或保存于-80 ℃冰箱。
1.5 样品巢式RT-PCR 检测
反应条件:95 ℃预变性5 min,95 ℃变性30 s,54 ℃退火1 min,72 ℃延伸1 min,上述步骤反复操作30 遍;接着在72 ℃环境下再延伸5 min。内套扩增反应的退火温度为56 ℃,其他条件不变。最后收集内套PCR 扩增产物,放置到浓度是1%的琼脂糖凝胶里进行电泳分析,最后通过凝胶成像设备查看,同时记录最终的结果。
1.6 病毒的分离培养
将TGEV 阳性样品研磨过滤后加入磷酸盐缓冲液(PBS)中10 倍稀释。放置于4 ℃的离心机里面持续10 min,接着量取上清液通过0.22 μm 的滤膜过滤后接种于生长状态良好,长满单层的PK-15 细胞中,加入0.3%浓度胰酶的DMEM 放入37℃、5% CO2培养箱处理1.5 h,缓缓倒掉培养瓶中液体,加入适量10%胎牛血清培养液37 ℃培养,没有接种上述样品的PK-15 细胞为阴性对照。观察细胞状态直至出现细胞病变,对未出现病变的细胞经3 次冻融循环后继续接种,连续盲传直至出现稳定的细胞病变,当观察到80%细胞病变时,将上清液和细胞进行3 次冻融循环。在1 500×g 离心15 min,收集上清液在-80 ℃下储存。
1.7 RT-PCR 病原特异性鉴定
提取第15 代分离毒的病毒RNA 并反转录成cDNA 进行TGEV 巢式RT-PCR 扩增,并通过实验室已建立的方法对上述cDNA 进行PEDV 与PDCoV 的RT-PCR 特异性扩增,产物于浓度为1%的琼脂糖凝胶电泳中检测,凝胶成像分析仪下观察并保存结果[16-17]。
1.8 间接免疫荧光试验
分离毒接种PK-15 细胞48 h 后。经多聚甲醛溶液处理30 min,用PBS 溶液清洗细胞3 次;接着在所有孔当中滴注0.2%细胞穿孔溶液Triton X-100 250 μL持续10 min 之后将残余液体倒掉,然后用PBS 溶液对细胞进行3 次清洗;接着在所有孔当中滴注250 μL 的0.3% BSA 来封闭非特异性抗原,然后在37 ℃密封环境下静置30 min,随后用PBS 溶液对细胞进行3 次清洗;接着在所有孔当中滴注1∶800 倍的TGEV N 蛋白单克隆抗体,随后放置于室温环境作用1 h,然后用PBS 溶液对细胞进行3 次清洗;接着在所有录入孔当中滴注1∶200 倍稀释的FITC 标记的山羊抗小鼠荧光抗体,进行IFA 鉴定。
1.9 电镜观察
取第15 代分离毒,接种于PK-15 细胞48 h 出现CPE 后,在生物安全柜中收集培养液和PK-15 细胞于一个干净的EP 管中,经3 次冻融循环,通过离心以收取上层液体。接着将上层液体置于5 000 rpm的离心机上持续30 min,收集上清液,把前面收集的液体置于离心机中15 000 rpm 并且设置温度为4 ℃,持续离心2 h。收取离心管中的沉淀通过酸碱度为7.0 的溶液来进行悬浮,然后磷钨酸负染电镜进行结果观察。
1.10 病毒TCID50 计算
病毒液按照10 倍的比例进行逐一稀释,然后将获得的液体接种在长满PK-15 细胞的96 孔细胞培养板当中,同步设置对照组。把上述培养板摆放到温度为37 ℃的细胞培养箱里面静置,观察产生CPE 的孔数。根据Reed-Muench 法计算第15 代病毒的TCID50[18]。
2 结果
2.1 样品巢式RT-PCR 鉴定结果
为了确定分离样本是TGEV 阳性,我们将实验室保存的腹泻样品剪碎研磨处理后,经过RNA 提取和反转录后,进行巢式RT-PCR 鉴定,结果(图1)表明,出现了与预期长度相符的目的片段,证明分离样品准确。

图1 腹泻样品TGEV N 基因巢式RT-PCR 扩增结果Fig.1 The induced for TGEV partial N gene by nest RT-PCR
2.2 病毒分离CPE 观察
将TGEV 阳性病料接种于PK-15 细胞。结果(图2)显示,盲传15 代48 h 时PK-15 细胞出现明显的CPE。而未接毒的细胞状态良好。
2.3 RT-PCR 病原特异性鉴定结果
为了从核酸角度验证分离毒是TGEV,我们将第15 代分离毒通过巢式RT-PCR 鉴定,利用TGEV N 基因内、外套特异性引物,扩增N 基因片段。结果(图3)显示,出现的片段与预期大小相符。其他猪腹泻病毒均为阴性。说明只有TGEV 在PK-15 细胞中得到了增殖。
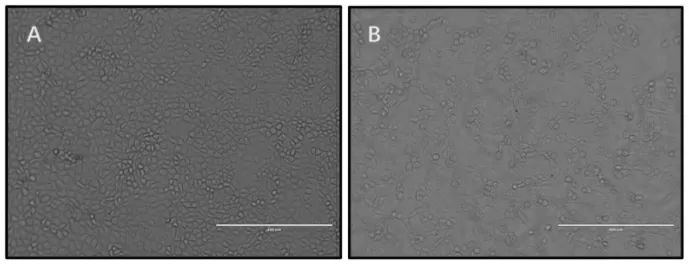
图2 PK-15 细胞感染TGEV(P10)后出现CPEFig.2 CPE on PK-15 cells infected with the TGEV(P10)

图3 TGEV(P15)的巢式RT-PCR 鉴定Fig.3 Identification of the TGEV(P15)isolate by nested RT-PCR
2.4 IFA 鉴定结果
随后我们通过IFA 试验鉴定分离毒是TGEV,选择第15 代分离毒进行验证。利用TGEV N 蛋白鼠源单克隆抗体作为一抗,正常培养的PK-15 细胞为阴性对照。结果(图4)显示,接毒组出现明显荧光信号,而对照组未见荧光信号。
2.5 电镜观察结果
为进一步观察分离毒的形态特征,我们通过对TGEV 第15 分离毒代扩大培养,超速离心,沉淀物经负染后电镜下观察,如图5 可以看见病毒粒子周围有一圈类似花冠的典型冠状病毒结构,在视野中央病毒粒子呈不规则的椭圆形,直径约100 nm。将研究分离毒命名为TGEV HQ2016。

图4 TGEV(P15)感染PK-15 细胞的IFA 鉴定Fig.4 Identification of the isolate in PK-15 cells by IFA
2.6 病毒TCID50 计算结果
对盲传15 代的分离毒进行10 倍稀释并接种在长满单层PK-15 细胞的96 孔板中,如表4,第3 天CPE 的孔数趋于稳定,根据Reed-Muench 法公式计算病毒TCID50为10-5.25/0.1 mL。

图5 TGEV(P15)电镜观察结果Fig.5 Observation of TGEV(P15)by electron microscopy

表4 病毒滴度(TCID50)计算Table 4 Calculation of virus titer by TCID50
3 讨论
由于冠状病毒能够引起哺乳动物及禽类发病,进而造成经济损失。TGEV 与PEDV 均是α-冠状病毒中的成员,这两种疾病也是目前引发仔猪病毒性腹泻的主要病原[19]。TGEV 仅一种血清型,前人研究表明,猪呼吸道冠状病毒(Porcine respiratory coronavirus,PRCV)与TGEV 有一定的联系,但该病主要表现为猪的呼吸道症状[20]。近期,实验室通过2015~2018 年全国22 省及自治区的部分猪场猪群腹泻样本进行TGEV 检测,结果显示,17 个省份及自治区存在TGEV 感染的情况。其中陕西、四川、湖北等地阳性率较高[21]。近些年,其他研究人员也在贵州、浙江、广西等地检测到不同程度的TGEV 感染[22-23],这些调查结果提示目前该病在全国范围内分布广泛,值得引起重视。现阶段该病尚未由有效的治疗措施,疫苗免疫成为预防的主要方法。我国学者通过TGEV 弱毒株(华毒株),成功研制出猪传染性胃肠炎-猪流行性腹泻-猪轮状病毒三价活疫苗,临床试验表明,腹泻发病率从8%~12%降到了3%~5%[24]。此外我国还有TGEV XH08 制成的猪传染性胃肠炎、猪流行性腹泻二联活疫苗,该疫苗能够为仔猪提供有效的抗病能力[25]。这些疫苗的出现对我国TGEV 防控起到重要作用,但新疫苗的研发依然有必要。试验所用引物是针对TGEV 的N 基因,而N 基因所编码的核衣壳蛋白主要结构蛋白基因,在病毒的感染宿主细胞时,当病毒粒子处于组装过程中N 蛋白起到重要作用,且具有增强病毒RNA 复制的能力。试验选择黑龙江省某猪场猪腹泻样品,经巢式RT-PCR 检测显示为TGEV 阳性之后,利用PK-15 细胞分离TGEV,分离之初CPE 不明显。进而继续传代培养,CPE 出现的时间提前且变得明显。盲传15 代时CPE 明显,一般在接种后36~48 h 即可出现典型的CPE,此时细胞呈现圆缩聚集并形成合胞体,部分细胞脱落,与前人病毒分离的结果保持一致[13,15]。有研究表明,PEDV 与PDCoV 均可通过猪肾细胞在体外分离。因此,研究通过对第15 代分离毒进行病毒特异性试验,结果表明,PEDV 与PDCoV 均为阴性,不存在与其他猪腹泻病毒混和的情况。间接免疫荧光试验结果显示PK-15接毒48 h 后出现了明显荧光信号,对照组无荧光信号。最后我们将分离毒通过在电镜观察方法进一步了解病毒结构,结果表明,电镜下病毒粒子表面出现形似花冠状的典型冠状病毒结构。对成功分离的病毒命名TGEV HQ2016。测定第15 代分离毒TCID50为10-5.25/0.1 mL,与TGEV JS2012 P20TS(10-5.5/0.1 mL)毒价相近,高于TGEV AHHF P5TS(10-4.12/0.1 mL),推测该分离毒毒力强[26-27]。未来可通过动物致病性试验进一步了解该毒株的致病力,对该毒株进行遗传演化分析可为该地区TGEV 流行情况提供参考,同时该毒株继续传代后TCID50的测定,是提示能否成为疫苗株的重要指标。
4 结论
研究通过TGEV 阳性仔猪粪便利用PK-15 细胞成功分离并鉴定一株TGEV,命名为TGEV HQ2016。该毒株的成功分离鉴定对进一步研究其致病性,疫苗研发及诊断产品研制提供前期基础。
