不同剂量甲基强的松龙联合环磷酰胺治疗狼疮脑病对比研究
2021-05-06王在红刘曙艳
王在红 刘曙艳
焦作市第二人民医院,河南 焦作454000
狼疮脑病即系统性红斑狼疮(systemic lupus erythematosus,SLE)诱发的神经系统并发症[1],据不完全统计[2],SLE患者合并中枢神经系统疾病发病率高达24%~51%[2]。系统性红斑狼疮累及中枢神经系统出现一系列的精神神经症状时称为狼疮性脑病,神经系统的各个部分均可受累,临床表现多样[3],如抑郁、躁狂、头痛、头晕、注意力下降、记忆力下降、各种运动障碍,以及颅内压增高、癫痫、卒中甚至昏迷等[4-5]。这些可能是狼疮首发的表现,因此临床上出现一些可疑的神经精神症状时需做一系列相关的检查,如脑电图、头颅磁共振、头颅CT、腰椎穿刺、脑积液检查等[6],同时应注意排除药物引起的神经系统症状,如糖皮质激素引起的精神损害、中枢神经系统感染以及非狼疮相关的神经系统表现[7]。狼疮病患者免疫力低下并长期使用激素及免疫抑制剂,需警惕有无中枢神经系统感染,如结核性脑膜炎、真菌性脑膜炎等。SLE 神经系统病变即临床常说的神经精神狼疮(neuropsychiatric lupus,NPSLE)该病临床症状表现复杂,常表现为头痛、癫痫、抑郁、情感障碍、运动障碍等,早期临床诊断难度较高,需要辅助腰穿脑脊液检查、影像学检查等辅助手段[9]。甲基强的松龙联合环磷酰胺在SLE 疾病中应用临床效果显著[10],显著降低了SLE 患者狼疮性肾炎等并发症的发生概率,提高了临床治疗效率。
本文选取2017-02—2019-02 焦作市第二人民医院60 例狼疮脑病患者为研究对象,对不同剂量甲基强的松龙联合环磷酰胺对NPSLE 临床疗效、神经功能及血清炎性因子水平的影响进行探讨。
1 资料与方法
1.1 一般资料 以焦作市第二人民医院2017-02—2019-02接收的60例NPSLE患者为研究对象,按照随机组分数法分为低剂量组、中剂量组、高剂量组,每组20例。纳入标准[11]:(1)入组患者临床症状与NPSLE诊断标准相符,且均经临床影像学、脑脊液检查确诊;(2)患者或患者家属对试验内容知情,并签署知情同意书;(3)近1个月内患者未接受过其他激素类药物治疗。排除标准[12]:(1)合并严重心、肝、肾、肺等器质性损伤性疾病或癌症患者;(2)治疗前1 个月接受过激素类药物治疗者;(3)高血压性脑病、中枢神经系统感染性疾病、尿毒症或糖尿病患者;(4)对试验药物过敏者;(5)精神极度亢奋,顺应性极差,无法配合完成试验者。本试验经院伦理委员会批准。3 组患者一般资料差异无统计学意义(P>0.05),见表1。
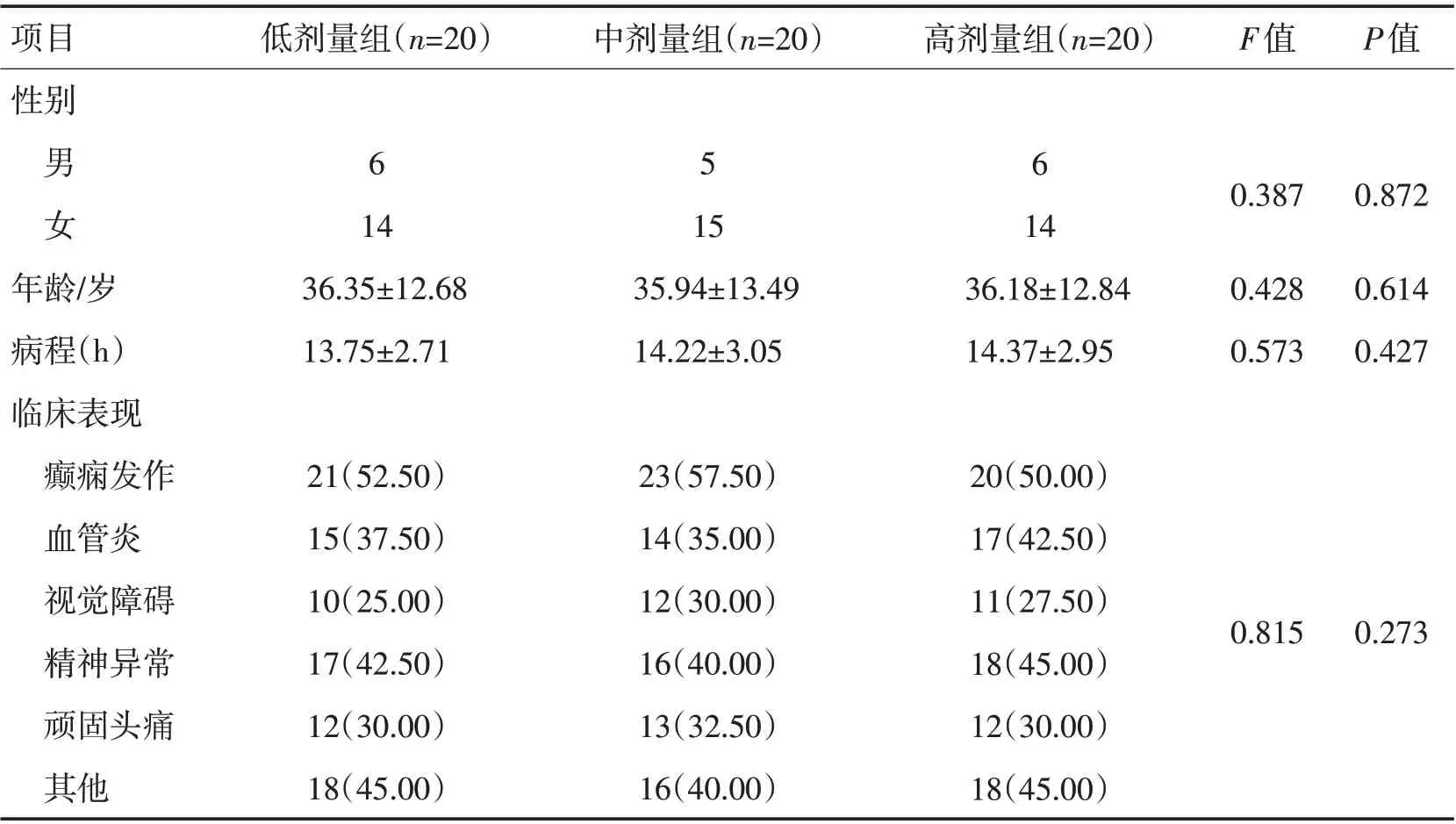
表1 3组患者一般资料对比Table 1 Comparison of general data of three groups of patients
1.2 方法 低剂量组治疗前3 d 使用甲泼尼松龙琥珀酸钠(常州四药制药有限公司;批准文号:H20173357;40 mg*1 支/盒)2 mg/(kg·d),加入5%葡萄糖注射液250 mL 静滴,滴注时间不少于15 min,3 d后改为初始给药剂量的2/3,第5天改为初始给药剂量的1/3,第6 天开始改为口服甲基强的松龙片剂(比利时法玛西亚;批准文号:H20070174,4 mg/片,30片/盒),16 mg/次,1次/d,同时环磷酰胺(山西普德药业有限公司;国药准字:H14023686;规格:200 mg/支*10/盒)200 mg 加入生理盐水100 mL 静滴,隔日一次。中剂量组治疗前3 d 使用甲泼尼松龙琥珀酸钠2 mg/(kg·d),加入5%葡萄糖注射液250 mL静滴,滴注时间不少于15 min,3 d后改为初始给药剂量的2/3,第5天改为初始给药剂量的1/3,第6天开始改为口服甲基强的松龙片剂,32 mg/次,1 次/d,同时静滴环磷酰胺,用法用量与低剂量组相同。高剂量组治疗前3 d 使用甲泼尼松龙琥珀酸钠,2 mg/(kg·d),加入5%葡萄糖注射液250 mL 静滴,滴注时间不少于15 min,3 d 后改为初始给药剂量的2/3,第5 天改为初始给药剂量的1/3,第6 天开始改为口服甲基强的松龙片剂,给药剂量48 mg/次,1 次/d,同时静滴环磷酰胺,用法用量与低剂量组相同。
1.3 观察指标 观察3 组患者临床疗效、神经功能及血清炎性因子水平的变化。
1.3.1 临床疗效评价:系统性红斑狼疮活动度评分(systemic lupus erythematosus disease activity index,SLEDAI)[12],结果与患者临床疗效呈负相关。SLEDAI 评分标准:①癫痫发作症状、精神症状、器质性脑病临床症状、视觉障碍、脑神经病变、狼疮头痛、脑血管疾病、血管炎症状各计1 分;②关节炎症状、肌炎症状、管型尿、血尿、蛋白尿、脓尿各计1 分;③脱发、皮疹、黏膜溃疡、胸膜炎、心包炎、低补体、抗双链DNA 抗体阳性率各计2 分;④发热、血小板减少、白细胞减少各计1分,共计3分。
1.3.2 神经功能评价:以治疗前后患者缄默、兴奋、幻听、恐惧、抑郁、焦虑等发生概率作为评价标准[13]。神经功能评价以自行设计的神经功能评价量表进行自评,每项满分100分,以60分作为评价标准。
1.3.3 血清炎性因子评价:指标包括IL-1β、IL-6、IL-8、IFN-α,采集患者清晨空腹血5 mL,加入肝素抗凝,8 000 r/min 离心20 min,取上清进行酶联免疫吸附试验(ELISA)检测上述检项,ELISA试剂盒购自北京义翘神州科技有限公司,操作方案按试剂盒说明书进行。
1.4 统计学方法 所有数据采用SPSS 20.0 软件进行统计分析,计量资料应用均数±标准差(±s)表示,组间比较采用独立样本t 检验,计数资料以百分率(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 3 组治疗前后SLEDAI 评分对比 治疗前3 组间SLEDAI 评分差异无统计学意义(P>0.05);治疗15 d、30 d 时高剂量组SLEDAI 评分显著低于低剂量组、中剂量组,组间比较差异有统计学意义(P<0.05)。见表2。
表2 3组治疗前后SLEDAI评分对比 (分,±s)Table 2 Comparison of SLEDAI scores before and after treatment (scores,±s)
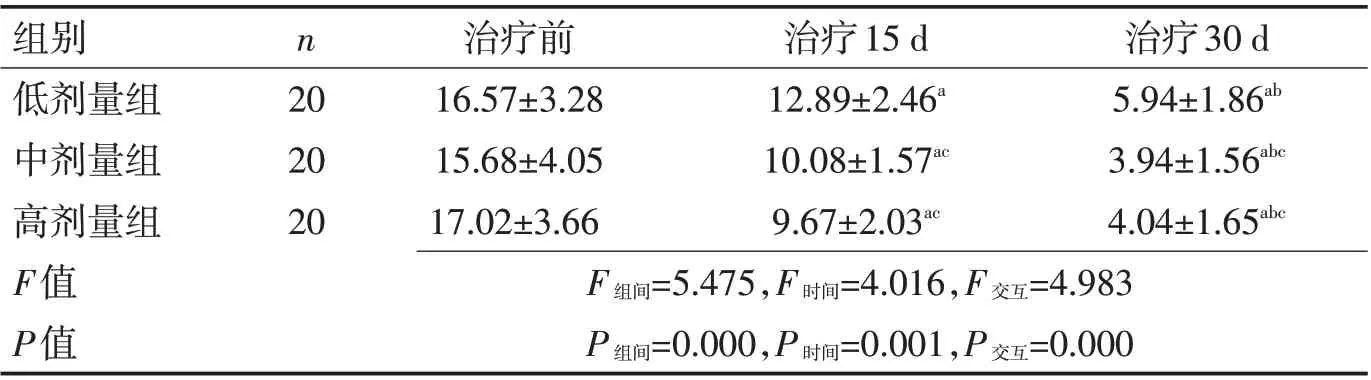
表2 3组治疗前后SLEDAI评分对比 (分,±s)Table 2 Comparison of SLEDAI scores before and after treatment (scores,±s)
组别低剂量组中剂量组高剂量组F值P值n 20 20 20治疗前16.57±3.28 15.68±4.05 17.02±3.66治疗15 d 12.89±2.46a 10.08±1.57ac 9.67±2.03ac治疗30 d 5.94±1.86ab 3.94±1.56abc 4.04±1.65abc F 组间=5.475,F 时间=4.016,F 交互=4.983 P 组间=0.000,P 时间=0.001,P 交互=0.000
2.2 3 组治疗前后神经功能症状对比 治疗30 d后中剂量组、高剂量组精神症状改善效果显著优于低剂量组(P<0.05),且中剂量组、高剂量组患者精神症状改善效果无显著差异(P>0.05)。见表3。
2.3 3 组治疗前后血清炎性因子水平对比 治疗30 d 后3 组患者血清炎性因子IL-1β、IL-6、IL-8、IFN-α水平与治疗前相比均显著改善(P<0.05),但中剂量组、高剂量组患者血清各炎性因子改善水平显著优于低剂量组(P<0.05),且中剂量组、高剂量组患者血清炎性因子改善效果差异无统计学意义(P>0.05)。见表4。
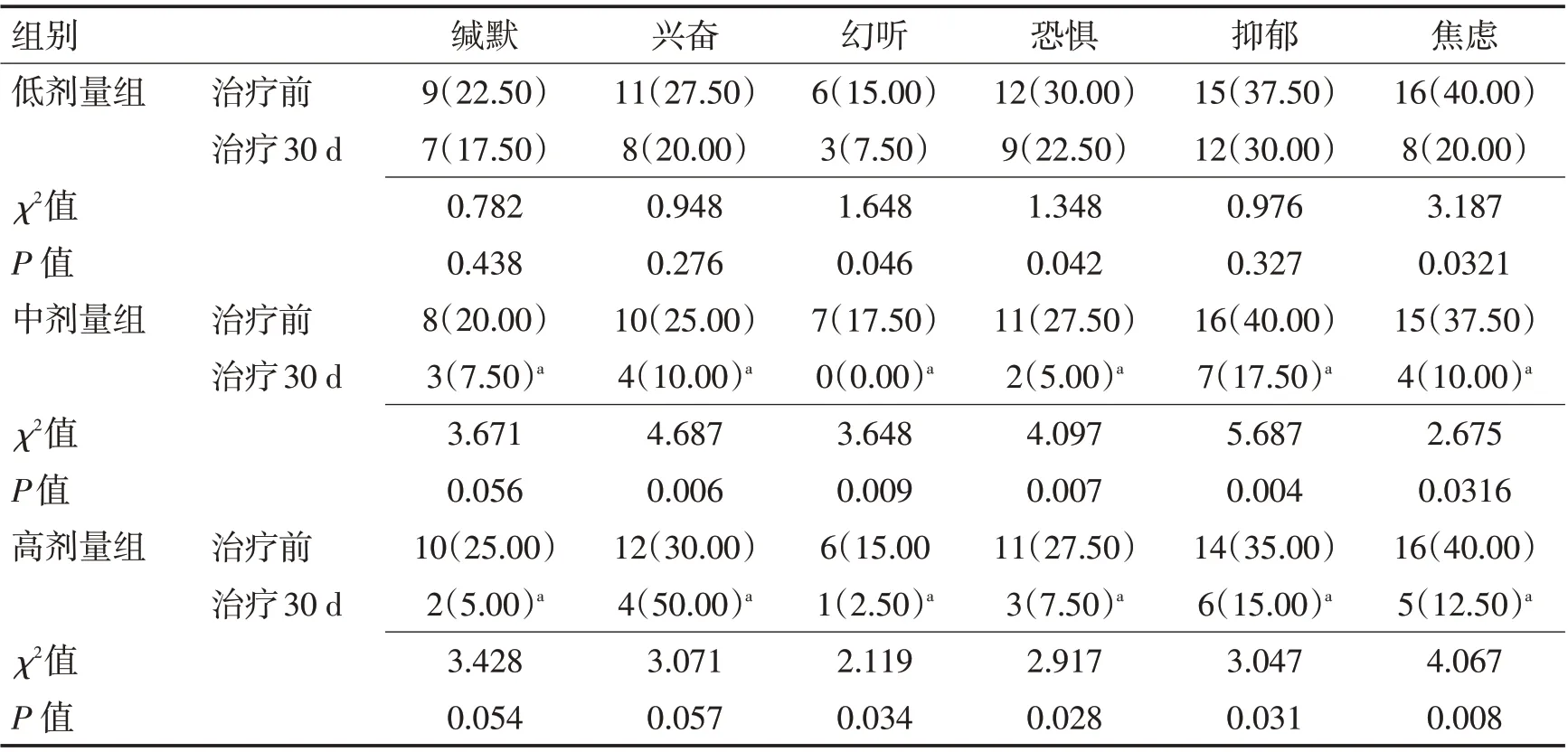
表3 3组治疗前后神经功能症状对比 [n(%)]Table 3 Comparison of neurological symptoms before and after treatment in three groups [n(%)]
表4 3组治疗前后血清炎性因子水平对比 (pg/mL,±s)Table 4 Comparison of serum inflammatory before and after treatment in three groups (pg/mL,±s)
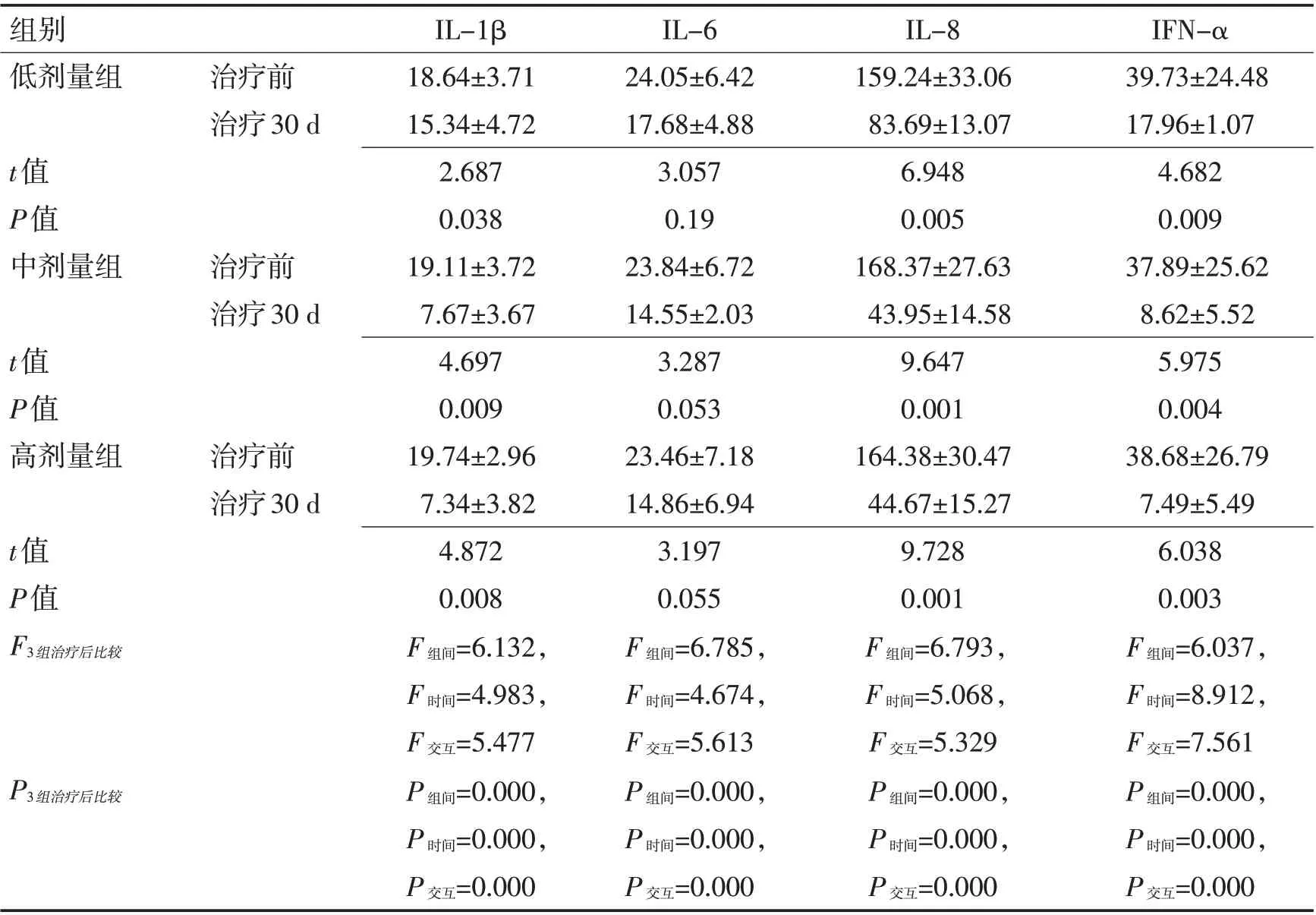
表4 3组治疗前后血清炎性因子水平对比 (pg/mL,±s)Table 4 Comparison of serum inflammatory before and after treatment in three groups (pg/mL,±s)
组别低剂量组 治疗前治疗30 d t值P值中剂量组治疗前治疗30 d t值P值高剂量组治疗前治疗30 d t值P值F3组治疗后比较P3组治疗后比较IL-1β 18.64±3.71 15.34±4.72 2.687 0.038 19.11±3.72 7.67±3.67 4.697 0.009 19.74±2.96 7.34±3.82 4.872 0.008 F 组间=6.132,F 时间=4.983,F 交互=5.477 P 组间=0.000,P 时间=0.000,P 交互=0.000 IL-6 24.05±6.42 17.68±4.88 3.057 0.19 23.84±6.72 14.55±2.03 3.287 0.053 23.46±7.18 14.86±6.94 3.197 0.055 F 组间=6.785,F 时间=4.674,F 交互=5.613 P 组间=0.000,P 时间=0.000,P 交互=0.000 IL-8 159.24±33.06 83.69±13.07 6.948 0.005 168.37±27.63 43.95±14.58 9.647 0.001 164.38±30.47 44.67±15.27 9.728 0.001 F 组间=6.793,F 时间=5.068,F 交互=5.329 P 组间=0.000,P 时间=0.000,P 交互=0.000 IFN-α 39.73±24.48 17.96±1.07 4.682 0.009 37.89±25.62 8.62±5.52 5.975 0.004 38.68±26.79 7.49±5.49 6.038 0.003 F 组间=6.037,F 时间=8.912,F 交互=7.561 P 组间=0.000,P 时间=0.000,P 交互=0.000
3 讨论
狼疮脑病是指系统性红斑狼疮累及中枢神经系统引起的神经精神症状,表现为癫痫、狼疮性头痛、脑血管病变、无菌性脑膜炎、运动障碍、急性意识错乱、焦虑状态、认知功能减退、情绪障碍等症状[13]。目前认为脑局部血管炎的血栓形成、自身抗体和炎症介质介导的炎症反应等,共同促进了狼疮脑病的发生[14]。NPSLE 严重影响患者的精神症状,严重降低了患者及其家属的生活质量。研究显示[15],NPSLE 患者血清及脑脊液炎性因子IL-1β、IL-6、IL-8、IFN-α水平显著高于正常水平,因此抗炎治疗是关键。对IL-1β、IL-6、IL-8、IFN-α生理作用进行临床分析,IL-1β可导致局部炎症反应的发生或加剧;IL-6 可使患者外周血管扩张并在增加血管通透性方面也具有显著影响,最终导致患者脑组织水肿,引起或加重患者神经以及精神症状;IL-8 能够显著增加SLE 患者血脑屏障的通透性,进一步加重患者脑组织水肿症状。IFN-α可促发SLE并加重病情。
3.1 甲基强的松龙联合环磷酰胺治疗狼疮脑病作用机制 甲基强的松龙是一种合成糖皮质激素[16],在临床上具有强效的抗炎、免疫抑制及抗过敏作用,且其在减少血管扩张方面也具有显著的临床应用效果。环磷酰胺在进入人体后可被肝脏或肿瘤内存在过量的磷酰胺酶或磷酸酶水解,变为活化作用型的磷酰胺氮芥而起作用的氮芥类衍生物[17],在SLE 临床治疗过程中环磷酰胺主要通过与淋巴细胞的相互作用抑制特异性抗体的生成,消除T淋巴细胞介导的免疫反应,从而降低SLE导致的炎性反应。因此,甲基强地松龙联合环磷酰胺在降低NPSLE患者血清各炎性因子水平方面临床效果显著[18-23]。
3.2 不同甲基强的松龙联合环磷酰胺治疗狼疮脑病临床效果 本研究显示,中剂量组、高剂量组患者血清炎性反应改善效果显著优于低剂量组(P<0.05),而中剂量组、高剂量组患者精神症状改善效果无显著差异(P>0.05),中剂量组、高剂量组患者精神症状改善效果显著优于低剂量组(P<0.05),与药物药理作用及NPSLE 病理机制相符。本研究还显示,中剂量组、高剂量组患者临床疗效显著优于低剂量组(P<0.05),而高剂量组、中剂量组患者临床疗效无显著差异(P>0.05)。因此,中剂量甲基强的松龙联合环磷酰胺治疗NPSLE 临床效果显著,能够显著改善患者精神症状,并降低血清炎性因子水平,值得临床推广。
