miR-21-3p调节结核分枝杆菌在宿主巨噬细胞内存活机制的研究
2021-05-06吴托雅石金郭继东刘原园逄宇鲁洁高飞
吴托雅 石金 郭继东 刘原园 逄宇 鲁洁 高飞
结核分枝杆菌(Mycobacteriumtuberculosis,MTB)可通过免疫逃逸促进其自身胞内存活,导致疾病的迁延不愈[1-2]。因此,探究MTB与宿主细胞的关系,对于深入阐明其致病机制及宿主的抗结核免疫具有重要意义。微小RNA(microRNA,miRNA)是一种内源性非编码核糖核酸,通过与靶基因的调控区域结合,在转录后水平降解mRNA或抑制靶基因的翻译,作为基因表达的转录后阻遏物参与许多生理和病理反应[3-4]。最近的研究已经确立了miRNA在免疫调节中的新作用,包括调节免疫细胞的发育和分化、抗体的产生及先天免疫等过程[5-6]。miRNA的异常表达也与各种肿瘤疾病相关[7]。研究显示,microRNA-21-3p(简称“miR-21-3p”)对肿瘤耐药、组织损伤、甲型流感病毒复制等具有调控作用[8-13]。然而,miR-21-3p对MTB感染的调控机制研究目前尚未见报道。为此,笔者通过原代巨噬细胞及细胞模型探究miR-21-3p在宿主巨噬细胞内对抗MTB感染中的作用。
材料和方法
一、实验材料
1.材料来源:研究所用的细胞系THP-1和U937,以及MTB标准株H37Rv均来自北京市结核病胸部肿瘤研究所生物资源样本库。
2.培养基:分枝杆菌罗氏中性培养基(批号:2012081)购自珠海市银科医学工程股份有限公司;OADC增菌液(9017941)和7H10固体培养基(批号:0126928)购自美国BD公司;1640含酚红培养液(批号:29420003)购自美国Corning公司;胎牛血清(批号:2021472)购自美国Gibco公司。
3.试剂:细胞/细菌总RNA提取试剂盒(批号:R1061)购自广州东胜生物科技有限公司;miDETECT A Track miRNA qRT-PCR Starter Kit试剂盒(批号:T0909)、miR-21-3p上游引物(批号:00417)及U6上游引物(批号:R0529)均购自广州锐博生物技术有限公司;Hifair®Ⅱ 1st Strand cDNA Synthesis SuperMix(批号:H0901211)及Hief®qPCR SYBR®Green Master Mix(No Rox)(批号:H9001130)购自上海翊圣生物科技有限公司;CCK-8试剂盒(细胞增殖及毒性检测试剂盒)(批号:20150715)购自北京索莱宝科技有限公司。TBD人全血单个核细胞分离液(批号:LDS1075)及TBD清洗液(批号:2010X1118)购自天津市灏洋生物制品科技有限公司。
4.引物信息:使用Primer Premier 软件进行引物设计,由北京擎科生物科技有限公司进行引物合成,引物序列见表1。

表1 荧光定量逆转录PCR引物信息
二、实验方法
1.细胞培养:人巨噬细胞系THP-1和U937接种于含有10%胎牛血清的1640含酚红培养液,在含5% CO2的37 ℃加湿培养箱中培养。
2.人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分离:抽取6例临床确诊肺结核患者及6名健康人的外周血,5 ml/例。收集外周全血,加入TBD人全血单个核细胞分离液,450×g离心25 min,吸取乳白色环状细胞层,加入TBD清洗液,250×g离心10 min,洗涤细胞2次后计数并收集细胞。
3.细胞感染:MTB标准株H37Rv接种于分枝杆菌罗氏中性培养基上,培养3周后,研磨成单一的细菌悬浮液。将THP-1和U937细胞计数并接种于6孔细胞培养板上,在细胞培养液中加入佛波酯(phorbol 12-myristate 13-acetate,PMA)以50 ng/ml的浓度诱导巨噬细胞分化。24 h后用1 ml磷酸盐缓冲液(PBS)洗涤平板2次,并以相同感染复数(MOI=5)的MTB标准株H37Rv感染细胞,在含5% CO2的37 ℃加湿培养箱中继续培养,并在指定的时间点收集细胞。
4.细胞转染:为了上调或下调U937和THP-1细胞中miR-21-3p的表达,应用购自广州锐博生物科技有限公司的miR-21-3p模拟物(mimic)及阴性对照(negative control mimic,NC-mimic)、抑制剂(inhibitor)及阴性对照(negative control inhibitor,NC-inhibitor)转染到U937和THP-1细胞中,采用实时荧光定量逆转录PCR(qRT-PCR)分析以评估转染效果。
5.qRT-PCR:用细胞/细菌总RNA提取试剂盒抽提细胞总RNA;用miDETECT A Track miRNA qRT-PCR Starter Kit试剂盒进行mRNA cDNA合成,并对miR-21-3p的表达量进行qRT-PCR检测,以U6作为内部对照。以试剂盒Hifair®Ⅱ 1st Strand cDNA Synthesis SuperMix进行逆转录合成cDNA后,以Hief®qPCR SYBR®Green Master Mix(No Rox)试剂盒对炎症细胞因子及候选靶基因的mRNA表达量进行qRT-PCR检测,以三磷酸甘油醛脱氢酶(GAPDH)作内部对照。采用2-△△Ct(Livak)方法,以对照基因作为标准,对目标基因的表达量进行相对定量。
6.细胞增殖及毒性检测:将细胞计数并接种到96孔板中,分别用模拟物、抑制剂或其阴性对照进行转染。在指定的时间点将10 μl CCK-8(cell counting kit-8)试剂加入96孔板中,并在37 ℃下再孵育4 h。使用酶标仪测量450 nm处的吸光度(A)值。
7.菌落形成单位(colony-forming unit,CFU)计数法:细胞在感染MTB后用PBS洗涤细胞2次以去除胞外细菌,并在新鲜培养基中孵育至指定的时间点。用0.05% SDS裂解感染的细胞,经过10倍梯度稀释,按照稀释比例接种在含有10% OADC的7H10琼脂平板上,并在37 ℃孵育3~4周,计算CFU。
8.潜在靶基因筛选:使用TargetScan、miRDB和DIANA等miRNA靶基因预测生物信息学工具检测与miR-21-3p序列匹配的基因。
三、统计学处理
采用 GraphPad Prism 8软件进行分析。偏态分布的计量资料以“中位数(四分位数)[M(Q1,Q3)]”表示,两组间差异的比较采用Mann-WhitneyU检验,多组间差异的比较采用Kruskal-WallisH检验,均以P<0.05为差异有统计学意义。
结 果
一、MTB感染诱导宿主巨噬细胞中miR-21-3p表达上调
对6例临床肺结核患者及6名健康人的外周血PBMC的检测结果表明,结核病组PBMC的miR-21-3p相对表达量为7.286(6.964,10.483),明显高于健康对照组的1.030(0.997,1.169),差异有统计学意义(U<0.001,P=0.002)。
细胞实验结果显示,在感染MTB标准株H37Rv 24 h后,细胞系THP-1及U937中的miR-21-3p相对表达量分别为16.311(15.543,17.030)和72.850(65.343,97.343),与感染前(即0 h组)[1.038(0.959,1.165)与1.029(0.979,1.200)]相比均明显升高,差异有统计学意义(U值均<0.001,P值均为0.002)。
二、miR-21-3p抑制MTB在巨噬细胞内的存活
应用miR-21-3p模拟物(mimic)及其阴性对照(NC-mimic)、抑制剂(inhibitor)及阴性对照(NC-inhibitor),分别转染U937细胞,结果表明,miR-21-3p模拟物组miR-21-3p相对表达量为256.351(187.079,448.045),高于NC-mimic组的0.987(0.426,1.026),差异有统计学意义(U<0.001,P=0.002)。而抑制剂组miR-21-3p相对表达量为0.030(0.027,0.054),明显低于NC-inhibitor组的0.987(0.875,1.026),差异有统计学意义(U<0.001,P=0.002)。
为了确定瞬时转染miR-21-3p模拟物和抑制剂后是否会对巨噬细胞活性产生影响,采用CCK-8分析法检测不同处理条件下的细胞活性,结果显示,miR-21-3p模拟物组、NC-mimic组、抑制剂组、NC-inhibitor 组A值分别为2.056(2.028,2.349)、2.137(1.984,2.181)、2.076(1.835,2.253)、1.896(1.674,2.174),各转染处理组间的细胞活力差异无统计学意义(H=1.647,P=0.649),细胞可用于后续实验。
以MTB标准株H37Rv感染miRNA转染成功的实验组细胞,用CFU计数法测定巨噬细胞中MTB菌量。结果显示,在感染后24 h miR-21-3p模拟物组的胞内菌量为7.5×104(6.0×104,8.8×104),明显少于NC-mimic组的13.5×104(12.0×104,14.0×104),差异有统计学意义(U<0.001,P=0.002)。
三、miR-21-3p促进MTB感染巨噬细胞过程中炎症因子的表达
巨噬细胞分组转染miR-21-3p后,以MTB标准株H37Rv进行感染并检测炎性细胞因子IL-6、TNF-α的分泌水平。结果显示,与NC-mimic组相比,miR-21-3p模拟物组的巨噬细胞对于MTB感染导致的炎症应答明显增强,IL-6及TNF-α的mRNA 相对表达量分别由1.803(1.729,1.892)及0.960(0.858,1.020)升高至4.520(4.234,5.205)及1.455(1.372,1.523),差异均有统计学意义(U值均<0.001,P值均为0.002)。而抑制剂组的IL-6及TNF-α相对表达量分别为0.927(0.901,1.050)及0.781(0.705,0.805),较NC-inhibitor组的1.819(1.007,1.953)及1.101(0.994,1.202)明显降低,差异均有统计学意义(U=2.000,P=0.009;U<0.001,P=0.002)。
四、miR-21-3p潜在靶基因分析
通过TargetScan、miRDB和DIANA预测与miR-21-3p序列匹配的基因,最终得到22个共有基因。经过对文献资料的搜索,最终筛选出与细胞增殖、凋亡及免疫过程相关的6个候选基因。巨噬细胞分组转染miR-21-3p后,以MTB标准株H37Rv进行感染并检测上述基因的表达情况。结果显示,miR-21-3p模拟物组CDK-8的mRNA相对表达量明显低于NC-mimic组,差异有统计学意义。抑制剂组CDK-8的mRNA相对表达量明显高于NC-inhibitor 组,差异有统计学意义。miR-21-3p模拟物组UBE4B的mRNA相对表达量明显高于NC-mimic组,差异有统计学意义。抑制剂组UBE4B的mRNA相对表达量,明显高于NC-inhibitor组,差异有统计学意义。miR-21-3p模拟物组PEG3的mRNA相对表达量高于NC-mimic组,差异有统计学意义。抑制剂组PEG3的mRNA相对表达量高于NC-inhibitor组,差异有统计学意义。miR-21-3p模拟物组NFYB的mRNA相对表达量明显高于NC-mimic组,差异有统计学意义。抑制剂组NFYB的mRNA相对表达量明显高于NC-inhibitor组,差异有统计学意义。miR-21-3p模拟物组KLHL3的mRNA相对表达量明显高于NC-mimic组,差异有统计学意义。抑制剂组KLHL3的mRNA相对表达量明显高于NC-inhibitor组,差异有统计学意义。具体见表2。
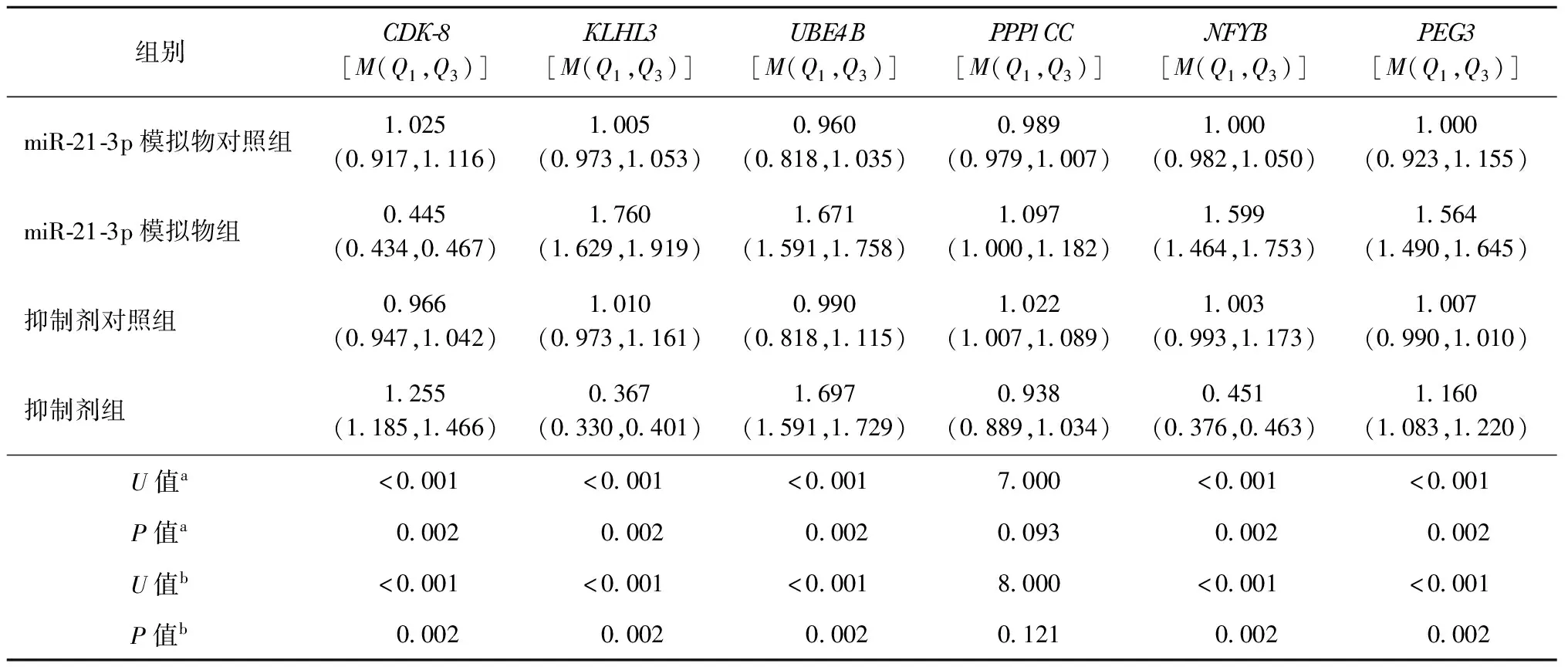
表2 结核分枝杆菌标准株H37Rv感染分组转染miR-21-3p的巨噬细胞后潜在靶基因mRNA表达情况
讨 论
近年来,miRNA在疾病的发生发展中发挥的调节功能越来越受到研究者的重视。目前已有大量的研究证实,miR-21-3p作为一种重要的调节因子,在多种疾病中表现出不同的调控机制。笔者以MTB感染巨噬细胞为模型,探讨了miR-21-3p在MTB感染过程中发挥的作用及相关机制。通过对临床标本检测和细胞系感染实验,发现miR-21-3p在MTB感染的巨噬细胞内表达上调。随后,miRNA 转染实验发现,miR-21-3p上调可以抑制MTB在巨噬细胞内的存活。对炎症因子的检测结果表明,过表达miR-21-3p的巨噬细胞对于MTB感染导致的炎症应答明显增强,TNF-α和IL-6的mRNA表达水平明显增高。miRNA通过与其靶基因3′非翻译(3′-UTR)区的互补位点结合来发挥其调节作用,并抑制靶基因的表达,说明miRNA与其靶基因为负向调节关系[14]。对靶基因的筛选和检测结果表明,CDK-8可能是miR-21-3p对抗MTB感染过程中的潜在靶标之一。
miRNA在MTB感染巨噬细胞的免疫过程中起到重要的调控作用。MTB感染可引起miR-33和miR-33*上调。miR-33和miR-33*可以抑制自噬和增加细胞脂质储存,以此来促进MTB胞内存活和扩增[15]。MTB感染使miR-144*增多,miR-144*使DNA损伤调节的自噬调节剂2(DNA damage regulated autophagy modulator 2,DRAM2)和吞噬体表达降低,从而抑制细胞的自噬反应[16]。miR-27a可通过下调Ca2+信号通路,抑制自噬体形成来促进MTB胞内存活[17]。miR-30a可明显抑制MTB感染诱导的巨噬细胞中TNF-α、IL-6、IL-8的表达[18-19]。miR-155、miR-365可抑制促炎因子TNF-α和IL-6的释放,促进MTB的胞内存活;而miR-125和miR-32-5p则可促进TNF-α和IL-6 表达[20]。
巨噬细胞作为MTB感染的直接宿主,可通过激活Toll样受体(Toll-like receptors,TLR)诱导系统性炎症反应。TLR在识别MTB配体后导致巨噬细胞产生炎性细胞因子,如TNF-α、IL-1和IL-6。细胞因子通过结合特定的细胞表面受体作用于免疫细胞,引发复杂的细胞反应[21-22]。TLR信号主要依赖于4种衔接蛋白:髓样分化因子88(myeloid differentiation factor 88,MyD88)、Toll-白细胞介素1受体结构域连接蛋白(Toll-interleukin 1 receptor domain-containing adaptor protein,TIRAP)、Toll样受体衔接分子1(Toll-like receptor adaptor molecule 1,TICAM1)和TICAM2。它们直接结合激活的TLR并募集下游信号成分。除了仅通过TICAM1信号的TLR3,所有TLR都利用MyD88依赖性途径,导致产生TNF-α、IL-1、IL-6和其他依赖于NF-κB的细胞因子[22]。miRNA可通过靶向TLR衔接蛋白来调节TLR诱导的NF-κB活化。例如,miR-30a直接靶向MyD88的3′-UTR,从而抑制巨噬细胞中TLR和MyD88活化及细胞因子表达[18]。miR-146a是一种抗炎miRNA,通过靶向白细胞介素-1受体相关激酶(IL-1 receptor associated kinase,IRAK1)和肿瘤坏死因子受体相关因子(TNF receptor associated factor 6,TRAF6)对NF-κB 的激活进行负调节[23-24]。miR-27a则靶向TLR3衔接子TICAM1的3′-UTR,以减弱TLR3信号[25]。
细胞周期蛋白依赖性激酶最初被描述为细胞周期进程的调节剂,但后来证明它们在代谢、神经元分化、造血、血管生成等生物过程中具有多种作用[26]。与众所周知的CDK家族成员不同,CDK-8不介导细胞周期进程。CDK-8的一个关键功能是磷酸化RNA Pol Ⅱ的C末端结构域(CTD),使转录延长[27]。CDK-8可以抑制和激活哺乳动物的基因转录[26],正向调节几种癌症相关的信号通路,包括血清反应网络、转化生长因子β、缺氧诱导因子1α和雌激素受体[28]。另外,在几种上皮来源的细胞系和髓样细胞中,CDK-8及其平行激酶CDK-19共同参与TLR-9的转录激活并与C/EBPβ和NF-κB共同调节炎症相关基因的转录[27,29]。
综上所述,本研究验证了miR-21-3p可以促进MTB感染诱导的促炎因子TNF-α和IL-6,并筛选出CDK-8为其在MTB感染中可能的靶基因。笔者推测miR-21-3p在MTB感染宿主巨噬细胞的过程中,通过靶向调控CDK-8来调节TLR介导的炎症通路。后续可以通过更多的实验来证实这一假设。可以肯定的是,miR-21-3p在MTB感染宿主巨噬细胞的过程中发挥着重要的生物学功能,这项发现或可能有助于开发结核病的新治疗方法,并提示miRNA和靶基因可作为针对结核病的宿主导向治疗的潜在候选物。
