合肥地区无偿献血人群CD36抗原缺失的调查*
2021-05-06赵娜娜王超金惠新赵阳吕蓉
赵娜娜 王超 金惠新 赵阳 吕蓉
CD36抗原又称为GPⅣ、GPⅢb、PASⅣ或FAT,是一种80KD大小的膜糖蛋白,广泛存在于血小板、免疫细胞、脂肪细胞、心肌细胞、肠细胞、肠内分泌细胞、视网膜和乳腺上皮细胞以及微血管内皮细胞上[1]。研究表明,CD36抗原缺失患者因输血、移植、妊娠等免疫刺激而产生CD36同种抗体,可引起血小板输注无效[2]、新生儿同种免疫性血小板减少症[3]、输血后紫癜[4]等。CD36是胞外基质蛋白凝血酶敏感蛋白的受体,凝血酶敏感蛋白与血小板上的CD36 C-末端区域结合,能促进血小板的黏附。产生CD36抗体的患者,其血小板与胶原蛋白的黏附力下降,并且血小板CD36抗体能抑制血小板变形、聚集和分泌[5]。这些将会导致血小板的黏附、聚集和分泌功能下降,是导致血小板输注无效(PTR)的次要原因。1989年IKEDA等[6]在一位日本血小板输注无效患者体内发现NaKa抗体,并证实NaKa抗原位于CD36分子上,此后发现血小板CD36抗原缺失与血小板输注无效有关。近几年,国内外报道CD36抗体导致的血小板输注无效病例增加,CD36抗原缺失已引起输血界的高度关注。本研究建立了血小板CD36抗原流式检测方法,并分析了合肥地区无偿献血者CD36抗原的缺失频率,现将结果报告如下。
材料与方法
1 研究对象 随机选取合肥地区2020年3月~2020年7月无偿捐献血小板献血者共973例,年龄18~55岁。获得知情同意后采集EDTA抗凝全血2 mL(4 ℃保存),于样本采集24 h内完成CD36抗原的流式检测。
2 主要试剂与仪器 FITC荧光标记抗人CD36单克隆抗体(购自法国Beckman CouLter公司,批号:200012),FITC荧光标记抗人IgG1单克隆抗体(购自法国Beckman CouLter公司,批号:200069),PE荧光标记抗人CD14单克隆抗体(购自法国Beckman CouLter公司,批号:200042),DPBS basic(1X)(赛默飞世尔生物化学制品(北京)有限公司,批号:8119439),EDTA/DPBS缓冲液(10 mmol/L EDTA溶于DPBS溶液,pH7.0~7.2),离心机(赛默飞世尔科技有限公司),混匀器(海门市其林贝尔仪器制造有限公司),BD管(FALCON),流式细胞仪(BD FACS Calibur,美国BD公司)。
3 方法
3.1 血小板CD36抗原流式方法检测:取2 mL EDTA抗凝全血,混匀,100 g离心15 min分离上层富含血小板血浆(PRP),用3 mL EDTA/DPBS缓冲液洗涤,3 000 r/min离心5 min,洗涤2次后弃上清,再用EDTA/DPBS缓冲液将血小板稀释至3.0×105/μL。取50 μL稀释后的血小板悬浮液,加入2.5 μL FITC荧光标记抗人CD36单克隆抗体,对照管加FITC荧光标记抗人IgG1单克隆抗体,混匀,室温、避光孵育30 min,用2 mL EDTA/DPBS缓冲液洗涤,2 500 r/min离心3 min,洗涤2次后弃上清,将标记的血小板悬浮在300 μL EDTA/DPBS缓冲液中,混匀,流式细胞仪检测,通过FSC/SSC设血小板门,分析血小板表面的几何平均荧光强度(geometric mean fluorescence intensity,GMFI)。血小板CD36抗原阴性、阳性结果判断:当样本的M1<5%时(此时M2>95%,因为M1+M2=100%)判定该样本为阴性;当样本的M1>5%时(此时M2<5%)判定该样本为阳性。
3.2 单核细胞CD36抗原流式方法检测:取100 μL EDTA抗凝血,加入5 μL FITC标记抗人CD36单克隆抗体、5 μL PE标记抗人CD14单克隆抗体,混匀,避光、室温孵育20 min后,再加入500 μL红细胞裂解液,混匀,避光、室温静置15 min,加入2 mL~3 mL DPBS缓冲液洗涤,3 000 r/min离心5 min,弃上清(重复一次),再用500 μL DPBS缓冲液重悬细胞扣,混匀,流式细胞仪分析。 单核细胞CD36抗原阴性、阳性结果判断:当样本的M2<5%时(此时M1>95%,因为M1+M2=100%)判定该样本为阴性;当样本的M2>5%时(此时M1<5%)判定该样本为阳性。
3.3 CD36抗原缺失分类的定义:流式细胞仪检测献血者血小板CD36抗原阴性后,对献血者单核细胞进行检测CD36抗原。若单核细胞CD36抗原为阴性,则该献血者为CD36Ⅰ型缺失;若单核细胞CD36抗原为阳性,则该献血者为CD36Ⅱ型缺失。
结 果
1 973例合肥地区无偿献血者CD36抗原检测情况 血小板CD36抗原流式检测和单核细胞CD36抗原流式检测示意图见图1和图2。共检出血小板CD36抗原阳性者957例,血小板CD36抗原缺失者16例,缺失频率为1.64%;其中Ⅰ型缺失2例,Ⅱ型缺失14例,缺失频率分别为0.20%(2/973)和1.44%(14/973)。在血小板CD36抗原缺失者中,Ⅰ型缺失占12.50%(2/16)、Ⅱ型缺失占87.50%(14/16),CD36抗原检测结果及分布情况(见表1)。

表1 CD36抗原的表达与分布情况
2 人群血小板CD36抗原表达差异 根据血小板上CD36抗原的几何平均荧光强度GMFI发现,合肥地区无偿献血者血小板CD36抗原表达强度存在差异:16例CD36表达阴性(缺陷型),GMFI值为32.25±5.31;957例CD36表达阳性(非缺陷性),其中CD36抗原低表达有128例,其GMFI为165.57±27.76,CD36抗原中表达有686例,其GMFI为346.88±88.81,CD36抗原高表达有143例,其GMFI为 659.05±111.18。
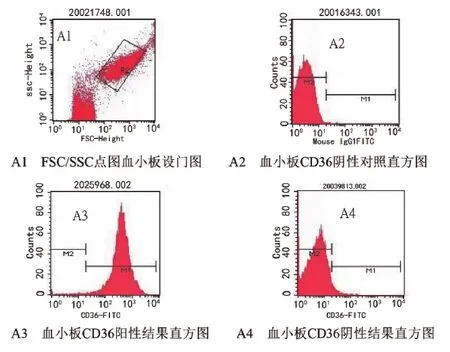
图1 血小板CD36 抗原流式表达示意图

图2 单核细胞CD36 抗原流式表达示意图
讨 论
随着临床血小板输注量的增多,发现CD36抗原缺失者经输血、妊娠、移植等途径带来的免疫刺激后易产生抗CD36抗体,后者可导致血小板输注无效、新生儿同种免疫血小板减少、输血后紫癜等疾病,因此CD36抗原-抗体相关研究越来越被重视,已有的研究发现CD36缺失型在中国人群中占有相当比例[7]。CD36抗原缺失分为2种类型:Ⅰ型为血小板和单核细胞都不表达CD36抗原;Ⅱ型仅是血小板缺失CD36抗原,而单核细胞上表达CD36抗原[8]。Ⅱ型缺失又被分为2个亚类,2a和2b,只是血小板缺乏CD36为2a;如果红细胞也缺乏CD36,为2b[9]。Ⅱ型比Ⅰ型更常见。研究证实CD36缺失Ⅰ型的分子机制主要源于编码区的基因突变[10];Ⅱ型缺失的分子机制目前尚不明确。KASHIWAGI等[11]推测在CD36基因上或其附近存在一个“血小板特异性沉默等位基因”,该基因会影响CD36的表达。IMAI等[12]假设存在血小板限制调节因子,其导致CD36抗原Ⅱ型缺失,而XU等[13]研究发现起始密码子上游的基因突变会导致CD36抗原表达低下,因此认为在5´-UTR存在几个潜在的顺式调控元件对转录进行调控,最终导致血小板CD36抗原Ⅱ型缺失。也有研究发现有些CD36基因突变并不一定会引起CD36抗原缺失,有的只是会引起抗原表达量减少,甚至没有影响[14]。
本次研究分析了合肥地区人群CD36抗原缺失频率,在检测的无偿献血者CD36抗原缺失频率为1.64%。据报道非洲人缺失率较高,美国非裔为2.4%[15],亚洲人群缺失率为5%~10%[1],日本为3%~11%[16],白种人缺失率仅为0%~0.3%[4];国内报道的CD36缺失分别为广州2.10%[17]、深圳3.19%[18]、 长 春 3.45%[19]、 广 西 4.13%[20]、 杭 州3.6%[13],其中广西壮族人群高达5.76%。由此可见,CD36抗原缺失率存在地区和种族差异,合肥地区缺失频率较中国南部地区CD36缺失率略低。
目前多用流式细胞法检测血小板CD36抗原,根据细胞在流式细胞仪上的前向角和侧向角确定血小板区域,排除红细胞、白细胞和碎片的干扰,并分析血小板区域的荧光强度。从本次结果分析,CD36抗原缺失者中A、B、O、AB血型个数均不低于2个,可为临床输注CD36抗原阴性血液患者提供帮助,也可为建立合肥地区无偿献血人群CD36抗原表达阴性资料库的建立打下基础。
本研究建立了血小板和单核细胞的CD36抗原流式检测方法,并初步分析了合肥地区CD36抗原缺失频率。血小板CD36抗原流式检测方法的建立可用于对无偿献血者CD36抗原筛查及临床病人血小板CD36抗原检测,为血小板输注无效并产生CD36抗体的患者寻找CD36抗原阴性血液制品提供基础,但是本研究只进行了CD36抗原的调查,而缺失的分子机制还待进一步研究探讨。
利益冲突所有作者均声明不存在利益冲突
