非霍奇金淋巴瘤患者行外周血单个核细胞采集前后血细胞的变化及影响因素分析
2021-05-06迟红旭江颖姚欢田静李玲玲朱晓君刘晓敏张雷英孙桂香于洋
迟红旭 江颖 姚欢 田静 李玲玲 朱晓君 刘晓敏 张雷英 孙桂香 于洋
淋巴瘤为原发于免疫系统的实体肿瘤,其中霍奇金淋巴瘤与非霍奇金淋巴瘤的占比约为1:9。从病理学水平上划分,非霍奇金淋巴瘤主要包括B细胞淋巴瘤、T细胞淋巴瘤以及NK细胞淋巴瘤,其中来源于B细胞的淋巴瘤占所有淋巴瘤的85%~90%[1]。目前,非霍奇金淋巴瘤的一线治疗方案为化疗,绝大部分的患者经一线治疗后可获得治愈,但仍有20%~30%的弥漫大B细胞淋巴瘤患者经化疗后复发[2]。部分复发难治非霍奇淋巴瘤患者可通过自体移植获得缓解,但大约有40%~50%的患者经自体移植后仍然复发。复发难治非霍奇淋巴瘤患者预后不佳,总体反应率(overall response rate,ORR)仅26%,中位生存期仅为6.3月[3]。
CAR-T疗法(chimeric antigen receptor T-Cell immunotherapy),嵌合抗原受体T细胞免疫疗法,即通过血细胞分离机体外采集患者自身的外周血,通过基因编辑工程使患者T细胞表面携带有针对肿瘤细胞抗原的特异性分子,靶向杀伤肿瘤细胞的新型免疫疗法,于2017年已获得美国食品药品监督管理局(FDA)批准用于治疗经一线以及二线治疗失败后的复发难治非霍奇金淋巴瘤[4]。新型免疫疗法的出现成为了复发难治非霍奇金淋巴瘤患者的福音。患者在行CAR-T治疗之前,由输血科协助进行单个核细胞采集,现将拟行单个核细胞采集的非霍奇金淋巴瘤患者以及健康供者采集前后的血细胞变化进行分析,同时探讨影响终产品单个核细胞数量的因素以更好的提高采集效率。
资料与方法
1 一般资料 选取2019年3月1日~2019年10月31日,在输血科进行单个核细胞(MNC)采集的非霍奇金淋巴瘤患者23例及健康供者22例为研究对象。其中非霍奇金淋巴瘤Ⅰ/Ⅱ期患者6例;Ⅲ/Ⅳ期患者17例。研究对象的一般资料如表1所示。
纳入标准:①体重:女≥45 kg,男≥50 kg;②血压:90/60 mmHg~160/100 mmHg;心率:60~100次/分;③一般状况良好;④血常规:血红蛋白:女≥110 g/L,男≥120 g/L,血小板计数≥100×109/L;⑤心电图各项参数检测值在正常范围;⑥凝血功能正常。排除标准:①严重心脑血管疾病;②活动性癫痫;③脏器功能衰竭;④凝血功能障碍伴活动性出血;⑤有严重的献血反应史或迟发型昏厥史;⑥晕厥;⑦采集前8 h行增强CT或增强核磁检查;⑧采集前有腹泻。
2 仪器与试剂 COM. TEC血细胞分离机(德国Fresenius公司);抗凝剂(四川南格尔生物科技有限公司)血液保存液(Ⅰ)500 mL,其主要组分为枸橼酸钠、枸橼酸、葡萄糖;0.9%氯化钠注射液(华仁药业股份有限公司);血常规以及产品血常规均由SysmexXS-800i系列全自动血液分析仪(Sysmex公司)进行检测。
3 采集参数 首先依据患者的血常规结果以及机器的采血效率计算所需循环血量,采血流速一般设置为60 mL/min,全血与抗凝剂的比例为1∶10;采集过程中根据患者的症状调整补钙的量以及速度,以减轻或避免枸橼酸盐反应(口唇麻木、四肢麻木、肌肉震颤或抽搐);持续床旁心电监护,密切关注患者一般生命体征,治疗过程中每隔20 min记录患者血压、心率、呼吸频率,如发现不良反应及时上报临床医生。
4 检测指标 采用血细胞分析仪,检测采集前后患者/供者外周血细胞计数和终产品血细胞计数;记录采集相关参数,包括采集时间、循环次数、单次循环量、总循环量、ACD用量、除去ACD的总循环量 、白膜泵出量、单次收集量、ACD:全血比值、流度;采集前/后单个核细胞计数=采集前/后淋巴细胞计数+采集前/后单核细胞计数;终产品单个核细胞计数=终产品淋巴细胞计数+终产品单核细胞计数。
5 统计学分析 应用Graphpad 8.0进行统计分析,计数资料以均数±标准差( ±SD)表示,多因素回归分析法进行多因素分析,筛出主要相关因素,P<0.05为差异有统计学意义。
结 果
1 非霍奇金淋巴瘤患者和健康供者的基本情况比较非霍奇金淋巴瘤供者和健康供者基本情况比较见表1。
2 采集过程中的采集参数情况 采集过程中非霍奇金淋巴瘤患者和健康供者采集参数见表2。
3 采集单个核细胞前后血细胞的变化
3.1 健康供者采集前后血细胞变化情况:行单个核细胞采集后,健康供者RBC、WBC、淋巴细胞、单核细胞、PLT均较采集前明显下降(图1)。其中,WBC和单核细胞较采集前平均下降约18%;RBC和PLT较采集前平均下降约20%;血红蛋白较采集前平均下降约21%;淋巴细胞较采集前平均下降约24%。
3.2 非霍奇金淋巴瘤患者采集单个核细胞前后血细胞的变化:非霍奇金淋巴瘤患者行单个核细胞采集后,白细胞、淋巴细胞、单核细胞、红细胞及血红蛋白计数较采集前明显下降(图2A、2B、2C),但血小板计数较采集前无明显变化(图2D)。其中,白细胞、红细胞、血红蛋白采集后较采集前下降约15%,淋巴细胞较采集前下降约16%,单核细胞较采集前下降约13%。

表1 两组人群基本情况比较

表2 非霍奇金淋巴瘤患者和健康供者的采集参数比较 ( ±SD)

图1 健康供者采集前后血细胞的变化情况
3.3 非霍奇金淋巴瘤患者与健康供者对比采集前后血细胞的变化:非霍奇金淋巴瘤患者采集单个核细胞前,白细胞计数、单个核细胞计数均较健康供者低(图3A、3C),采集后非霍奇金淋巴瘤患者白细胞计数、单个核细胞计数均低于健康供者(图3B、3D)。
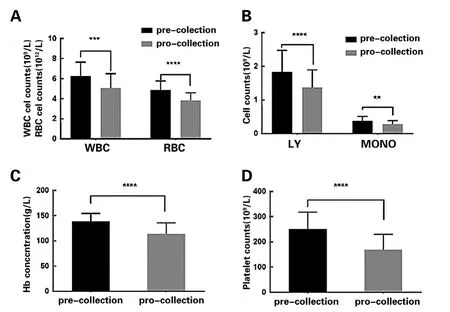
图2 非霍奇金淋巴瘤患者采集前后血细胞的变化情况
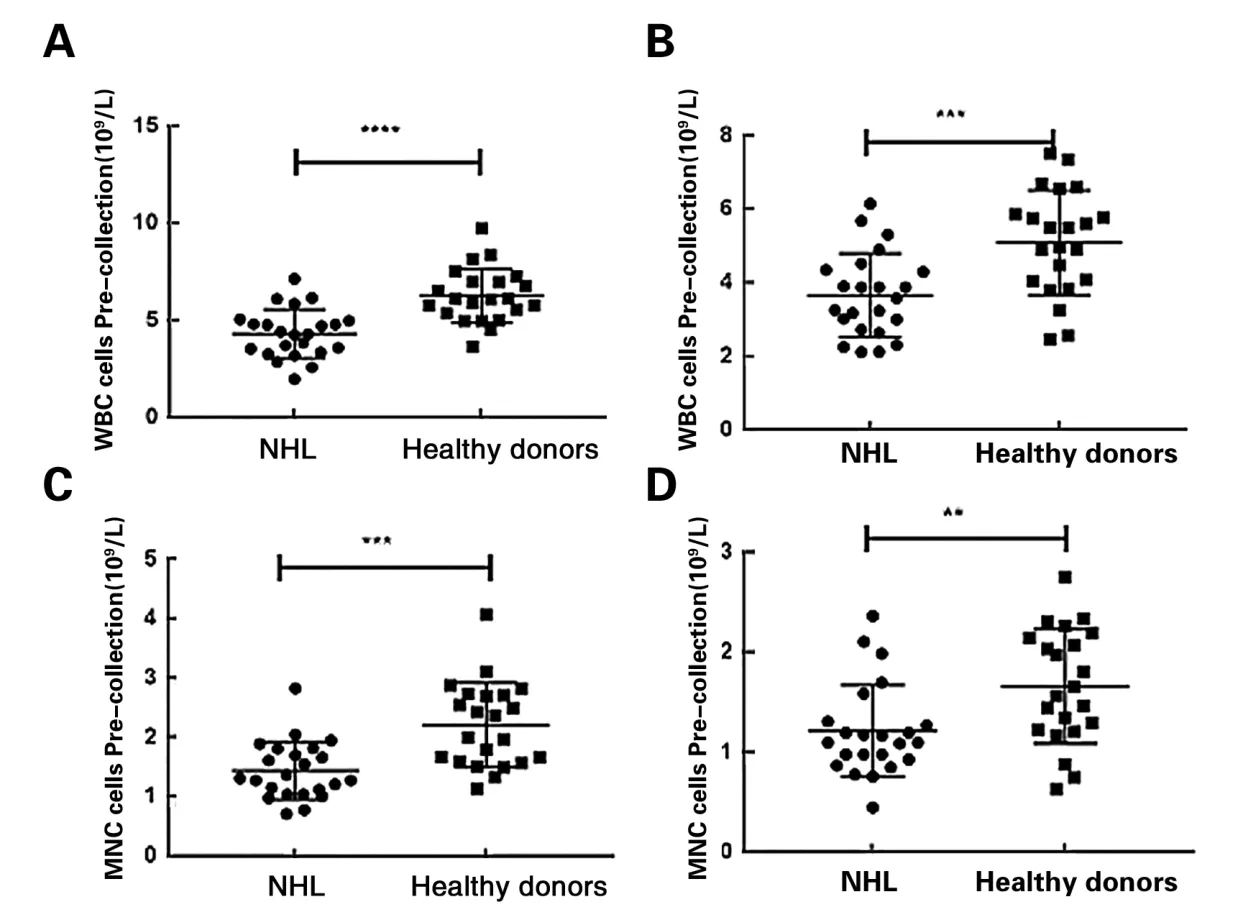
图3 非霍奇金淋巴瘤患者与健康献血者采集前后血细胞的变化
3.4 影响终产品单个核细胞数量的因素相关性分析:通过相关性分析发现,采集前单个核细胞的数量、采集前白细胞计数、采集时间、白膜泵出量、单次收集量、循环次数、单次循环量、总循环量与终产品单个核细胞数量呈现明显的线性相关。其中,随着单次循环量的增加,终产品单个核细胞数量(终产品单个核细胞浓度×终产品体积)呈现下降趋势;采集前MNC(包括淋巴细胞和单核细胞)的数量、采集前白细胞计数、采集时间、白膜泵出量、循环次数、总循环量与终产品MNC数量呈现明显的正向相关。而年龄、身高、体重、BMI、全身循环血量、流速与终产品MNC数量无明显相关性。
3.5 影响终产品MNC数量的多元线性回归分析:通过对影响终产品MNC数量的因素进行多元线性回归分析发现单次收集量、循环次数以及采集前MNC计数是影响终产品MNC计数的因素。回归系数如表3所示,回归方程为Ÿ=0.617a1+0.410a2+0.274a3,a1为单次收集量,a2为循环次数,a3为采集前MNC计数,回归方程检验的P<0.05,显示有统计学意义。

图4 影响最终产品MNC计数的相关因素分析
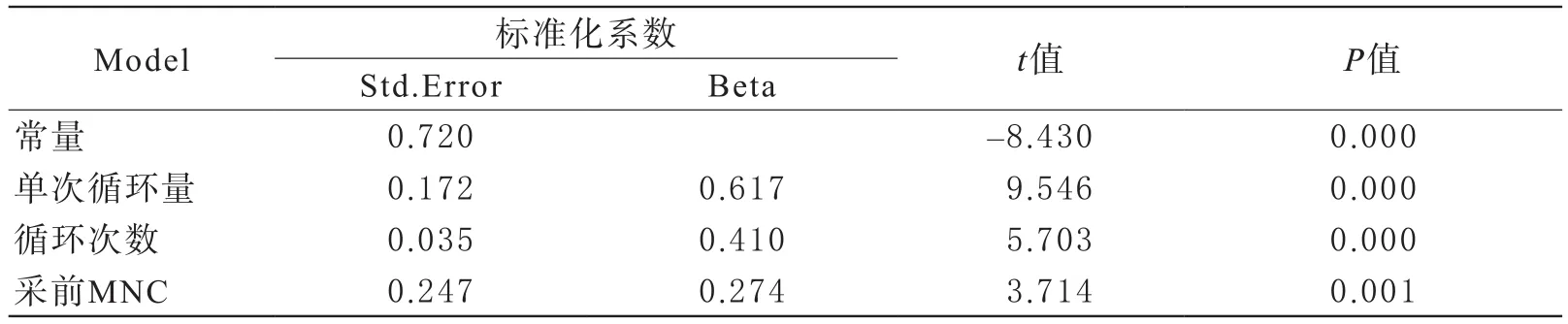
表3 MNC采集的多元线性回归分析
讨 论
近年来,CAR-T疗法在非霍奇金淋巴瘤中得到了广泛应用[5]。在进行CAR-T治疗之前,首先需要进行MNC采集,从外周血中分离获得富含MNC的细胞产品,经体外活化,基因编辑修饰,体外扩增,使T细胞稳定表达与靶抗原特异性结合的抗体,从而以非
MHC(major histocompatibility complex)限制性的方式特异杀伤靶抗原[6]。经血细胞分离机获得的富含MNC产品中MNC的数量是保证CAR-T治疗有效性的关键因素。我们选取了23名拟行CAR-T治疗的非霍奇金淋巴瘤患者以及22名健康供者进行MNC采集,分析采集前后的血细胞计数变化,为MNC采集机采条件提供依据,同时,总结影响终产品MNC数量的因素以更好的提高采集效率。
本研究的结果显示,无论是健康供者还是非霍奇金淋巴瘤的患者,进行MNC采集后,血细胞计数较采集前均会下降,健康供者血细胞下降幅度波动于18%~24%,平均下降约21%(图1);非霍奇金淋巴瘤患者血细胞下降幅度波动于13%~16%,平均下降约14.5%(图2)。健康供者与非霍奇金淋巴瘤患者相比,采集MNC后血细胞水平下降幅度较大。采集完成后血细胞的下降幅度与采集前血细胞计数水平密切相关,采集前非霍奇金淋巴瘤患者血细胞计数水平明显低于健康供者(图3),因而健康供者完成MNC采集后血细胞的下降水平较非霍奇金淋巴瘤患者下降幅度大。该结果提示我们在获得高质量的MNC产品同时,为保障供者及患者的健康水平,采集前选择外周血细胞计数较高的供者进行采集。
造成非霍奇金淋巴瘤患者血细胞计数水平明显低于健康供者(图3)的原因可能与入组的非霍奇金淋巴瘤患者皆为经传统一线治疗失败后的复发难治患者,行MNC采集前经历了多疗程化疗有关。文献报道[7]亦证实多疗程的放化疗会影响血细胞计数。因此,非霍奇金淋巴瘤患者,采集MNC之前可进行细胞动员,促进骨髓中的MNC释放入血,以获得更好的细胞产品。
为提高采集效率,保证产品质量,将采集前的血细胞计数,采集过程中的参数设置与终产品MNC数量进行相关性分析发现,采集前MNC计数>2×109/L,白细胞计数>4×109/L(图4A、4B),终产品中MNC计数较理想,该结果与国内陆华等[8]报道较为一致。
张根玲等[9]研究发现在儿童造血干细胞自体采集的患者中,终产品MNC计数与采集前集落刺激因子动员后的MNC数量有相关性。也有研究得出[10]终产品MNC计数与采集前WBC总数有关。本研究显示采集前MNC与终产品MNC计数呈正相关,而前期研究[11,12]发现终产品MNC与采集前淋巴细胞计数有相关性,分析原因可能是COM.TEC血细胞分离机是通过梯度密度离心方式将全血分离成不同的血液成分,通过界面探测器识别MNC进行提取,而单核细胞或淋巴细胞等单一因素可能不会影响终产品MNC数量,但此结果需扩大样本量后进一步证实。此外,本研究还发现采集者的身高、体重、BMI、全身循环血量不影响终产品MNC计数。除采集前血细胞计数外,机器参数设置也是影响外周血MNC细胞采集的主要因素。其中,随着采集时间、白膜泵出量、单次收集量、循环次数、总循环量的增加,终产品中MNC细胞数也随之增加(图4C-G)。然而,单次循环量增加,终产品单个核细胞计数并未增加,反而呈现下降趋势。单次循环血量控制在400~600 mL,即可获得高浓度的细胞产品(图4H)。单次收集量、循环次数以及采集前MNC细胞计数,三者之间互相制衡,共同影响最终产品中MNC细胞计数。
利益冲突所有作者均声明不存在利益冲突
