敲低S100A1通过降低WNT/β-catenin信号活性抑制甲状腺癌SW579细胞增殖
2021-05-06郑艳张茜孙菲
郑艳 张茜 孙菲
甲状腺癌是一种好发于女性的内分泌系统常见恶性肿瘤,近年来甲状腺癌的发病率逐年增加,据报道,目前我国新发甲状腺癌患者约占全身恶性肿瘤患者的3%,约占头颈部恶性肿瘤患者的5%[1,2]。根据组织病理学特征,甲状腺癌可分为乳头状癌、滤泡状癌、髓样癌及未分化癌等病理类型,其中,以甲状腺乳头状癌最为常见,约占甲状腺癌总数的85%,而甲状腺未分化癌最为少见,但恶性程度高,预后差[3,4]。目前,临床上对于甲状腺癌患者的主要治疗手段包括手术切除、I131放射治疗及内分泌治疗等[5]。早期患者能取得较好的治疗效果,但容易出现肿瘤复发;而对于晚期患者,治疗效果较差,5年生存率不容乐观[6]。因此,探究甲状腺癌的发病机制,寻找治疗晚期甲状腺癌患者的新途径仍是当前临床医生所关注的问题。
本研究基于GEO(Gene Expression Omnibus)数据库中人甲状腺癌数据集GSE50901和GSE138198,使用R软件进行差异基因的筛选并利用TCGA数据库对差异基因进行验证,筛选出靶基因S100A1,随后通过细胞和分子实验探究S100A1对人甲状腺癌SW579细胞增殖的影响及其可能的作用机制,有望为探索甲状腺癌药物治疗的新靶点提供依据。
材料与方法
1 实验材料 人甲状腺癌SW579细胞系购自上海通派生物科技有限公司;DMEM培养基、青链霉素双抗购自武汉普诺赛生命科技有限公司;RIPA裂解液购自上海碧云天生物技术有限公司;S100A1特异性siRNA序列(siS100A1)及对照组序列(siNeg)购自苏州泓迅生物科技股份有限公司;PC3.1-S100A1-HA过表达载体和对照组载体(PC3.1-EGFP-HA)购自广州云舟生物科技有限公司;HighGene转染试剂购自武汉爱博泰克生物科技有限公司;Cell Counting Kit-8 (CCK-8)试剂盒和胰酶购自武汉赛维尔生物科技有限公司;抗S100A1一抗购自赛默飞世尔科技公司;抗β-catenin,c-myc和cyclinD1一抗均购自美国CST(Cell Signaling Technology)公司;抗GAPDH一抗购自武汉三鹰生物技术有限公司。
2 方法
2.1 细胞培养:人甲状腺癌SW579细胞使用DMEM完全培养基(含10%胎牛血清和1%双抗)常规培养,取对数生长期细胞进行后续细胞实验。
2.2 细胞转染及分组:按照转染试剂说明书,将甲状腺癌SW579细胞接种在6孔板中,“8”字法摇匀,细胞转染时弃去培养基,PBS洗涤2次后加入不含血清的DMEM培养基,将siRNA或质粒按照比例(3 μL siRNA或3 μg质粒对应5 μL转染试剂)混匀,室温静置15 min后加入6孔板中,摇匀,转染48 h后提取总蛋白验证敲低及过表达效率,共包括4组,即敲低对照组(siNeg组),S100A1敲低组(siS100A1组),过表达对照组(EGFP组)和S100A1过表达组(S100A1组)。
2.3 细胞增殖检测:将质粒或siRNA转染48 h后的SW579细胞用胰酶消化重悬,均匀接种在96孔板中,调整细胞密度为5×103个/孔。待接种8h、24 h、48 h和72 h后,加入CCK-8试剂,用全自动酶标仪检测各孔细胞吸光度值(OD Value,波长450 nm)。
2.4 Western Blot:转染48 h后,用胰酶消化,离心后收集细胞,加入200 μLRIPA裂解液提取总蛋白;BCA法定量后,取20 μg总蛋白进行电泳分离;湿法转膜及5%脱脂奶粉封闭后,根据目的蛋白分子大小裁膜,置入相应的一抗(β-catenin,c-myc,cyclinD1和GAPDH)中孵育过夜;TBST洗膜后,加入辣根过氧化物酶标记的二抗,室温孵育1h后使用ECL试剂盒进行显影及曝光,使用ImageJ软件进行定量分析。
2.5 RNA-Seq测序:收集转染siNeg和siS100A1的SW579细胞,TRizol法提取总RNA,取0.5 μg总RNA进行逆转录和实时荧光定量PCR以检测siRNA的敲低效率,其余总RNA置于-80℃保存,由深圳华大基因股份有限公司完成RNA-Seq测序,使用GSEA4.0.3软件进行基因集富集分析(Gene Set Enrichment Analysis)。
2.6 差异基因筛选及富集分析:数据集GSE50901和GSE138198下载自GEO数据库,使用R软件及Limma包等功能包筛选差异基因,设置筛选条件为|log2(Fold Change)| >1且P.Val<0.05,使用ggplot2、pheatmap等功能包进行绘图和数据可视化。
3 统计学处理 应用SPSS20.0统计软件进行数据分析,结果以均数±标准误( ±SEM)表示,使用配对t检验进行统计学分析,P<0.05表示差异有统计学意义。
结 果
1 甲状腺癌生物信息学分析 选取GEO数据库中甲状腺癌数据集GSE50901,共含有65个甲状腺组织样本,其中正常组织4个,甲状腺癌组织61个,对该数据集进行分析发现,与正常甲状腺组织相比,甲状腺癌组织中有454个基因表达水平发生改变,其中208个基因表达下调,246个基因表达上调(图 1A);选取GEO数据库中数据集GSE138198,共含有17个甲状腺组织样本,其中正常组织3个,甲状腺癌组织14个,对该数据集进行分析发现,与正常甲状腺组织相比,甲状腺癌组织中有2 324个基因表达水平发生改变,其中953个基因表达下调,1 371个基因表达上调(图1B)。
2 S100A1在甲状腺癌中高表达 对数据集GSE50901和GSE138198进行联合分析发现,有97个基因在两个数据集中均发生上调,46个基因均发生下调(图2A),其中,S100A1基因在甲状腺癌中高表达(图2B和2C)。此外,对TCGA数据库中甲状腺癌样本数据进行分析发现,与正常组织相比,甲状腺癌组织的S100A1基因表达水平明显上调(图 2D)。
3 S100A1对甲状腺癌SW579细胞增殖的影响 对人来源的正常甲状腺细胞系HT-ori3和甲状腺癌细胞系(TPC-1,K1,SW579,BCPAP)进行S100A1蛋白检测,发现甲状腺癌SW579细胞中S100A1蛋白水平显著升高(图 3A和3B)。通过siRNA干扰或者质粒转染的方式敲低或过表达SW579细胞的S100A1蛋白(图 3C和3D),发现敲低S100A1能抑制SW579细胞的增殖,过表达S100A1则能促进SW579细胞的增殖(图 3E和3F)。

图1 甲状腺癌组织生物信息学分析

图2 S100A1在甲状腺癌组织中高表达
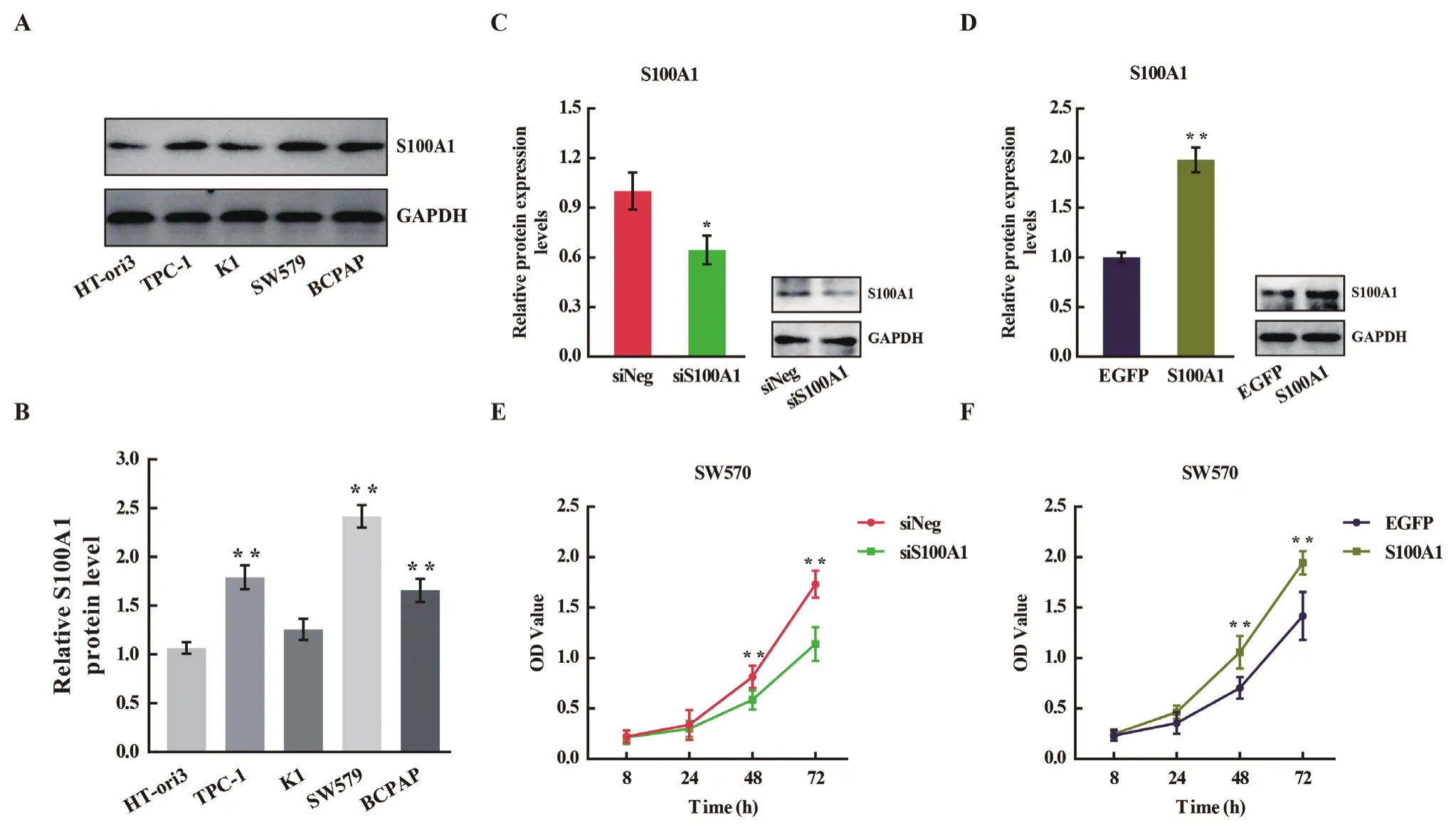
图3 S100A1在甲状腺癌细胞系中的表达及对SW579细胞增殖的影响
4 S100A1对WNT/β-catenin信号通路的影响 为进一步探究S100A1促进甲状腺癌SW579细胞增殖的作用机制,本研究采用RNA-Seq测序分析,对基因表达矩阵进行基因集富集分析(GSEA)发现,敲低SW579细胞中S100A1后,WNT信号显著富集,且表现为信号通路活性降低(图4A和4B)。Western blot结果表明,siS100A1组细胞中β-catenin,c-myc和cyclinD1的蛋白表达水平显著低于siNeg组(图4C和4E),而S100A1组细胞中β-catenin,c-myc和cyclinD1的蛋白表达水平显著高于EGFP组(图4D和4F)。
讨 论
S100A1属于钙结合蛋白S100家族中的一员,其基因定位于人1号染色体长臂21区,在体内主要以同源二聚体的形式存在[7]。S100A1蛋白羧基末端含Ca2+结合位点,通过与Ca2+结合,控制Ca2+内流,引起细胞内Ca2+稳态失衡,导致下游一系列改变[8];同时,S100A1蛋白与Ca2+结合后会发生蛋白构象改变,暴露出疏水裂隙,通过与不同的靶蛋白结合,参与调控各种生物学过程[9]。既往研究表明,S100A1广泛参与调控细胞收缩、细胞凋亡、细胞分化及基因转录等生物学过程[10,11],而越来越多的研究发现,S100A1在多种恶性肿瘤中异常表达,参与肿瘤的发生发展,调控肿瘤细胞的增殖、转移、耐药等[12,13]。GUO[14]等发现,S100A1在肝癌中高表达,并与肿瘤分级、分期及预后密切相关,通过与LATS1蛋白相互作用,调控下游Hippo信号通路从而影响肝癌细胞的增殖。TIAN[15]等发现,S100A1在卵巢癌肿瘤样本中高表达,并与卵巢癌淋巴结转移密切相关,进一步细胞实验结果表明,过表达S100A1能显著提高卵巢癌细胞的迁移和侵袭能力。这些研究提示,S100A1可能作为癌基因参与调控恶性肿瘤的发生发展,与肿瘤细胞的增殖、迁移、侵袭等生物学行为密切相关,而目前关于S100A1对甲状腺癌调控作用的报道较少。
本研究通过分析人甲状腺癌数据集GSE50901和GSE138198,发现有97个基因在此两个数据集中均发生上调,46个基因均发生下调,其中S100A1基因在甲状腺癌中高表达。进一步分析TCGA数据库中甲状腺癌组织样本的转录组数据,发现S100A1基因在肿瘤组织中明显上调,提示S100A1基因的高表达可能参与甲状腺癌的发生和发展,因此本研究选择S100A1基因进行后续研究。为进一步探究S100A1基因在甲状腺癌中的作用,本研究检测了敲低或过表达S100A1对人甲状腺癌SW579细胞增殖的影响。结果表明,敲低S100A1能抑制SW579细胞的增殖,而过表达S100A1则能促进SW579细胞的增殖,说明S100A1在甲状腺癌的细胞增殖中具有重要作用。

图4 S100A1对WNT/β-catenin信号通路蛋白表达的影响
为探究S100A1促进甲状腺癌细胞增殖的作用机制,本研究通过siRNA干扰的方式敲低SW579细胞的S100A1蛋白表达,随后进行RNA-Seq测序分析,对基因表达矩阵进行基因集富集分析发现,敲低SW579细胞的S100A1后,WNT信号显著富集,且表现为信号通路活性降低。WNT信号通路是哺乳动物细胞中一条高度保守的信号转导通路,由WNT配体蛋白和膜蛋白受体及下游信号分子组成,其中最为经典的是WNT/β-catenin信号,通过一系列级联反应,可引起β-catenin蛋白入核,与细胞核中不同的转录因子结合调控下游靶基因Myc,CCND1等的表达[16]。既往研究表明,WNT/β-catenin信号通路在恶性肿瘤中异常激活,并与肿瘤的发生、发展密切相关,参与调控肿瘤细胞的增殖、分化、耐药、转移等生物学过程[17]。邵宇鑫[18]等发现β-catenin在分化型甲状腺癌中异常表达,并与其进展和转移密切相关。张贵军[19]等研究表明,β-catenin及WNT/β-catenin信号通路下游蛋白cyclin D1在甲状腺癌组织中高表达,并与肿瘤病理类型、临床分期及转移相关,这些研究均提示WNT/β-catenin信号通路激活与甲状腺癌的发生、发展密切相关,而抑制WNT/β-catenin信号通路活性能发挥抗甲状腺癌作用。因此,为进一步探究S100A1促进甲状腺癌SW579细胞增殖的作用机制,本研究检测了S100A1敲低或过表达对WNT/β-catenin信号通路活性的影响。Western blot结果表明,敲低S100A1能降低β-catenin,c-myc和cyclinD1蛋白表达水平,而过表达S100A1则能提高β-catenin,c-myc和cyclinD1的蛋白表达水平,说明S100A1蛋白可能是通过调控WNT/β-catenin信号通路活性影响甲状腺癌SW579细胞的增殖。为了深入探讨WNT/β-catenin信号通路在S100A1蛋白介导的甲状腺癌细胞增殖中的作用,后续研究需要在敲低S100A1蛋白的同时激活WNT/β-catenin信号通路,或过表达S100A1蛋白的同时使用抑制剂等方式抑制WNT/β-catenin信号通路以探究能否逆转S100A1蛋白对甲状腺癌细胞增殖的影响。此外,本研究尚未探究S100A1调控WNT/β-catenin信号通路活性的具体机制,这也是后续进一步研究的重点。
总之,本研究表明,S100A1在甲状腺癌中高表达,敲低S100A1可能是通过抑制WNT/β-catenin信号通路活性从而抑制甲状腺癌细胞增殖,S100A1可能成为潜在的甲状腺癌药物治疗的新靶点。
利益冲突所有作者均声明不存在利益冲突
