异鼠李素通过减轻氧化应激改善游离脂肪酸诱导肝细胞脂质沉积
2021-04-30周健杜凤康秉文殷草草蒋杉石莹王玥周耿瑶秦绪军王枫空军军医大学军事预防医学系军队健康教育与管理教研室西安7003陕西中医药大学公共卫生学院陕西咸阳7046
周健,杜凤,康秉文,殷草草,蒋杉,石莹,王玥,周耿瑶,秦绪军*,王枫*(.空军军医大学军事预防医学系 军队健康教育与管理教研室,西安 7003;.陕西中医药大学公共卫生学院,陕西 咸阳 7046)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是指在非过度饮酒的情况下,肝脏发生的脂质沉积现象,并排除药物、自身免疫、病毒等因素造成的肝脏疾病[1],以过量的三酰甘油(triacylglycerol,TG)在肝脏中聚积为特征[2]。NAFLD 已成为全世界人们在慢性病领域关注的焦点,我国预计在2030年成为NAFLD导致肝脏相关疾病死亡率最高的国家[3]。对于目前重症NAFLD 患者而言,除了改变不健康的生活方式之外,急需能够有效治疗NAFLD 的药物。NAFLD 发病机制复杂,致病因素众多。目前“多重打击学说”认为形成NAFLD 的因素包括肝脏TG 沉积,胰岛素抵抗(insulin resistance,IR),自噬能力减弱,炎性因子刺激以及氧化应激(oxidative stress,OS)等[4]。有研究表明,当大量活性氧(reactive oxygen species,ROS)发生OS 时,线粒体功能受到抑制,核因子相关因子2(NF-E2-related factor 2,Nrf2)与其内生的抑制剂Kelch 样ECH 相关蛋白1(Kelch-like ECHassociated protein 1,keap1)的分离可能会受到抑制,影响抗氧化基因表达,形成恶性循环,使细胞功能受损,诱发脂质沉积[5]。因此抗氧化是防治NAFLD 的重要研究内容之一。
异鼠李素(isorhamnetin,Iso)由沙棘中分离而得,是黄酮类化合物槲皮素的直接代谢产物之一[6]。沙棘具有缓解咳嗽,促进食欲的功效,被广泛用于治疗轻症的呼吸系统炎症、高原肺病、食欲不振等[7]。近几年,异鼠李素更是被证明具有保护心血管、抗炎、调节免疫、抗肿瘤、缓解肝脏纤维化等多种作用[8-11]。此外,异鼠李素抗氧化能力较强[9,12-13],能调节Nrf2 通路,从而增强血红素加氧酶1(HO-1)、谷氨酸半胱氨酸连接酶修饰亚基(GCLM)、谷氨酸半胱氨酸连接酶催化亚基(GCLC)等抗氧化基因的表达,缓解超氧化物歧化酶(SOD)过分消耗,减少ROS产生,从而缓解OS,起到抗氧化保护作用[14-15]。异鼠李素是否可以通过调节Nrf2 通路来缓解OS造成的损伤从而减轻NAFLD,尚不明确。本研究采用游离脂肪酸(FFA)构建体外脂质沉积模型,观察异鼠李素对细胞产生的ROS、抗氧化系统以及TG 沉积的变化影响,初步探讨异鼠李素抗NAFLD 的可能性及其分子机制。
1 仪器与试药
1.1 仪器
二氧化碳孵育箱(美国Thermo);紫外线超净台(江苏苏净安泰);台式离心机(陕西环宇);CKX41 倒置显微镜(日本Olympus);高速冷冻离心机5424 R(德国Eppendorf);Infinite200 PRO 全波长多功能酶标仪(德国Tecan);流式细胞仪(美国BD);Trans Blot Turbo 蛋白转印系统、蛋白电泳仪、凝胶成像系统(美国Bio-Rad)。
1.2 试药
异鼠李素(美国TargetMol,纯度≥98%,批号:T2836);胎牛血清(FBS)、DMEM 高糖培养基(美国Gibco);蛋白定量分析试剂盒(美国Thermo);青-链霉素溶液(上海源培);油红O、荧光探针(美国Sigma);过氧化氢酶(CAT)试剂盒、总SOD 试剂盒(上海 Beyotime);苏木精(珠海贝索);TG 试剂盒(日本Wako);CCK-8试剂盒(上海汉恒);浆蛋白核蛋白提取试剂盒、丙二醛(MDA)试剂盒(江苏凯基);Actin、CAT、SOD1、GPx1、GCLM 兔 抗单 克隆抗 体、SOD2 鼠抗单克隆抗体(美国Santa Cruz);Nrf2兔抗单克隆抗体(武汉 Proteintech);GCLC 兔抗单克隆抗体(南京巴傲德);HO-1 兔抗单克隆抗体(英国Abcam);ML385(美国TargetMol)。
2 方法
2.1 L-02 细胞培养与处理
人肝L-02 细胞(由中科院上海细胞库购买)接种于含10% FBS、1%青-链霉素的DMEM 高糖培养基中,在37℃、5% CO2的孵育箱中培养。取处于对数生长期细胞,均匀接种于96 孔板(用于CCK-8 实验)与6 孔板(用于蛋白水平表达等其他测定)中。油酸与棕榈酸按2∶1 的比例溶于BSA中配制成FFA[14]。将细胞分为3 组:对照(control)组,FFA 组,FFA +Iso 组。其中FFA 浓度为0.6 mmol·L-1,异鼠李素浓度为10 μmol·L-1,共处理7 d。每组设立3 个平行样。
2.2 细胞活力检测
采用CCK-8 细胞增殖试剂盒检测细胞活力。取对数生长期细胞按说明书均匀接种于96 孔板,分别给予0、5、10、20、40、80 μmol·L-1的异鼠李素培养24 h,再用10 μL CCK-8 溶液进行反应,37℃孵育2 h,在450 nm 处测定吸光度。
2.3 油红O 染色
油红O 充分溶于异丙醇中,过滤后配制5 g·L-1的储存液,与超纯水按3∶2 混合,过滤后配制成油红O 工作液。4%多聚甲醛处理细胞30 ~60 min 用于固定,60%异丙醇孵育3 min,油红O 工作液孵育5 min。苏木素孵育1 min 后进行清洗,直到呈现紫蓝色,显微镜下观察[15]。
2.4 细胞TG 检测
采用TG 试剂盒,通过GPO-DAOS 法测定细胞中TG 含量。按照试剂盒的说明进行操作:细胞用RIPA 裂解液常规裂解,4℃、14 000 g 离心20 min 后取上清液。检测液A 与B 按1∶1 混合。取2 μL 上清液加入300 μL 混合好的检测液,37 ℃孵育至少30 min,在600 nm 处测定吸光度。
2.5 细胞总ROS 检测
采用2',7'-二氯荧光黄双乙酸盐(DCFHDA)荧光探针标记,流式细胞仪检测荧光强度[16]。L-02 细胞消化重悬,加入浓度为10 μmol·L-1的DCFH-DA,37℃避光孵育30 min,孵育完成清洗3 次,重悬后用流式细胞仪FL-1通道测定平均荧光强度,激发波长为488 nm,发射波长为525 nm。
2.6 细胞MDA 含量、总SOD 活性和CAT 活性检测
在样品充分裂解后,按照说明进行操作,测定MDA、总SOD 活性及CAT 活性。MDA 荧光强度检测采用激发波长515 nm、发射波长553 nm。总SOD 活性采用450 nm 波长测定吸光度,CAT 活性采用520 nm 波长测定吸光度。
2.7 核蛋白与浆蛋白提取
采用核蛋白、浆蛋白提取试剂盒提取核蛋白及浆蛋白,在细胞中加入预冷的450 μL Buffer A与50 μL Buffer B,混匀,冰上放置30 min。4℃、3000 g 离心10 min,上清液即为胞浆蛋白。沉淀加入100 μL Buffer C,涡旋震荡15 s,冰上裂解60 min。4 ℃、14 000 g 离心30 min,上清液即为核蛋白。
2.8 Western blot
依照BCA 法,测定蛋白浓度。配制相应浓度的凝胶依次上样,恒压150 V 电泳60 min。电泳结束后,将蛋白转移至PVDF 膜上。5%脱脂奶粉室温孵育2 h。一抗在4 ℃孵育12 h,用TBST洗膜,共3次。二抗在25℃孵育2 h,TBST 洗膜,共4 次。发光液A 与发光液B 按1∶1 混匀,覆于PVDF 膜表面,并用凝胶成像进行成像。最后采用Bio-Rad Quantity One 软件对条带进行定量分析。
2.9 统计学分析
通过SPSS 22.0 统计分析软件,实验数据以±s形式表示。多组间数据采用单因素方差分析(One-way ANOVA),运用Dunnett’st检验比较实验组与对照组之间的统计学差异,以P<0.05为差异有统计学意义。
3 结果
3.1 异鼠李素对L-02 细胞活力的影响
当 浓度≤20 μmol·L-1时,异鼠 李 素对细胞活力的影响无显著区别;而当浓度≥40 μmol·L-1时,细胞活力显著降低(见图1)。因此,为了避免细胞活力受影响,选择浓度为10 μmol·L-1的异鼠李素进行干预。
3.2 异鼠李素对FFA 诱导的L-02 细胞中TG 水平的影响
与Control 组相比,经FFA 处理的细胞红色斑点大量生成,TG 水平显著提高;而经异鼠李素干预后,红色斑点显著减少,表明细胞内TG水平显著下降(见图2)。
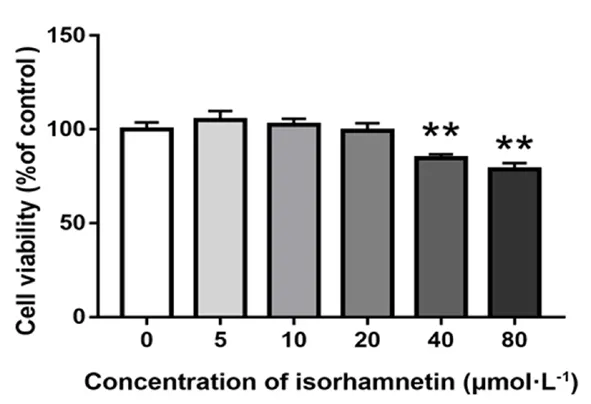
图1 不同浓度的异鼠李素处理后对L-02 细胞活力的影响(24 h)Fig 1 Effect of different concentrations of isorhamnetin on the viability of L-02 cells(24 h)

图2 异鼠李素对FFA 诱导的L-02 细胞中TG 水平的影响(7 d)Fig 2 Effect of isorhamnetin on TG level in L-02 cells induced by FFA(7 d)
3.3 异鼠李素对FFA 诱导的L-02 细胞中总ROS及MDA 水平的影响
与Control 组相比,FFA 组的总ROS 水平与MDA 水平均显著增高,表明FFA 可诱导细胞发生OS,使细胞受损;而经异鼠李素干预后,细胞总ROS 水平与MDA 水平均明显降低,表明异鼠李素可以有效缓解FFA 造成的OS 损伤(见图3)。
3.4 异鼠李素对FFA 诱导的L-02 细胞中抗氧化酶的影响
与Control 组相比,FFA 组SOD1、SOD2、GPx1的表达水平均显著下降;在异鼠李素干预后,SOD1、SOD2、GPx1 的表达水平显著提高(见图4A)。除此之外,FFA 可显著降低L-02 细胞总SOD 活性,而异鼠李素干预后总SOD 活性显著增加(见图4B)。
3.5 异鼠李素对FFA 诱导的L-02 细胞中Nrf2 蛋白及其下游蛋白水平的影响

图3 异鼠李素对FFA 诱导的L-02 细胞的总ROS 与MDA 水平的影响(7 d)Fig 3 Effect of isorhamnetin on total ROS and MDA level in L-02 cells induced by FFA(7 d)
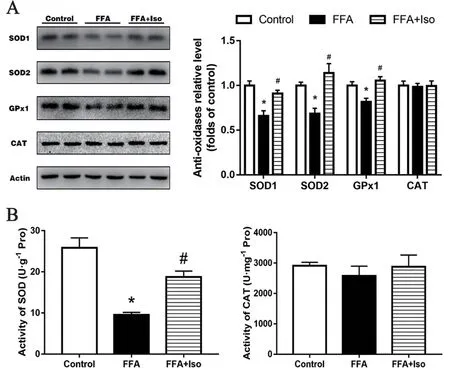
图4 异鼠李素对FFA 诱导的L-02 细胞的抗氧化酶的影响(7 d)Fig 4 Effect of isorhamnetin on anti-oxidases in L-02 cells induced by FFA(7 d)
FFA 处理后L-02 细胞胞核内的Nrf2 蛋白水平显著下降,Nrf2 下游的GCLC、GCLM 的表达水平也显著下降。与FFA 组相比,异鼠李素干预后细胞质中的Nrf2 蛋白(cyt Nrf2)水平显著下降,而细胞核中的Nrf2 蛋白(nuc Nrf2)水平则显著升高(见图5A);Nrf2 下游的蛋白表达水平也有显著提高(见图5B)。
3.6 抑制Nrf2 后异鼠李素对FFA 诱导的L-02 细胞中TG 水平的影响
与Control 组相比,FFA 组TG 水平显著升高,而异鼠李素进行干预后TG 水平有明显的下降,表明异鼠李素可以减轻FFA 诱导的脂质沉积。而在应用Nrf2 特异性抑制剂ML385(1 μmol·L-1)与异鼠李素共同处理后,细胞内TG水平明显回升,表明Nrf2 在受到抑制后,异鼠李素缓解脂质沉积的作用下降,进一步表明异鼠李素可能是通过调节Nrf2 通路缓解FFA 诱导的脂质沉积(见图6)。
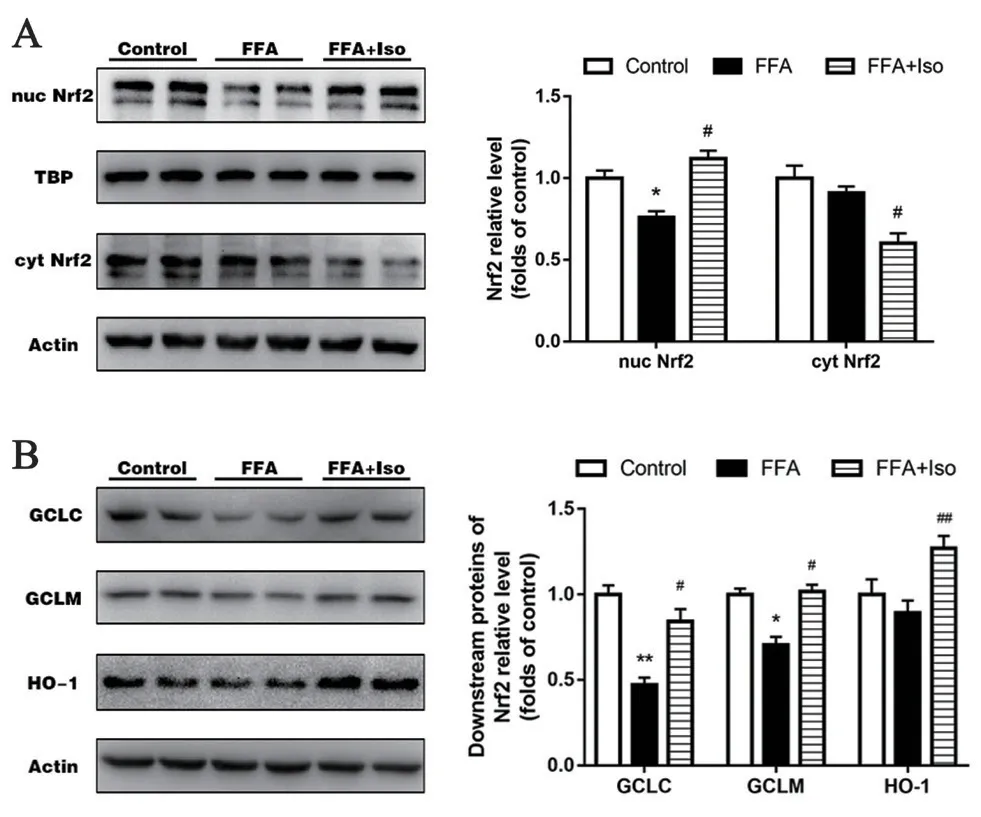
图5 异鼠李素对FFA 诱导的L-02 细胞中Nrf2 蛋白及其下游蛋白水平的影响(7 d)Fig 5 Effect of isorhamnetin on Nrf2 and its downstream proteins in L-02 cells induced by FFA(7 d)
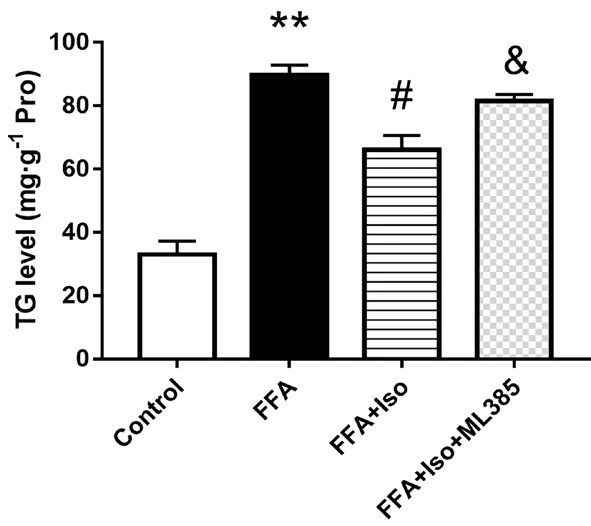
图6 抑制Nrf2 后异鼠李素对FFA 诱导的L-02 细胞中TG 水平的影响(7 d)Fig 6 Effect of isorhamnetin on the TG level in L-02 cells induced by FFA after the inhibition of Nrf2(7 d)
4 讨论
OS 是ROS 生成超过抗氧化的能力时出现的一系列应激反应,与NAFLD 的发生有着密切的联系。过量的游离脂肪酸在肝细胞线粒体内发生β氧化,造成ROS 的不断聚积,影响线粒体的活性,导致脂肪酸转化为TG 储存在肝细胞内,进一步破坏线粒体结构与功能,产生更多的ROS[17],大量TG 沉积在肝脏中最终形成NAFLD。而NAFLD 的形成也进一步使肝细胞受到脂质毒性的侵害,加重线粒体的破坏,产生更多的ROS,从而诱导IR与炎症的发生,进一步使OS 损伤加剧,形成恶性循环[18]。因此,通过减少ROS 成为预防或治疗NAFLD 的潜在有效手段[19]。
异鼠李素具有保肝的作用,可以有效缓解多种因素引起的肝细胞坏死与凋亡,这其中的机制可能与抗氧化相关[20]。在本研究中,我们发现FFA 可以诱导L-02 细胞发生脂质沉积,并且可以引起细胞发生OS 损伤,产生大量ROS,消耗多种抗氧化酶。而异鼠李素则可以有效缓解FFA诱发的脂质沉积,减少细胞中TG 的水平,并且缓解OS 损伤,减少ROS 与MDA 的水平,提高SOD1、SOD2、GPx1 的表达与活性,表明异鼠李素可能通过抗氧化来缓解脂质沉积。Nrf2 是上游重要的抗氧化转录因子,其调控机制尚不完全明确。但目前普遍的观点认为,当遇到亲电物质攻击或是发生磷酸化使其构象发生改变[21],Nrf2就会与keap1 分离进入细胞核,与一个小蛋白形成异二聚体,并识别抗氧化反应原件(antioxidant response element,ARE)序列,加强下游抗氧化蛋白表达,从而减轻ROS 带来的破坏,维持细胞的稳态[22]。此外,当keap1 发生构象的改变或是Nrf2 mRNA 水平上调,都可以促使Nrf2 通路的激活。我们进一步的研究发现,异鼠李素可以通过调控Nrf2 信号通路,促进Nrf2 进入细胞核,从而提高HO-1、GCLC、GCLM 的表达水平。这些结果表明异鼠李素可能是通过提高Nrf2 的转录活性,减轻了OS,从而缓解了FFA 诱导的脂质沉积。接下来本课题组应用Nrf2 的特异性抑制剂,发现异鼠李素缓解脂质沉积的作用减弱,细胞中TG 水平增加,这进一步表明Nrf2 通路是异鼠李素缓解脂质沉积的重要通路。Ganhold等[23]的研究证明异鼠李素可以缓解小鼠肝脏中的脂质沉积,其中的机制可能与过氧化物酶体增殖物激活受体γ(peroxisome proliferators activated receptorγ,PPARγ)通路有关。PPARγ通路与脂质合成相关,而有文献报道Nrf2 可以调控PPARγ通路,因此异鼠李素还有可能通过调控Nrf2 抑制脂肪从头合成,从而缓解脂质累积[24]。
综上所述,本研究采用NAFLD 体外细胞模型,发现异鼠李素可显著缓解FFA 引起的OS,提高细胞抗氧化的能力,降低FFA 诱导的脂质沉积,而调控Nrf2 通路是其中抗氧化的重要机制。该研究结果为进一步研究异鼠李素防治NAFLD提供了实验依据。
