中药爵床抗血小板聚集的活性物质及作用机制研究
2021-04-30陈鹏宇姚云峰张莹柯辛格余兵吴和珍杨艳芳肖学成湖北中医药大学药学院武汉430065中药资源与中药化学湖北省重点实验室武汉430061老年病中药新产品湖北省协同创新中心武汉430061
陈鹏宇,姚云峰,张莹,柯辛格,余兵,吴和珍,3,杨艳芳,3,肖学成(1.湖北中医药大学药学院,武汉 430065;2.中药资源与中药化学湖北省重点实验室,武汉 430061;3.老年病中药新产品湖北省协同创新中心,武汉 430061)
血栓形成是由于血管或心脏内流动的血液变为固态。血栓会导致血流阻塞,引发心肌梗死或者中风等血栓性疾病,对人们的健康产生严重危害[1];血小板是一种无核细胞,来自于骨髓巨核细胞,它的黏附、聚集、释放对于血管内血栓的形成具有重要作用。影响血小板的黏附、聚集等过程也是抗血栓药物研发的主流靶点[2-4]。阿司匹林、氯吡格雷等化学药物具有抗血小板聚集的作用,是目前临床上常用的血小板聚集抑制剂,其被广泛运用于治疗血栓性疾病[5]。但这些药物往往存在着作用机制单一、不良反应较大的缺点,难以被需要长期服药的患者所接受。故筛选安全有效的新的抗血小板聚集药物有着十分重要的意义。整合素β3主要在血小板中表达,是抗血小板治疗的首要靶点。根据课题组前期实验,初步确定爵床提取物抗血小板聚集的可能靶蛋白为整合素β3。
中药是新药研发的宝库,其安全性和有效性在几千年的药用历史中得到了检验。《神农本草经》最早收录了爵床,记载其味辛苦咸,性寒,入肝、肺、膀胱经,主治清热解毒、利尿消肿、截疟[6]。爵床中主要含有黄酮、生物碱、木脂素以及三萜类等成分,根据现代药理学研究,爵床具有镇痛、抑菌、抗炎以及抗肿瘤的作用[7-9]。课题组前期研究证实,爵床中的活性物质可以抑制血小板聚集,但具体的药效物质基础、作用机制还不完全清楚[10]。本文通过大孔吸附树脂法、制备性液相色谱法等分离纯化爵床中的活性成分,得到单体成分;构建动物模型来筛选活性物质,通过体外血小板实验和体内实验验证其药效,并初步探索抗血小板聚集的作用机制,为爵床进一步研究提供理论基础和实验数据。
1 材料
1.1 试药
爵床药材采于湖北宜昌,由湖北中医药大学药学院的吴和珍教授鉴定为爵床科植物爵床[Rostellularia procumbens(Lin.)Nees]的干燥全草。
D101 大孔吸附树脂(M0041)、角叉菜胶(C8830)(Solarbio 公 司);LDH 试剂盒(批 号:A019-2-2,南京建成生物医药有限公司);凝血酶(Thrombin,THR,规格:100 units,批号:T6884)、胶原(Collagen,COL,规格:25 mg,批号:C7661)及二磷酸腺苷(adenosine diphosphate,ADP,规格:100 mg,批号:A2754)(美国Sigma公司);阿司匹林肠溶片(Aspirin,ASP,规格:100 mg/片,批号:J20171021,拜耳医药);复方丹参片(规格:0.32 g/片,批号:Z41021966,仲景宛西制药);罗丹明鬼笔环肽300T(批号:CA1610,上海YEASEN 公司);RIPA 裂解液(批号:P0013B,碧云天);Integrinβ3抗体(批号:13166)、GAPDH 抗体(批号:5174)和二抗(批号:7074)(美国Cell Signaling Technology 公司)。
1.2 仪器
高效液相色谱仪(安捷伦1200)、Eclipse XDB-C18(4.6 mm×150 mm,5 μm)色谱柱、Eclipse XDB-C18(9.4 mm×250 mm,5 μm)色谱柱(美国Agilent 公司);LX51-F22FL/PH 荧光显微镜(日本OLYMPUS 公司);LBY-NJ4 血小板聚集仪(北京泰利康信科技公司);电泳仪EPS600、微型垂直电泳槽VE180(上海天能科技有限公司);化学发光凝胶成像系统Fluor Chem FC3(美国ProteinSimple 公司)。
1.3 实验动物
SPF 级雄性KM 小鼠60 只,体质量 18 ~20 g[许可证号:SCXK(鄂)2017-0012]、普通级新西兰雄兔2 只,体质量 2 ~2.5 kg [许可证号:SCXK(鄂)2016-0011,湖北省疾病预防控制中心];SPF级雄性SD 大鼠72 只,体质量190 ~230 g [许可证号:SCXK(鄂)2017-0012,三峡大学实验动物中心]。提供充足的水和饲料,环境温度保持在20 ~22℃,相对湿度30%~50%,每日控制照明12 h,适应性喂养7 d 后开始试验。
2 方法
2.1 筛选爵床抗血小板聚集活性部位
2.1.1 爵床活性部位的分离 取25 kg 爵床药材,粉碎,过2 号筛(24 目),按料液比1∶10(g/mL)加入80%乙醇渗漉提取后将渗漉液合并,溶剂减压回收至无醇味,即得总提取液。以D101大孔吸附树脂上样总提取液,以30%~90%乙醇梯度洗脱,得到A 组322.4 g(30%乙醇洗脱流分)、B 组107.4 g(45%乙醇洗脱流分)以及C 组160.8 g(90%乙醇洗脱流分)。将各组的洗脱液减压浓缩至近干。将适量的无水乙醇加入C 组浸膏中并超声15 min 溶解,抽滤。重复数次以除去色素,将沉淀(RPE)样品记为C1组(21.0 g),滤液记为C2组(126.6 g)。
2.1.2 爵床活性部位的筛选 将KM 雄性小鼠随机分成溶剂组、模型组、A 组、B 组、RPE 组、C2组,每组小鼠10 只。每日用0.5%CMC-Na 溶液给溶剂组和模型组小鼠灌胃,不同质量浓度的药液给A 组、B 组、C1组、C2组小鼠灌胃,药物以0.5%的CMC-Na 溶液制成混悬液。具体给药剂量由前期的急性毒性实验、预实验结果以及各组分的含量确定。A 组、B 组、C1组和C2组的药物质量浓度分别是16.1、5.4、1.1、6.3 mg·mL-1,分别相当于生药量1.25、1.26、1.3、1.24 g·mL-1。每日灌胃一次并持续7 d。最后一次给药前12 h禁食,自由饮水,给药1 h 后腹腔注射0.2%的角叉菜胶溶液将给药组与模型组小鼠造模,溶剂组腹腔注射等量生理盐水。室温控制为20℃。A 组、B 组、C1组、C2组小鼠给药的体积为0.2 mL/10 g,腹腔注射角叉菜胶溶液的体积为0.1 mL/10 g。造模12 h 后根据小鼠黑尾程度计算黑尾率,黑尾率(%)=小鼠黑尾部分长度/小鼠尾全长×100%
2.1.3 爵床活性部位的成分检测 称取RPE 50 mg 置于10 mL 量瓶中,以一定量的乙腈超声30 min 使之溶解,冷却后用乙腈定容,充分摇匀,0.22 μm 微孔滤膜过滤,取续滤液进样检测。
液相分析采用Eclipse XDB-C18色谱柱;以水(A)-乙腈(B)作为流动相,梯度洗脱(0 ~8 min,45%B;8 ~12 min,45%~65%B;12 ~20 min,65%B;20 ~25 min,65%~45%B);流速0.6 mL·min-1;柱温30℃;紫外检测波长256 nm;进样量10 μL。
2.1.4 爵床活性部位化学成分的分离纯化 用Agilent Eclipse XDB-C18色谱柱进一步从 RPE 中制备单体化合物。乙腈溶解RPE 样品,流动相为50%乙腈,等度洗脱,柱温30℃,流速4 mL·min-1,紫外检测波长 256 nm。将5 个色谱峰的溶液对应收集后,浓缩并回收溶剂,干燥。
2.2 体外的爵床活性物质抗血小板聚集实验
2.2.1 爵床活性物质的细胞毒性实验 取新西兰兔耳缘静脉处血,收集到含3.8%枸橼酸钠的真空采血管中,得抗凝血液。将其在1800 g 下离心10 min 后取上清液,为富血小板血浆(PRP)。下层液体用1800 g 离心18 min 后取上清液制备贫血小板血浆(PPP),将PRP 调整为3.5×108个·mL-1,与空白溶剂、PRE 溶液(0.25 ~4.00 mg·mL-1)、爵床脂定B(JDB)溶液(0.05 ~0.80 mg·mL-1)、金不换甲醚(CME)溶液(0.06 ~0.96 mg·mL-1)分别在37℃下孵育10 min,然后500 g 离心10 min 后,取上清液,试剂盒检测各组LDH 含量。同时直接将PRP 离心,取上清液测血小板的总LDH 含 量。计算LDH 释放率,LDH 释放率(%)=待测样品LDH 含量/总LDH 含量×100%
2.2.2 血小板黏附实验 将圆形盖玻片清洗干净后放至24 孔板中,每孔加入200 μL 的COL(5 μg·mL-1)或1% BSA 溶液对照,4℃过夜后吸出包被液,加入200 μL 的1% BSA 溶液,封闭60 min 后弃去液体,用1×PBS 液清洗3 次,每孔加入200 μL“2.2.1”项下制备好的PRP,各浓度的药液以及空白溶剂同样分别加200 μL 复方丹参片(55.0 mg·mL-1)、ASP(2.0 mg·mL-1)、JDB(0.20 mg·mL-1)、CME(0.24 mg·mL-1)、RPE-L(低浓度,0.25 mg·mL-1)、RPE-M(中浓度,0.50 mg·mL-1)、RPE-H(高浓度,1.0 mg·mL-1)溶液,37℃孵育90 min,之后吸弃培养液并漂洗3 次,用4%的多聚甲醛溶液固定20 min,弃去液体并漂洗3 次,以罗丹明鬼笔环肽250 μL 避光染色30 min 后吸弃染色剂。用荧光显微镜在暗室观察,荧光染色百分比通过Image pro plus 6.0 软件计算。单体化合物JDB 和CME 的给药浓度计算由两者在RPE 中的含量换算而来。
2.2.3 体外抗血小板聚集率的测定 待血小板聚集仪测试孔中的温度达37℃,将PPP 和PRP置入测量杯中,以PPP 为对照,透光率调节为100%,然后取下PPP,将PRP 放入,向PRP 加入空白溶剂或各溶度的药物(浓度与“2.2.2”项下一致),反应5 min,透光率调节为0%,加入ADP、THR、COL 3 种不同的诱导剂使其与血小板结合,进而使血小板聚集,浊度下降,透光率上升,即可测得血小板聚集率。读取300 s 内的血小板最大聚集率。
2.3 体内的爵床活性物质抗血小板聚集实验
2.3.1 大鼠尾血栓模型实验 实验分为9 组,模型组和溶剂组灌胃0.5%的CMC-Na 溶液,ASP(2.0 mg·mL-1)、复方丹参片(570 mg·kg-1)、JDB(4.2 mg·kg-1)、CME(5.1 mg·kg-1)、RPE-L(低剂量,5.0 mg·kg-1)、RPE-M(中剂量,10.0 mg·kg-1)、RPE-H(高剂量,20.0 mg·kg-1)组以对应浓度药液灌胃,不间断灌胃7 d,每日一次,最后一次给药前12 h 停止喂食,自由饮水,并且于给药后1 h 造模。溶剂组腹腔注射等量的生理盐水,模型组和各浓度给药组每只以0.5 mL/100 g 的0.4%角叉菜胶溶液腹腔注射造模。造模12 h 后观察各组大鼠尾部的血栓情况,计算黑尾率;以7%水合氯醛将大鼠麻醉后,通过腹主动脉取血8 mL,取其中6 mL 与抗凝剂混匀后离心,剩余2 mL 不加抗凝剂,待凝固后离心,取上层液即为血清。并计算肝系数,肝系数(%)=大鼠肝质量/大鼠体质量×100%
2.3.2 体内给药抑制血小板聚集率实验 将“2.3.1”项下得到的抗凝血用“2.2.1”项下方法得到PRP 和PPP,按“2.2.3”项下方法检测血小板聚集率。
2.4 Western blot 实验
将PRP 低速离心,获得血小板沉淀物。总蛋白提取采用RIPA 裂解缓冲液。样品用SDSPAGE 电泳分离,转至NC 膜上,将NC 膜与一抗在4 ℃下孵育过夜,然后用TBST 洗膜3 次,每次10 min。洗涤后,用HRP 抗偶联二抗孵育1 h。以相同的方式清洗膜。用FluorChem FC3 系统进行显影。
2.5 统计学分析
用SPSS 19.0 软件分析,统计结果使用单因素方差分析,并以均值±标准差表示。P<0.05认为差异具有统计学意义。
3 结果
3.1 爵床活性部位筛选情况
如图1,溶剂组黑尾率为0,且小鼠尾部未形成血栓,模型组和给药组都有血栓形成。与模型组相比,给药各组黑尾率都显著下降(P<0.05),且C1组黑尾率最低,说明C1组的抗血小板聚集作用最强,因此将C1组作为活性部位(即RPE),进行后续研究。
3.2 活性部位成分分析结果
通过HPLC 检测,并与对照品色谱峰对比,最终确定RPE 中的5 个潜在活性成分分别为6'-羟基爵床脂定B(6'-OH-JDB,1,纯度:97.23%)、爵床脂定B(JDB,2,纯度:96.50%)、金不换甲醚(CME,3,纯度:98.18%)、新爵床脂定B(NJDB,4,纯度:96.08%)和新爵床脂定A(NJDA,5,纯度:95.45%)。图2为HPLC 色谱图,图3 为化合物对应的结构式。
3.3 爵床活性物质对细胞毒性研究
根据LDH 释放率可知,血小板经过不同浓度的PRE 处理后,各浓度PRE 的LDH 释放率与溶剂组相比无明显差异(P>0.05),不同浓度的JDB 组和CME 组与溶剂组相比无明显差异(P>0.05),证明RPE、JDB 和CME 对血小板几乎无毒性,其抗血小板活性可能不是由于对血小板的毒性引起的(见图4)。
3.4 爵床活性物质的抗血小板黏附作用
由图5 可知,溶剂组几乎无血小板黏附,而模型组有大量的血小板黏附;与模型组相比,给药组的血小板黏附量减少(P<0.05,P<0.01),且RPE 的高剂量组以及复方丹参组、ASP 组的血小板黏附量最少,抗黏附作用最强,而RPE 低、中剂量组,JDB 组及CME 组抗黏附作用较ASP组弱,RPE 低剂量组作用最弱。
3.5 爵床活性物质体外抗血小板聚集的作用
诱导剂为凝血酶的情况下,与溶剂组比较,各给药组血小板聚集率(除RPE 低剂量组和CME组)都有所下降(P<0.05,P<0.01),而RPE高剂量组和ASP 组的血小板聚集率最低,对血小板聚集的抑制作用最强;诱导剂为ADP 时,与溶剂组比较,各给药组均能显著降低血小板聚集率(P<0.05,P<0.01),且RPE 高剂量组对血小板聚集率降低效果最明显;诱导剂为COL 时,与溶剂组比较,各给药组(除RPE 低剂量组)血小板集率都有所下降(P<0.05,P<0.01),且RPE高剂量组与复方丹参组、ASP 组的血小板聚集率更低,而CME 抗血小板聚集的作用较弱(见图6)。
3.6 爵床活性物质对大鼠尾血栓模型的保护作用

图1 各组小鼠尾血栓(a)和黑尾率(b)比较Fig 1 Tail thrombus(a)and black tail rate(b)of mice in each group of mice

图2 RPE 的HPLC 色谱图Fig 2 HPLC chromatogram of RPE

图3 化合物1 ~5 的结构式Fig 3 Chemical structure for compound 1 ~5
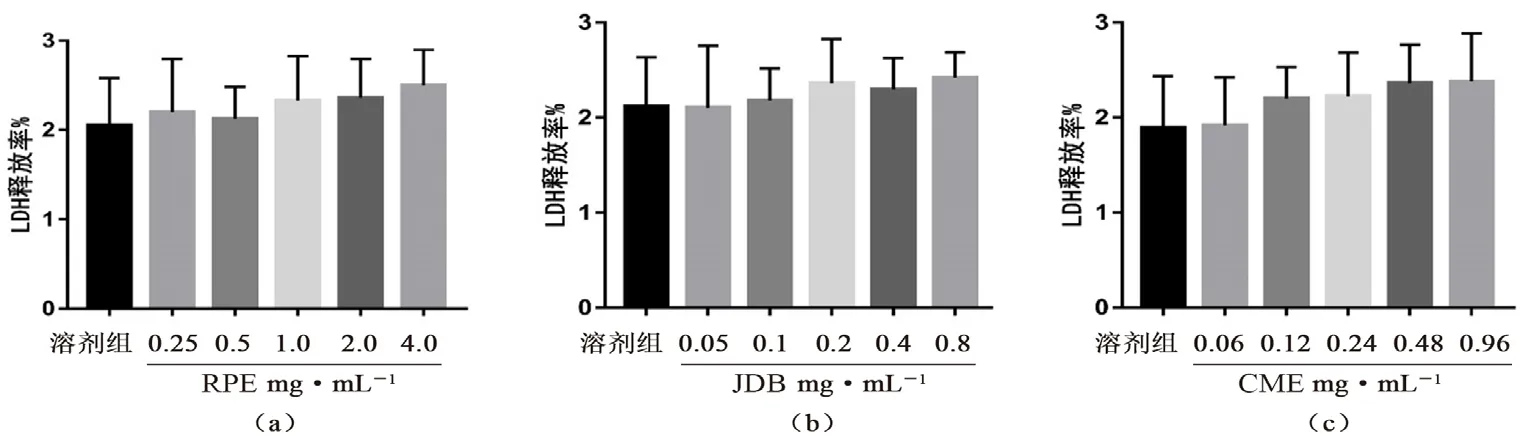
图4 不同浓度的RPE(a)、JDB(b)及CME(c)的LDH 释放率Fig 4 LDH release rate of RPE(a),JDB(b)and CME(c)at different concentrations
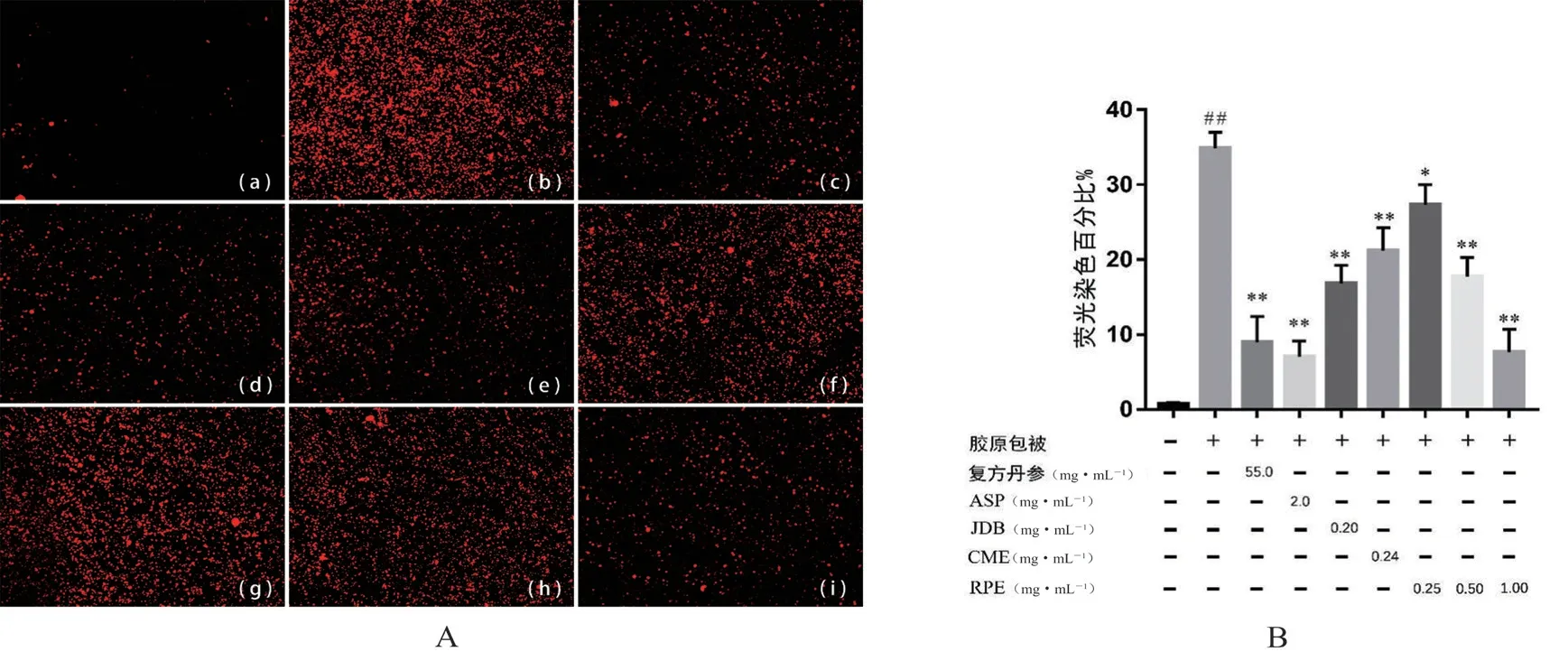
图5 各给药组对血小板黏附的作用(A)及荧光染色情况(B)Fig 5 Effect of each administration group on platelet adhesion(A)and fluorescence staining(B)
溶剂组大鼠在造模12 h 后尾部没有形成血栓,而模型组和给药组的大鼠尾部均有血栓形成。与模型组相比,给药组大鼠的黑尾率均有所下降(P<0.05,P<0.01)。同时发现模型组大鼠的肝脏肿胀、肝脏系数增高。而给药组的大鼠肝脏系数与模型组对比均显著降低(P<0.05),说明所给药物能够减轻肝脏肿胀,降低炎症反应,如图7所示。

图6 不同诱导剂对血小板聚集率的作用Fig 6 Effect of different inducer on platelet aggregation rate

图7 药物对大鼠黑尾率(a)和肝系数(b)的影响Fig 7 Effect of drug on rat black-tail rate(a)and liver coefficient(b)
3.7 爵床活性物质对ADP、COL、THR 诱导的体内血小板聚集的作用
与溶剂组相比,模型组的血小板聚集率显著提高(P<0.01);当诱导剂是THR 和COL时,与模型组对比,RPE 高剂量组、复方丹参组、ASP 组、JDB 组血小板聚集率显著降低(P<0.05),说高剂量 的RPE,以 及ASP 和JDB 具有抗凝血酶、抗胶原诱导的血小板聚集的作用;而诱导剂是ADP 时,RPE 低剂量组与模型组对比无显著性差异(P>0.05),其他各给药组对血小板聚集率均有降低作用(P<0.05),结果见图8。

图8 不同诱导剂对大鼠血小板聚集率的作用Fig 8 Effect of different inducer in each administration group on platelet aggregation rate in rats
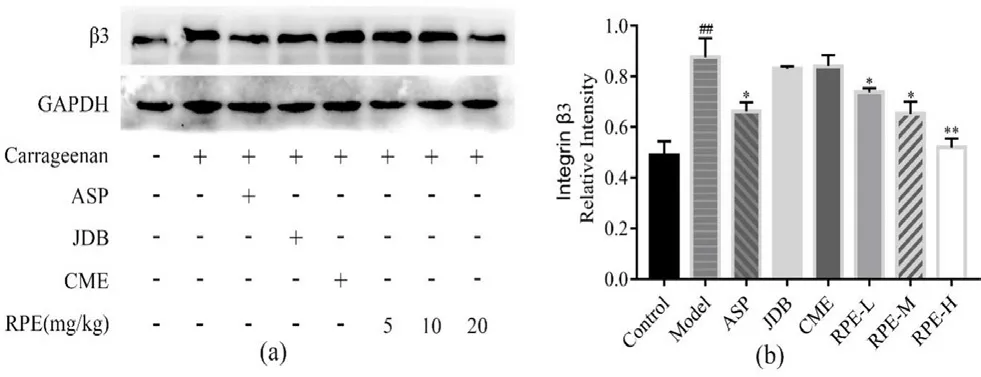
图9 大鼠血小板中β3 蛋白的表达情况Fig 9 Expression of beta 3 protein in rat platelets
3.8 爵床活性物质对角叉菜胶诱导的大鼠体内β3蛋白的影响
如图9 所示,与溶剂组比较,模型组尾血栓大鼠的血小板中β3蛋白表达量显著增高(P<0.01);与模型组对比;ASP 组,RPE 高、中、低剂量组均能显著下调β3蛋白的表达(P<0.05,P<0.01),而JDB 组 和CME 组 对β3蛋白的影响不明显。
4 讨论
在止血过程中血小板有很重要的作用,但血小板在异常时会形成血栓,进而诱发炎症以及动脉粥样硬化等病情[11-14]。相关研究认为针对血小板异常的靶向治疗有助于缓解血管疾病,但当前抗血小板药物对患者疗效有限,且具有一定毒副作用[15],例如长期使用阿司匹林会导致胃出血,因此有必要研究更加安全有效的抗血小板药物[16]。
小鼠尾血栓实验结果表明中C1组分(RPE)具有较好的抗尾血栓活性。通过HPLC 分析发现其由5 种木脂素类化合物组成,分别是CME、6'-OH-JDB、NJDB、JDB 和NJDA[17-19];通过制备液相色谱法,获得这5 种单体成分。JDB 和CME在活性部位中含量最高,是抗血小板聚集的主要活性物质,因此选择这两种化合物和RPE 进行后续研究[20-21]。
药物的毒性考察结果表明,LDH 释放率均在3%以下,表明爵床活性物质对血小板没有明显的细胞毒性。
体外实验中,采用比浊法研究了爵床活性物质对APP、THR 和COL 3 种诱导剂诱导的兔血小板聚集的抑制作用。发现爵床中的活性物质能有效抑制血小板聚集。体内实验中,采用角叉菜胶大鼠尾血栓模型,同样用上述3 种诱导剂诱导大鼠的血小板聚集,研究体内条件下药物对血小板聚集的影响。结果显示爵床活性物质表现出很好的体内抗血小板聚集作用。
诱导剂激活血小板后,会促使膜蛋白整合素αⅡbβ3活化,与纤维蛋白结合,形成血小板聚集。整合素αⅡbβ3由两个Ⅰ型跨膜糖蛋白αⅡb和β3通过二硫键连接而成。而血小板表面整合素β3作为主要受体影响血小板聚集并促进血栓形成[22]。实验结果证实了爵床活性物质可以下调尾血栓大鼠体内的β3蛋白的表达,表明其抗血小板聚集的作用机制与下调整合素β3有关。
综上所述,本实验首次在体内外两个层面阐释了爵床活性物质RPE、JDB、CME 的抗血小板药效,并初步研究了爵床抗血小板机制与降低整合素β3的表达有关,为进一步深入探讨爵床抗血小板聚集作用机制提供了理论支撑,为爵床资源的开发提供帮助。
