HAG联合地西他滨对骨髓增生异常综合征患者凋亡自噬相关基因表达的影响
2021-04-30刘艳芬刘欣訾建杰冯志刚闫慧韩宝艳张成侠
刘艳芬 刘欣 訾建杰 冯志刚 闫慧 韩宝艳 张成侠
骨髓增生异常综合征(MDS)是造血髓系干细胞、多能干细胞损伤引起的恶性血液病,以骨髓病态或无效造血、急性白血病转化风险高为特征[1,2]。MDS发病机制复杂,其中骨髓造血细胞增殖、凋亡自噬调控紊乱是MDS发生发展的重要病理机制[3,4]。我们前期研究发现,HAG(高三尖杉酯碱+阿糖胞苷+粒细胞集落刺激因子)联合地西他滨治疗MDS具有良好的治疗效果。本研究探讨了HAG联合地西他滨对MDS患者骨髓单个核细胞(BMMNC)凋亡自噬相关基因表达的影响,并以磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)通路为靶点探讨可能机制,以期为此类疾病的治疗提供理论依据。
1 资料与方法
1.1 一般资料 将2014年2月至2015年1月我院收治的MDS患者86例纳入研究范围,随机分为HAG组和联合组,每组43例。HAG组中,男24例,女19例;年龄26~71岁,平均(54.3±6.5)岁;分型:难治性贫血伴原始细胞增多-2 27例,难治性贫血伴原始细胞增多-1 11例,MDS转化急性髓系白血病4例,慢性-单核细胞白血病1例;IPSS分组:中危-1 15例,中危-2 22例,高危6例。联合组中,男25例,女18例;年龄25~72岁,平均(53.4±6.0)岁;分型:难治性贫血伴原始细胞增多-2 26例,难治性贫血伴原始细胞增多-1 12例,MDS转化急性髓系白血病3例,慢性-单核细胞白血病2例;IPSS分组:中危-1 13例,中危-2 25例,高危5例。2组性别比、年龄、分型、IPSS分级比较差异无统计学意义(P>0.05)。
1.2 纳入与排除标准
1.2.1 纳入标准:①符合MDS相关诊断标准[5];②所有患者有全血细胞减少、造血功能衰竭等典型表现;③患者及家属签署知情同意书。
1.2.2 排除标准:①合并其他恶性肿瘤者;②肝肾等重要脏器功能障碍者;③精神疾病患者;④入组前6个月服用过影响造血功能的药物者;⑤对治疗药物过敏者;⑥妊娠期或哺乳期女性患者。
1.3 治疗方法 2组均给予抗感染、营养支持治疗。HCG组给予高三尖杉酯碱(辰欣药业股份有限公司,1 ml∶1 mg,国药准字H20064996)+阿糖胞苷(海正辉瑞制药有限公司,国药准字H20054695)+粒细胞集落刺激因子(协和发酵麒麟株式会社,国药准字S200100631)治疗。高三尖杉酯碱,1 mg/d,1次/d,溶于250 ml 5%葡萄糖注射液中,静脉滴注;阿糖胞苷,2 mg/kg,1次/d,静脉滴注;粒细胞集落刺激因子,300 μg/d,1次/d,静脉滴注。连用14 d。联合组在HAG组治疗基础上加用地西他滨(正大天晴药业集团股份有限公司,国药准字H20143382),15 mg/m2,1次/8 h,静脉滴注。连用3 d。
1.4 实验方法
1.4.1 分离BMMNC:采集骨髓液5 ml,置于肝素抗凝管中,等量PBS稀释后加入淋巴细胞分离液,密度梯度离心法分离BMMNC。
1.4.2 Western blot:提取BMMNC总蛋白,经SDS-PAGE电泳后转移至PVDF膜,室温下10%脱脂奶粉封闭2 h。依次加入特异性一抗和辣根过氧化物酶标记的羊抗鼠IgG,TBST洗膜3次。ECL化学发光法显色、定影。
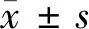
2 结果
2.1 2组增殖相关基因表达比较 2组治疗前Ki67、PCNA、CDK2蛋白表达比较差异无统计学意义(P>0.05);2组治疗后Ki67、PCNA、CDK2蛋白表达均较治疗前显著降低(P<0.05),且联合组Ki67、PCNA、CDK2蛋白表达低于HAG组(P<0.05)。见表1。
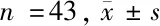
表1 2组增殖相关基因表达比较
2.2 2组凋亡相关基因表达比较 2组治疗前Bcl-2、Bax、Caspase-3蛋白表达比较差异无统计学意义(P>0.05);2组治疗后Bcl-2蛋白表达均较治疗前显著降低,Bax、Caspase-3蛋白表达均较治疗前显著升高(P<0.05),且联合组Bcl-2蛋白表达低于HAG组,Bax、Caspase-3蛋白表达高于HAG组(P<0.05)。见表2。
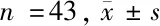
表2 2组凋亡相关基因表达比较
2.3 2组自噬相关基因表达比较 2组治疗前LC3、Beclin1蛋白表达比较差异无统计学意义(P>0.05);2组治疗后LC3、Beclin1蛋白表达均较治疗前显著升高(P<0.05),且联合组LC3、Beclin1蛋白表达高于HAG组(P<0.05)。见表3。
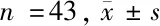
表3 2组自噬相关基因表达比较
2.4 2组PI3K/AKT/mTOR通路关键蛋白表达比较 2组治疗前p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR比较差异无统计学意义(P>0.05);2组治疗后p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR均较治疗前显著降低(P<0.05),且联合组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR低于HAG组(P<0.05)。见表4。
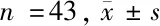
表4 2组PI3K/AKT/mTOR通路关键蛋白表达比较
3 讨论
研究表明,高危组MDS患者转白率达40%~60%,病死率高[6,7]。HAG方案治疗MDS具有较高的临床缓解率,但治疗相关毒副作用较重[8]。地西他滨是一种去甲基化治疗药物,通过抑制DNA甲基化转移酶激活抑癌基因,从而发挥抑制肿瘤增殖并诱导其分化、凋亡的作用[9]。我们前期研究证实,HAG联合地西他滨治疗MDS能够显著降低骨髓原始细胞比例,改善患者骨髓造血功能和生活质量[10]。但联合用药治疗MDS的可能机制仍待进一步探索。
Ki67是一种存在于增殖细胞核中的碱性蛋白质,可作为反映肿瘤细胞增殖特性、恶性程度及预后的敏感指标[11]。PCNA是一种细胞周期相关蛋白,直接参与调控细胞增殖[12]。CDK2是CDKs家族的重要成员,其激活后通过上调细胞周期相关基因的转录和表达,在细胞从G1期进入S期中发挥重要调控作用,从而促进细胞增殖[13]。本研究中我们采用Western blot检测BMMNC中Ki67、PCNA、CDK2的表达,结果显示,2组治疗前Ki67、PCNA、CDK2蛋白表达比较差异无统计学意义(P>0.05);2组治疗后Ki67、PCNA、CDK2蛋白表达均较治疗前显著降低(P<0.05),且联合组Ki67、PCNA、CDK2蛋白表达低于HAG组(P<0.05),提示联合组能够将细胞周期阻滞于G0/G1,从而抑制MDS细胞增殖能力及改善骨髓造血功能。
凋亡是由凋亡促进基因和凋亡抑制基因共同参与调控的细胞程序性死亡方式,凋亡过程紊乱是MDS的重要病理机制。其中低危MDS表现为骨髓细胞凋亡增加,随着疾病进展,异常增殖的骨髓细胞逃避凋亡信号的能力增强,导致凋亡细胞减少。Bcl-2、Bax是Bcl-2家族中发挥抗凋亡和促凋亡作用的主要分子,Bax/Bcl-2是反映凋亡效应的重要指标。Caspase-3是Caspase蛋白家族的主要成员,在Caspase依赖性细胞凋亡过程中发挥核心作用[14]。本研究结果显示,2组治疗前Bcl-2、Bax、Caspase-3蛋白表达比较差异无统计学意义(P>0.05);2组治疗后Bcl-2蛋白表达均较治疗前显著降低,Bax、Caspase-3蛋白表达均较治疗前显著升高(P<0.05),且联合组Bcl-2蛋白表达低于HAG组,Bax、Caspase-3蛋白表达高于HAG组(P<0.05),说明联合组通过上调促凋亡基因Bax、Caspase-3蛋白表达,下调抗凋亡基因Bax蛋白表达发挥促凋亡作用。
自噬是细胞内衰老、受损的细胞器和蛋白质在溶酶体内消化溶解的生物学过程,在细胞增殖、分化、组织重塑中发挥重要调控作用。近年来研究发现,自噬通过影响造血干细胞的增殖分化和骨髓造血微环境参与MDS发生发展,自噬缺陷导致MDS转化为急性白血病风险增加,而诱导细胞自噬能够发挥抗肿瘤作用[15,16]。LC3是常用于检测自噬体数量和自噬强度的标志性分子。Beclin-1是自噬的直接执行者,通过与Bcl-2家族成员结合促进自噬发生[17,18]。本研究结果表明,2组治疗前LC3、Beclin1蛋白表达比较差异无统计学意义(P>0.05);2组治疗后LC3、Beclin1蛋白表达均较治疗前显著升高(P<0.05),且联合组LC3、Beclin1蛋白表达高于HAG组(P<0.05),说明联合组通过诱导细胞自噬发挥抑制MDS增殖并促进其凋亡的作用。
既往研究表明,PI3K/AKT/mTOR通路的异常活化与肿瘤发生发展密切相关[19,20]。PI3K激活AKT后能够通过一系列信号级联反应导致mTOR磷酸化,继而经ULK1、4E-BF1等途径抑制细胞自噬,相反,靶向PI3K/AKT/mTOR通路的抑制性药物能够上调自噬标志性分子表达,从而发挥抗肿瘤作用。本研究结果表明,2组治疗前p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR比较差异无统计学意义(P>0.05);2组治疗后p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR均较治疗前显著降低(P<0.05),且联合组p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR低于HAG组(P<0.05),说明联合组通过抑制PI3K/AKT/mTOR通路诱导MDS细胞自噬,从而发挥促凋亡作用。
综上所述,HAG联合地西他滨可能通过调控相关基因表达抑制MDS细胞增殖,并诱导其凋亡自噬,机制可能与下调PI3K/AKT/mTOR活性有关。然而,HAG联合地西他滨是否存在其他抗肿瘤机制尚待进一步研究。
