TGF-β1对SKOV-3细胞EMT的影响及相关分子机制研究
2021-04-30闫晓楠杜辉左宏玲张娜王惠兰徐春琳
闫晓楠 杜辉 左宏玲 张娜 王惠兰 徐春琳
卵巢癌为女性生殖器官三大恶性肿瘤之一,严重威胁全球女性的生命健康。其发病隐匿,早期阶段无特异症状,确诊时通常已是Ⅲ~Ⅳ期,该疾病全球范围内的5年生存率低于30%[1]。影响患者生存率的主要因素包括肿瘤对周围组织的浸润以及远处器官的转移。因而,卵巢癌的侵袭转移机制仍为当今研究热点。已有研究表明,恶性肿瘤发生转移的时,上皮细胞间质转化(EMT)发挥了关键性的作用[2,3]。EMT变化主要为E钙粘蛋白(即E-cadherin)表达下调,而N钙粘蛋白(即N-cadherin)表达上调[4,5]。碱性螺旋-环-螺旋转录因子(Twist)蛋白是一种高度保守的转录因子,活化后的Twist可上调N-cadherin蛋白并下调E-cadherin蛋白的表达,促进EMT的发生发展[5]。多种因子在肿瘤微环境中可促进EMT的发生,其中一个关键的诱导因子为转化生长因子-β1(TGF-β1)[6],可显著地影响女性卵巢疾病的发展过程,值得高度关注[7]。当TGF-β1诱导肿瘤细胞发生EMT时,涉及多种信号传导通路,位于下游的PI3K/Akt信号通路(非Smad依赖性的)表现突出[8]。因而,本研究以EMT为切入点,探讨SKOV-3细胞EMT发生时受TGF-β1影响的相关规律,进而对PI3K/Akt信号通路的作用进行分析,以期为临床提供理论依据。
1 材料与方法
1.1 实验材料 采用北大人民医院提供的SKOV-3细胞(人卵巢浆液性囊腺癌细胞),通过含胎牛血清(10%)的RPMI-1640培养基进行培养。其他试剂包括Sigma生产的MTT,Cambridge公司生产的Transwell小室,以及贝博公司生产的蛋白裂解液,Peprotech生产的TGF-β1,SantaCruz生物技术公司所生产的Twist、N-cadherin和E-cadherin等三类单克隆抗体,p-Akt(Thr308)多克隆抗体等。
1.2 实验方法
1.2.1 细胞培养及分组在无酚红RPMI1640培养基中接种SKOV-3细胞(链霉素100 U/ml、青霉素100 U/ml、胎牛血清10%),在温度为37℃且含有5%浓度CO2的培养箱中进行培养。实验细胞状态良好,处于对数生长阶段。MTT法检测各种TGF-β1浓度条件下(1、2、5、10 ng/ml)分别作用24、48 h后SKOV-3细胞的增殖情况,对照组为TGF-β1(0 ng/ml);Transwell检测各组连续培养48 h后SKOV-3细胞的侵袭能力,实验分组:①TGF-β1组(浓度1、2、5、10 ng/ml)、②LY294002组(PI3K抑制剂,浓度10 μmol/ml)、③LY294002+TGF-β1组(10 μmol/ml LY204002干预30 min后加入10 ng/ml TGF-β1),④对照组(PBS);采用Western blot法对各组中N-cadherin、E-cadherin、Twist以及p-Akt的蛋白表达情况进行检测(药物作用48 h后进行细胞蛋白提取)。分组如下:①TGF-β1组(10 ng/ml),②LY294002组(10 μmol/ml),③LY294002+TGF-β1组(10 μmol/ml LY294002干预30 min后加入10 ng/ml TGF-β1),④对照组(RPMI-1640)。
1.2.2 MTT法检测各种浓度TGF-β1干预后SKOV-3细胞的增殖活性:在96孔板(3×104个/ml的浓度,而且每个孔均为200 μl)中接种细胞,在含有5% CO2、温度为37℃的培养箱中放置,待细胞出现贴壁现象后根据分组的情况换液,此时标记为0 h。各组均设置复孔5个。24、48 h后,培养终止前将MTT(10 μl)添加到所有的孔中,进行4 h的孵育。进行吸光度(OD值)的实验测定。各实验重复3次。
1.2.3 Transwell实验检测各组SKOV-3细胞的侵袭能力:1∶3进行Matrigel基质胶的稀释,在Transwell小室中的聚碳酸酯膜之上将其铺展开,进行细胞外基质的实验模拟。将共计200 μl的细胞悬液(每个孔为3×104个)添加到上室,完全培养基添加到下室,各组中平行小室数量均为3个。等体积PBS作为趋化剂作用于SKOV-3细胞为对照组。置于培养箱中孵育48 h 后,PBS洗膜,棉拭子擦净上室内细胞及Matrigel基质胶,多聚甲醇固定10 min,苏木素染色后自来水冲洗,显微镜下计数穿透Matrigel基质胶细胞数目。各实验重复3次。
1.2.4 Western blot 法检测各组细胞中p-Akt、Twist、N-cadherin、E-cadherin蛋白的表达情况:不同干预方式作用48 h后提取各组细胞蛋白,Nanodrop进行蛋白定量。通过SDS-PAGE凝胶对蛋白进行电泳分离,4℃转膜1.5 h,室温下脱脂奶粉(5%)封闭1 h,再添加一抗(按0.1/cm2膜的比例)。4℃过夜,采用Tris-HCI缓冲盐溶液进行共计3次洗膜操作,时长均为10 min,然后将山羊抗兔IgG(1∶2 000)二抗和山羊抗鼠IgG(1∶2 000)加入(均已通过辣根过氧化物酶来进行相应的标记),室温孵育2 h,洗膜3次,具体操作流程同前,再通过ECL法进行显影。ImageJ分析蛋白灰度值,获得各实验组中4种蛋白表达水平。各实验重复3次以获得可靠数据。
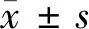
2 结果
2.1 不同浓度TGF-β1作用不同时间后SKOV-3细胞的增殖活性比较 MTT结果显示:不同浓度TGF-β1(0、1、2、5、10 ng/ml)刺激SKOV-3细胞24、48 h后,随着TGF-β1浓度的增加及作用时间延长OD值有所增加,但差异无统计学意义(P>0.05),即TGF-β1对SKOV-3细胞生长促进作用不明显。见表1。
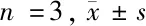
表1 各浓度TGF-β1作用不同时间后SKOV-3细胞OD值结果
2.2 T组细胞的侵袭能力比较 根据Transwell相关结果可知:进行各浓度TGF-β1干预后,穿过小室的SKOV-3细胞数目均多于对照组,并且随着TGF-β1的浓度增高,穿过小室细胞数目逐渐增多(P<0.05);单独应用LY294002及联合TGF-β1处理后,穿过小室细胞SKOV-3数目明显减少(P<0.05)。见表2。
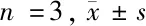
表2 Transwell小室检测不同处理后SKOV-3穿膜细胞数
2.3 各组SKOV-3细胞p-Akt、Twist、N-cadherin、E-cadherin蛋白的表达情况 与对照组比较,SKOV-3细胞经TGF-β1作用后:p-Akt、 Twist和N-cadherin蛋白表达显著增加(P<0.05);LY294002单独作用或与TGF-β1联合处理后p-Akt、Twist和N-cadherin蛋白表达水平显著降低;E-cadherin蛋白的表达与此相反(P<0.05)。见图1,表3。
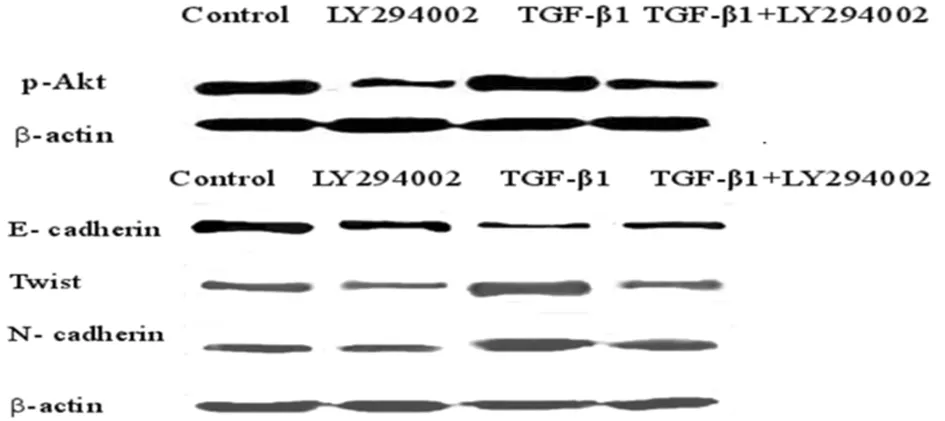
图1 不同干预方式作用48h后SKOV-3细胞中p-Akt、Twist和N-cadherin、E-cadherin蛋白表达情况
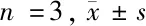
表3 SKOV-3细胞中各蛋白表达的相对光密度值
3 讨论
研究表明,对于不同类型的上皮来源恶性肿瘤而言,在其侵袭以及转移等的相关过程中,EMT具有十分关键的影响,被认为是恶性肿瘤转移的先决条件之一[9]。肿瘤上皮细胞发生EMT后,获得运动迁移能力,脱离原发病灶,浸润周围组织并进入血液循环转移、种植到较远部位。而对于上皮间叶而言,EMT的重要条件之一就是TGF-β1的诱导[10],此过程涉及多个信号传导通路,尤其值得注意的就是PI3K/Akt信号通路(它是非Smad依赖性的)。因此,本研究观察TGF-β1对人上皮性卵巢癌SKOV-3细胞株EMT发生的影响,并探讨PI3K/Akt信号通路在其中的作用,以期为临床提供潜在的治疗靶点。
3.1 TGF-β1对SKOV-3细胞EMT的影响 TGF-β1具有较强的生物学活性,可促进肿瘤的增殖、分化、促进肿瘤血管生成,与多种肿瘤的发生发展、浸润及转移密切相关[11]。国内外关于TGF-β1在卵巢癌的研究多在血清学或蛋白水平,结果显示TGF-β1在卵巢癌患者中表达水平增加;也有学者认为TGF-β1在卵巢癌中主要在基因水平发挥调控作用[12,13]。然而,人卵巢癌上皮细胞出现EMT的过程和侵袭转移等是否受到TGF-β1的诱导及其机制尚未明确。
Vergara等[14]研究发现,MTT法结果显示,TGF-β1对卵巢癌上皮细胞增殖作用无明显影响。本研究中,MTT法检测不同浓度TGF-β1分别作用于SKOV-3细胞24、48 h,结果显示:TGF-β1对SKOV-3细胞生长促进作用不明显。为进一步观察TGF-β1对SKOV-3细胞侵袭能力的影响,本研究采用不同浓度TGF-β1持续刺激SKOV-3细胞48 h,进行Transwell实验,结果显示:TGF-β1处理后SKOV-3细胞穿过小室数目多于对照组,且随浓度的增加而增加(P<0.05),即TGF-β1可促使SKOV-3细胞运动侵袭能力增强。据MTT和Transwell结果推测,TGF-β1刺激SKOV-3细胞后侵袭能力增强,可能是由于形态学上的变化引起,而非细胞增殖数目增多所致。
EMT是上皮细胞原有极性的丧失及间质特性的获得,主要表现为E-cadherin出现了一定程度的表达下调;而N-cadherin则出现了表达上调的趋势,上述过程可由Twist等进行相应的调控[4,5]。Wu等[15]体外细胞研究证实,人子宫内膜癌细胞ECC-1中Twist、N-cadherin高表达,E-cadherin低表达,三者共同作用在子宫内膜癌细胞EMT的发生中起重要作用;Twist/N-cadherin siRNA的应用可降低其表达水平从而使子宫内膜癌细胞的迁移和侵袭能力减弱。上述结果提示,Twist/N-cadherin信号通路促进子宫内膜癌细胞的迁移和侵袭。
本研究采用TGF-β1(10 ng/ml)刺激SKOV-3细胞48 h后提取蛋白,Western blot结果显示:经TGF-β1处理后转录因子Twist蛋白表达上调,N-cadherin蛋白的表达水平较对照组显著升高,E-cadherin蛋白的表达水平显著降低(P<0.05)。上述结果显示TGF-β1作用于SKOV-3细胞后抑制其E-cadherin蛋白的表达,促进N-cadherin蛋白的表达,与文献报道一致[4,5,15],即TGF-β1可诱导SKOV-3细胞发生EMT,获得间质特性,为肿瘤细胞通过基底膜发生浸润和远处转移提供机会。TGF-β1诱导SKOV-3细胞EMT的发生,可能是通过刺激Twist的表达上调来实现的。
3.2 TGF-β1诱导SKOV-3细胞发生EMT的信号转导机制 磷脂酰肌醇3激酶(phosphaatidylinositlo 3kinase,PI3K)是生物体重要的胞内激酶,具有磷脂酰肌醇激酶及丝氨酸/苏氨酸激酶活性。当PI3K/Akt信号通路被激活后,可提高细胞存活能力,凋亡过程受到抑制,对肿瘤的EMT起促进作用[16,17]。因此,探索EMT靶点相关抑制剂有着重要的临床应用前景。Chen等[18]的结果表明,骨形态蛋白2(bone morphogenetic proteins,BMP-2)可上调人胰腺癌Panc-1细胞中的p-Akt蛋白的表达,从而有利于EMT的发生;采用PI3K/Akt信号通路抑制剂LY294002预处理后,发现对SKOV-3细胞EMT过程起到显著抑制作用,侵袭转移能力减弱。上述结果表明,BMP-2可能是通过PI3K/Akt通路来诱导Panc-1细胞EMT的发生。另外的研究显示,在胃癌和结肠癌的研究中发现了同样的现象,即PI3K/Akt信号通路可介导上皮性肿瘤细胞发生EMT,并且此作用可被PI3K/Akt信号通路抑制剂所逆转[19-22]。
本研究第一部分已证实TGF-β1可诱导SKOV-3细胞发生EMT,但是否经PI3K/Akt信号通路实现,目前尚不十分清楚。本实验对此做了进一步研究,Transwell侵袭实验结果显示:无论单独应用LY294002还是先用LY294002预处理30 min后再给予TGF-β1刺激,SKOV-3细胞的侵袭能力均显著降低(P<0.05),结果与文献报道[14-16]相似。本研究中Westernblot分析结果显示:与对照组相比较,SKOV-3细胞受TGF-β1刺激后,除了E-cadherin表达水平降低,无论是N-cadherin、转录因子Twist还是p-Akt等蛋白均出现了表达增加的现象。PI3K/Akt通路抑制剂LY294002作用于SKOV-3细胞后上述各指标蛋白表达水平出现相反趋势 (P<0.05),与文献报道相似[18-20,23]。上述结果提示:TGF-β1作用于SKOV-3细胞后,PI3K/Akt通路被激活,p-Akt表达水平上调,接着上调Twist表达水平,进而N-cadherin表达水平的上调,E-cadherin表达水平的下调,从而使SKOV-3受到诱导,EMT发生,最终SKOV-3细胞侵袭以及转移能力增加。应用LY294002后,有效地抑制了SKOV3-细胞p-Akt自身的活性,下调了Twist的表达水平,对EMT发生起到逆转作用,最终使肿瘤细胞具有的侵袭转移能力被显著降低。
综上所述,TGF-β1/PI3K/Akt信号通路在卵巢癌的发生发展中起重要作用,应用相应抑制剂可降低此通路中多个下游分子的表达,从而达到抑制肿瘤生长的目的[24-27]。分子靶向治疗技术是未来卵巢癌研究领域的重点,特别是在持续地探讨TGF-β1/PI3K/Akt的相关信号通路相关科学问题之后,有望发现新型治疗靶点,从而促进卵巢癌基础医学及临床医学研究的发展。
