超声引导下Ⅱ型胸神经阻滞对全麻下行乳腺癌手术患者免疫功能的影响
2021-04-30崔秀玲刘萍赵晓琛于丽丽赵浩晨缴宝杰
崔秀玲 刘萍 赵晓琛 于丽丽 赵浩晨 缴宝杰
乳腺癌是全世界范围内的一种常见癌症,是女性发病率最高的一种恶性肿瘤[1]。尽管手术旨在消除大多数肿瘤组织,但癌细胞仍可能扩散至血液和淋巴循环系统[2],这可能导致癌症复发,尤其是在手术和麻醉剂诱导的免疫抑制下[3]。因此,术后免疫力的提高对患者的生存至关重要。胸神经阻滞通过在手术过程中阻断胸神经和肋间神经而表现出相对较少的并发症[4,5]。与Ⅰ型胸神经阻滞相比,Ⅱ型胸神经阻滞增加了肋间神经外侧支的二次注射[6]。先前研究报道,胸神经阻滞可以达到更好的镇痛效果[7],减少手术期间阿片类药物如瑞芬太尼和芬太尼的使用,并通过阻断周围神经以减少术后的慢性疼痛[8]。手术和麻醉都会对免疫产生不利影响[9,10]。既往研究表明,手术应激与血管生成和转移以及先天免疫和细胞免疫受到抑制相关[3]。NK细胞是天然免疫的重要组成部分,有助于保护机体免受肿瘤细胞的扩散[11,12]。因此,NK细胞的丢失可能潜在地提高了肿瘤转移的风险[13]。胰腺小鼠模型的证据表明,NK细胞的丢失促进了肿瘤的进展[14]。曲妥珠单抗(trastuzumab)是一种常用的乳腺癌药物,是一种单克隆抗体,可选择性靶向作用于Her2。Her2阳性乳腺癌细胞的裂解能力主要取决于NK细胞介导的抗体依赖性细胞毒性(ADCC),因此NK细胞在这一过程中起着关键作用。关于Ⅱ型胸神经阻滞,我们旨在研究其是否能够改善乳腺癌术后NK细胞的增殖和杀伤活性。除NK细胞外,也评估并比较了患者的其他免疫细胞,包括自然杀伤T(NKT)细胞、辅助T细胞和细胞毒性T细胞及相关细胞因子。
1 资料与方法
1.1 一般资料 本研究经沧州市中心医院伦理委员会批准。所有患者均签署知情同意书。本研究共纳入232位被诊断为乳腺癌且经美国麻醉医师协会(ASA)身体状况评分为Ⅰ和Ⅱ级的患者。所有登记的参与者都准备接受保乳手术/改良根治术。排除标准:(1) 18岁以下;(2)既往手术史和肿瘤史;(3)其他类型肿瘤;(4)心脏病、呼吸系统疾病、神经系统疾病或其他疾病史;(5)凝血障碍或对手术药物过敏;(6)最近接受放疗或化疗(<8周);(7)最近使用类固醇或阿片类药物,酒精或其他非法药物。根据标准排除后,纳入196例患者。根据计算机生成的一组随机数字将这些患者分为2组:单纯全身麻醉组(G组)和全身麻醉下的Ⅱ型胸神经阻滞组(PG组)。住院期间,所有参与者都接受了合适的麻醉和手术。手术组和护理组对分组情况不知情,且所有患者均由同一名麻醉师麻醉。
1.2 麻醉方法 患者均接受利多卡因(河北天成药业股份有限公司,1 mg/kg),异丙酚(四川国瑞药业)和瑞芬太尼(江苏恩华药业股份有限公司)的麻醉诱导和维持。调整瑞芬太尼剂量以使BIS值保持在40~60。采用靶控输注(TCI)泵(Orchestra;Fresenius-Kabi,德国),分别使用Schnider等[15,16]的药代动力学模型来计算丙泊酚和瑞芬太尼的用量。PG组在全麻诱导后根据已发表的方法进行超声引导下Ⅱ型胸神经阻滞[17]。首先,在锁骨外侧三分之一处放置超声探头,以确定腋窝静脉和动脉。然后将探头移至胸大肌和小肌之间的位置。之后,在超声引导下,在胸大肌和胸小肌之间斜置一根超声针。然后,注射罗哌卡因(齐鲁制药有限公司,0.5%,10 ml)。然后将探针从第一根肋骨移到第三根肋骨,到达前锯肌。推进针直到其尖端到达Pmm和SAM之间的潜在空间,将罗哌卡因(0.5%,20 ml)注入该区域。术中监测心电图、无创血压、脉搏血氧饱和度、体温、双谱指数(40~60,BIS vista monitor revision 3.0;Aspect Medical Systems,USA)。当双谱指数>60时,给予异丙酚0.5 μg/kg(间隔为1 min或更长时间)静脉注射。当心率降至<50次/min时,静脉注射阿托品0.5 mg。手术后,将确认自发呼吸和意识恢复的患者移至术后重症监护室,进行接下来的24 h监测。
1.3 血样采集 手术24 h后,将患者的血液样本收集在肝素管中以进行外周血单核细胞(PBMC)分离,并用乙二胺四乙酸管进行细胞因子评估。采用Ficoll-Paque(GE Healthcare,瑞典)密度梯度离心法分离PBMC[18],并冷冻于含10%二甲基亚砜(Sigma-Aldrich,美国)的热灭活人AB血清(Sigma-Aldrich,美国)中。
1.3.1 NK细胞分离:根据制造商提供的流式细胞术方案,从抗CD56结合微球(英国MiltenyiBiotec)选择的PBMC免疫中分离CD56+NK细胞。
1.3.2 细胞培养与凋亡检测:为了在存在或不存在患者血清或NK细胞的情况下进行凋亡检测,我们使用了人类原发性乳腺癌细胞HCC,该细胞系在含有10%胎牛血清(FCS,Sigma)的ATCC配制的RPMI-1640培养基中培养。在指定的实验中,使用样品血清代替FCS。将NK和HCC细胞以1∶10的比例在含有指定血清的细胞培养基中共培养24 h。使用FITC-Annexin和碘化丙啶(Annexin V-FITC细胞凋亡检测试剂盒,Biofriend,CN)进行双重染色,评估HCC细胞的凋亡率,并通过流式细胞仪进行分类。
1.3.3 NK细胞毒性:用K562靶向红白血病细胞(美国模式培养集,美国)培养,检测NK细胞的细胞毒性。细胞用羧基荧光素琥珀酰亚胺酯(Sigma Aldrich)染色,温育4 h后收集。加入碘化丙锭(Becton Dickinson,美国)以确定死靶细胞。
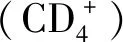
2 结果
2.1 患者人口学资料与围手术期临床特点 共有232名患者参加了这项研究。在排除几种情况后,纳入196例患者。将患者随机分为单纯全麻组(G组,n=98)和全麻下Ⅱ型胸神经阻滞组(PG组,n=98)。它们的特性如表1所示。2组患者在年龄、身高、体重、肿瘤分期、手术方式、ASA状态等方面无明显差异。但是,在手术过程中,PG组瑞芬太尼用量明显低于G组(P=0.001)。G组与PG组其他生命体征(包括动脉压、心率)无明显差异。见表1~3。
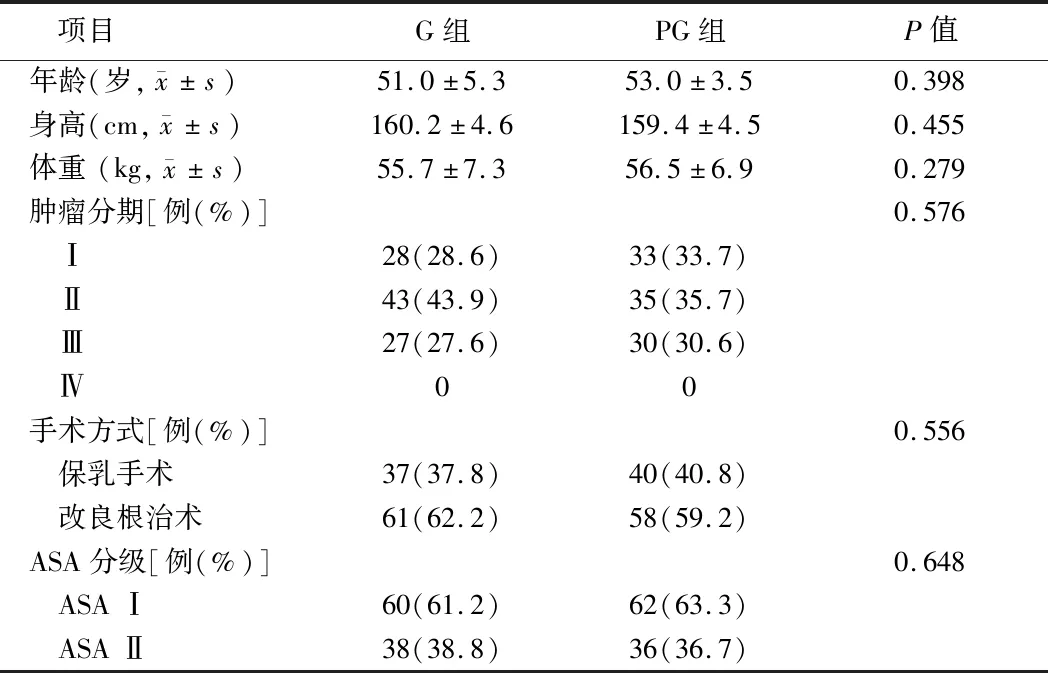
表1 患者一般资料 n=98
2.2 全身麻醉下Ⅱ型胸神经阻滞对NK细胞数量和功能的影响 为了探究2组的不同免疫应答,我们首先检测了NK细胞的数量。G组术前NK细胞约占PBMC的(17.2±3.53)%,全麻后降至(13.36±3.07)%(P=0.023)。PG组NK细胞数无显著性差异。比较2组术后NK细胞数量时,PG组显示PBMC中NK细胞的占有率明显高于G组(P=0.036)。对于G组和PG组,NK细胞的凋亡率在手术前后均未受到影响。PG组和G组NK细胞凋亡率也相近。术后2组NK细胞的杀伤活性均显著降低(P<0.001)。

表2 患者麻醉、手术时间及术中药物使用情况

表3 患者术中生命体征
然而,术后PG组比G组具有更多的功能性NK细胞(P=0.007)。见表4。
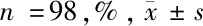
表4 手术期间使用Ⅱ型胸神经阻滞对NK细胞的影响
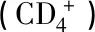
表5 2组患者NKT、T辅助1细胞和细胞毒性T淋巴细胞的PBMC百分比
2.4 HCC细胞的凋亡率 我们研究了受试者的血清是否会影响HCC细胞的凋亡率。我们用正常患者、G组和PG组患者的血清处理HCC细胞。在没有NK细胞的情况下,3种处理之间没有观察到HCC凋亡率的差异。在存在NK细胞的情况下,G组患者(n=20)的血清与正常血清相比,显著促进乳腺癌细胞凋亡。G组和PG组术后血清培养的乳腺癌细胞凋亡率明显低于术前(G组,P<0.001;PG组,P=0.017)。但与PG组术后血清相比,G组术后血清明显抑制乳腺癌细胞凋亡率(P=0.031),说明G组术后血清对NK细胞功能的抑制作用可能强于PG组术后血清。在受试者血清补充培养基中与NK细胞共培养后HCC细胞的凋亡率。乳腺癌细胞在补充血清的培养基中单独培养或与NK细胞一起培养。通过用FITC-Annexin V和碘化丙啶进行双重染色来确定凋亡,并通过流式细胞术进行检测。每个实验重复3次(P<0.05)。见表6,图1。
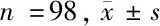
表6 2组患者HCC细胞的凋亡率
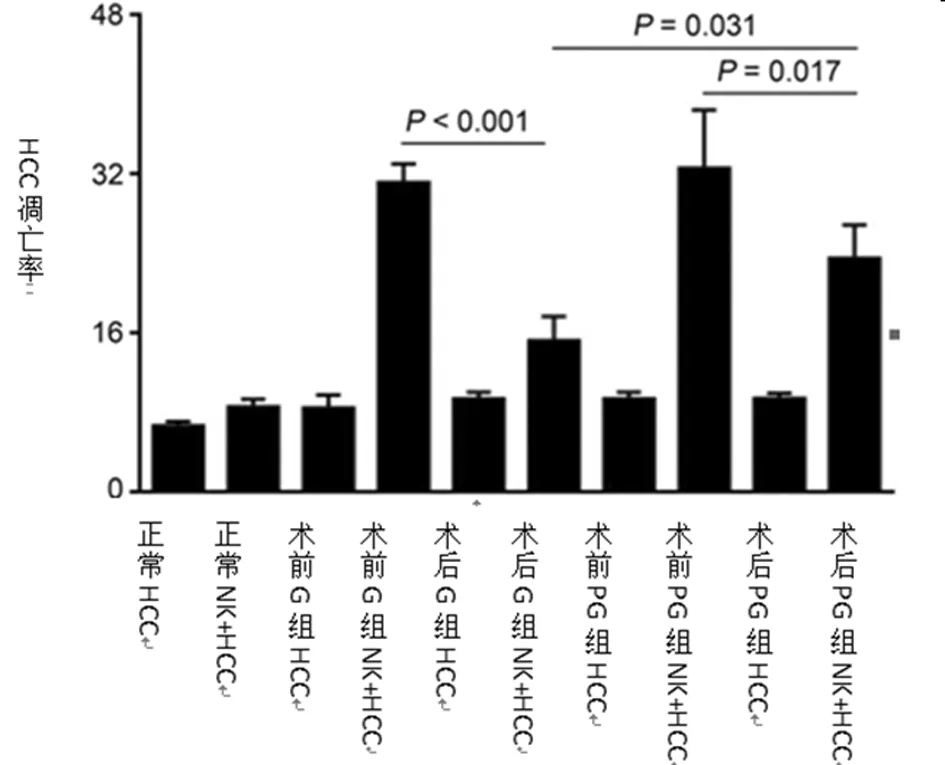
图1 2组HCC细胞凋亡率比较
3 讨论
我们的研究发现,与全身麻醉方法相比,Ⅱ型胸神经阻滞在术中瑞芬太尼消耗量更少。PecsⅡ主要通过改变乳腺癌手术患者血液中细胞比例来影响免疫系统。此外,PecsⅡ还增强了NK细胞的杀伤活性,表明PecsⅡ也对免疫细胞功能有影响。在最近的一项研究中也发现了类似的观察结果[19],与对照组相比,术前使用罗哌卡因进行Ⅱ型胸神经阻滞,手术期间瑞芬太尼的用量显著减少。
众所周知,麻醉的选择至关重要,因为它可能与癌症的复发有关[3]。尽管手术切除可以去除大部分癌症组织,但仍有少量癌细胞保留在体内[20]。在这方面,麻醉诱导的免疫抑制和手术引起的应激可以帮助这些癌细胞的扩散和存活。除了对免疫系统的抑制作用外,在实验和临床上还发现手术与血管生成增加和促进转移有关[3]。还发现阿片类麻醉药物抑制细胞介导的免疫[21],并促进肿瘤的发展和转移[22]。在大鼠模型中,发现瑞芬太尼可抑制NK细胞活性和淋巴细胞增殖[23]。在临床研究中也观察到瑞芬太尼对免疫的类似抑制作用[24,25]。因此,减少使用阿片类药物如瑞芬太尼可能有益于癌症患者的预后。
本研究发现术后外周血单核细胞中的NK细胞百分比及其杀伤活性显著下降,这与手术和麻醉诱导的免疫抑制有关。令人印象深刻的是,使用Ⅱ型胸神经阻滞对NK细胞数量和功能的抑制作用较小。我们是第一个发现Ⅱ型胸神经阻滞对NK细胞具有支持作用的研究。这对于Ⅱ型胸神经阻滞在外科手术中的进一步临床应用至关重要,因为免疫调节可部分决定肿瘤的复发。术中未观察到NKT和T淋巴细胞的变化。然而,之前有研究报道,手术可能导致T淋巴细胞和NKT细胞的显著丢失[24,26,27]。可能是由于手术方式和癌症类型的不同而导致了有争议的结论。一篇文献研究了丙泊酚对乳腺癌患者T淋巴细胞和NK细胞的影响,发现术后NK细胞数量明显减少[28]。
在NK细胞存在的情况下,PG组术后血清培养的乳腺癌细胞凋亡率明显高于G组。结果提示PG组可能含有更多支持NK细胞增殖或杀伤活性的细胞因子。
除了血液中的这些免疫细胞外,研究PecsⅡ阻滞是否对肿瘤微环境中的免疫细胞有影响也很重要。例如,肿瘤组织和周围基质区的肿瘤浸润淋巴细胞(TIL)或PD-1和PD-L1水平是确定Pecs-Ⅱ阻滞如何影响与肿瘤微环境相关的免疫功能的重要参数,本研究省略了这些参数。但是,在我们的进一步研究中,有必要研究PecsⅡ阻断对肿瘤微环境中免疫系统的影响。
综上所述,术后Ⅱ型胸神经阻滞可增加外周血单核细胞(PBMC)中NK细胞数量,增强其杀伤活性,改善乳腺癌患者免疫功能。
