声动力联合免疫治疗抑制恶性黑色素瘤复发和转移的机制研究
2021-04-29胡宏志张艳丽郭雷洋刘亚玲
胡宏志,张艳丽,李 倩,郭雷洋,王 玲,刘亚玲*
(1.华中科技大学同济医学院附属协和医院骨科,湖北 武汉 430022;2.河北医科大学第三医院皮肤科,河北 石家庄 050051;3.河北医科大学第三医院骨科,河北 石家庄 050051)
恶性黑色素瘤(melanoma,MM)是一种起源于神经嵴黑色素细胞的高度侵袭性皮肤恶性肿瘤,临床进展迅速,易早期发生广泛转移,预后差[1]。近年来,MM的发病率和致死率均明显上升,给患者及其家庭带来了沉重的经济和精神负担。对于晚期MM患者,目前仍然没有有效的治疗方式控制肿瘤的局部复发和远处转移。因此,亟待开发一种有效的治疗方式激活宿主的免疫系统,产生长期免疫记忆抑制肿瘤复发和转移。声动力治疗(sonodynamic therapy,SDT)是一种类似于光动力疗法(photodynamic therapy,PDT)的治疗方法,利用低强度超声激活富集于肿瘤部位的高浓度声敏剂产生大量活性氧(reactive oxygen specie,ROS)发挥抗肿瘤效应[2]。值得注意的是,超声波可以穿透深部软组织而不受黑色素的影响,所以SDT比PDT更适用于富含黑色素的MM。由于肿瘤细胞旺盛的代谢反应和肿瘤血管的非正常生长,导致肿瘤组织局部严重缺氧[3],并且SDT过程的持续耗氧也会进一步加剧氧缺乏,而缺氧会极大地降低ROS的产生效率,进而影响SDT的治疗效果[4]。此外,缺氧会限制免疫细胞对肿瘤的浸润、加速肿瘤复发和转移[5]。因此,纠正肿瘤微环境的缺氧是提高SDT治疗效果的首要任务之一。线粒体是细胞内最重要的细胞器,是细胞有氧呼吸的主要来源场所。有文献报道,线粒体相关氧化磷酸化过程中产生三磷酸腺苷后过度消耗氧气是造成缺氧的主要原因之一[6]。因此,通过干预氧化磷酸化可以阻止三磷酸腺苷的产生,抑制肿瘤细胞对氧气的消耗,从而解决肿瘤微环境缺氧的难题[5]。二甲双胍(metformin,Met)是一种双胍类口服降糖药物,具有多种药理作用机制,因其降糖效果显著、不良反应小、患者依从性好而备受关注。此外,文献报道Met对在多种癌症中表现出具有抗肿瘤作用,包括MM[7-8]。同时,Met可以抑制线粒体氧化呼吸链中复合物I的活性,降低肿瘤的氧消耗[7]。因此,SDT与Met联用一方面可以降低内源性氧消耗,改善缺氧对SDT的抵抗作用,以提高SDT的疗效,另一方面可同时发挥Met的抗肿瘤效应来增强SDT的治疗效果。本课题组为开发有效的策略来改善SDT的抗肿瘤免疫反应,激发宿主产生长期的免疫记忆,开展了相应的初步研究,现报告如下。
1 资 料 与 方 法
1.1主要试剂 氧化石墨烯(graphene oxide,GO)、叶酸氨基聚乙二醇(Folate amino polyethylene glycol,FA-PEG-NH2)、Met、Ce 6、鼠来源的MM细胞B16-F10、RPMI-1640培养基、胎牛血清、双抗(青霉素+链霉素)、PBS、胰蛋白酶。
1.2方法
1.2.1材料合成 GO和FA-PEG-NH2通过缩合反应获得GO-PEG-FA。
1.2.2细胞活力检测 使用CCK8试剂盒进行细胞增殖检测。将3×103个B16-F10细胞接种于96孔板中,并培养过夜。进行相应处理24 h后,将培养基替换为100 μL含有10% CCK-8溶液的培养基,避光孵育2 h后,在酶标仪450 nm读取吸光度。
1.3统计学方法 应用GraphPad Prism version 6.01统计软件分析数据。所有实验至少重复三次。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
CCK8结果表明SDT联合Met可显著增强SDT对B16-F10的抗肿瘤效应,见表1。
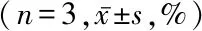
表1 各组细胞中细胞增殖活力比较
3 讨 论
初步研究结果表明,Met能增强SDT的抗肿瘤效应,后续实验将完善相关实验并验证Met是否能有效缓解细胞内缺氧,改善缺氧对SDT的抵抗作用,实现SDT/化疗联合抗肿瘤作用,增强SDT的抗肿瘤免疫效果。值得注意的是,文献报道由SDT引发的抗癌免疫过于短暂和脆弱,无法有效抑制肿瘤生长和复发[9]。未甲基化胞嘧啶-磷酸鸟嘌呤的寡核苷酸(cytosine-phosphate-guanine,CpG),作为一种免疫佐剂,可与浆细胞抗原呈递细胞(包括树突状细胞和巨噬细胞)中的Toll样受体9特异性结合,刺激免疫反应产生辅助性T细胞1和促炎细胞因子[10-11]。通过联合免疫佐剂增强SDT治疗后的抗原特异性反应,进而诱导宿主对残留肿瘤细胞产生长期的免疫记忆,是一种有前景的治疗策略。
综上所述,本课题结合前期的工作基础和初步实验结果设计一种能实现有效激活宿主抗肿瘤免疫的纳米治疗平台,实现化疗/SDT/免疫治疗协同增效激活免疫系统产生长期免疫记忆,抑制MM的复发和远处转移。这一新的免疫治疗策略通过激活宿主的抗肿瘤免疫反应获得更好的免疫治疗效果,在未来的临床转化中具有很大的潜力。
