干眼症患者泪液IL-1β、TNF-α、TSLP水平与BUT值、FL评分的相关性分析
2021-04-29黄锐升林丽敏李虹霓黄奕霞
黄锐升,林丽敏,金 泰,李虹霓,黄奕霞,苏 丹
(1.广东省汕头市中心医院,中山大学附属汕头医院眼科,广东 汕头 515031;2.广东省汕头市中心医院,中山大学附属汕头医院西药库,广东 汕头 515031)
干眼症系因泪液分泌不足、蒸发过多或泪液中成分异常导致的眼部不适及视功能障碍[1],主要表现为眼疲劳感、异物感以及干涩感。研究表明,炎性因子在干眼症发生、进展过程中扮演关键角色,但具体机制尚未探明[2]。白细胞介素(interleukin,IL)1β参与免疫、炎症反应的调节过程[3]。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)能通过诱导致炎酶分子、活性氧自由基以及IL-1分泌来发挥调控细胞趋化、黏附及炎性反应时细胞迁移功能[4]。胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)主要参与机体细胞免疫过程[5]。目前,关于干眼症患者泪液IL-1β、TNF-α、TSLP水平的报道较多,但其与泪膜破裂时间(break-up time,BUT)值、角膜荧光素染色(corneal fluorescein staining,FL)评分的关系鲜有报道。为此,本研究旨在探讨干眼症患者泪液IL-1β、TNF-α、TSLP水平与BUT值、FL评分的关系,报告如下。
1 资 料 与 方 法
1.1一般资料 选择2017年1月—2020年1月广东省汕头市中心医院收治的干眼症患者120例为研究组,男性48例,女性72例,年龄35~75岁,平均(52.6±13.62)岁,病程2个月~2年,平均(1.18±0.31)年,体重指数(body mass index,BMI)为23.19±2.29。纳入标准:①均符合干眼症诊断标准;②年龄≤75岁;③患者家属知情同意。排除标准:①合并心肝、肺、肾等脏器严重功能障碍患者;②近3个月眼部手术史及眼部活动性炎症史患者;③合并系统干燥综合征、角结膜化学伤、先天性无泪症、眼睑异常、先天性无泪腺等;④合并恶性肿瘤;⑤近3个月使用影响泪液分泌药物;⑥合并精神疾病而无法配合完成研究者;⑦妊娠、哺乳期。另选取同期健康志愿者100例为对照组,男性42例,女性58例,年龄36~75岁,平均(52.62±13.62)岁,BMI 23.24±2.39,均行眼科检查未见异常。2组性别、年龄、BMI差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准通过。
1.2方法 2组受检者均于首次检查时采集检测泪液样本。轻拉受检者下睑结膜,于结膜囊中滴入60 μL无菌生理盐水,嘱受检者轻微转动眼球,使生理盐水与泪液充分混合,于球结膜与穹隆结膜交界处轻微后压,采用毛细玻璃管收集泪液,并立即置入冻存管内,2 000 r/min,离心10 min,取上清液,-20 ℃冷存待检。采用酶联免疫吸附法检测泪液IL-1β、TNF-α、TSLP水平,试剂盒均购自上海信裕生物科技有限公司,严格按照试剂盒说明书操作,并采用全波长酶标仪(美国ThermoFisher公司产,型号为Multiskan Sky)于450 nm波长下测定吸光度(optical density,OD)值,并以标准曲线计算泪液样本中的IL-1β、TNF-α、TSLP水平。
BUT测定:将20 g/L荧光素钠涂抹于下睑结膜囊中,闭眼以便荧光素均匀分布于角膜表面,然后暴露角膜,并以钴蓝光照射,于裂隙灯下观察最后1次瞬目睁眼至泪膜上呈现的第1个破裂点时间,BUT值<10 s即为阳性,取3次检测平均值作为最终结果纳入数据统计。FL评分测定:以1%荧光素钠滴于下睑结膜囊中,观察荧光染色情况,眨眼几次,于钴蓝光下观察角膜4个不同象限染色情况,无染色记0分,散点状染色记1分,密集点状染色记2分,片状染色记3分,总分为0~12分。
1.3统计学方法 应用SPSS 22.0统计软件处理数据。计量资料比较采用独立样本t检验;相关性采用Pearson相关分析;诊断价值采用受试者工作特征(receiver operator characteristic curve,ROC)曲线分析,曲线下面积(area under curve,AUC)0.7~0.9表示具有一定准确性,AUC>0.9表示准确性较高。P<0.05为差异有统计学意义。
2 结 果
2.12组泪液IL-1β、TNF-α、TSLP水平比较 研究组泪液IL-1β、TNF-α、TSLP水平均显著高于对照组,差异有统计学意义(P<0.05),见表1。
表1 2组泪液IL-1β、TNF-α、TSLP水平比较Table 1 Comparison of IL-1β,TNF-α and TSLP between two groups
2.22组BUT值、FL评分比较 研究组BUT值明显低于对照组,而FL评分明显高于对照组,差异有统计学意义(P<0.05),见表2。
2.3泪液IL-1β、TNF-α、TSLP水平与BUT值、FL评分相关性 Pearson相关分析显示,泪液IL-1β、TNF-α、TSLP水平与BUT值呈显著负相关(P<0.01),与FL评分呈显著正相关(P<0.01),见表3。
2.4泪液IL-1β、TNF-α、TSLP水平对干眼症的诊断价值 ROC曲线分析显示,泪液IL-1β、TNF-α、TSLP水平诊断干眼症的AUC为0.830、0.885、0.838。以ROC曲线靠左上方约登指数的最大切点作为最佳临界值(IL-1β为90.485 ng/L,TNF-α为25.215 ng/L,TSLP为13.165 ng/L)。IL-1β诊断敏感度为67.5%,特异度为93.0%;TNF-α诊断敏感度为75.0%,特异度为88.0%;TSLP诊断敏感度为61.7%,特异度为91.0%。将泪液IL-1β、TNF-α、TSLP水平纳入Logistic回归模型,通过回归系数得出三项联合的数值计算公式为:三项联合=IL-1β+(0.319/0.095)×TNF-α+(0.525/0.095)×TSLP,统计分析得出联合数据。结果显示,三项联合诊断AUC为0.920,敏感度为90.0%,特异度为 94.0%,均高于IL-1β、TNF-α、TSLP单项检测,提示联合诊断价值较高,见表4,图1。

表2 2组BUT值、FL评分比较Table 2 Comparison of BUT value and FL score between two groups

表3 泪液IL-1β、TNF-α、TSLP水平与BUT值、FL评分相关性Table 3 Correlation of IL-1β,TNF-α,TSLP levels in tear fluid with BUT value and FL score
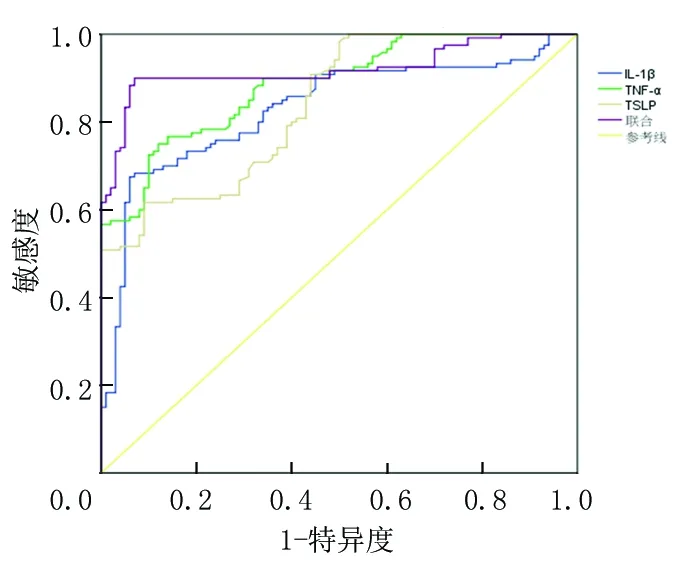
图1 泪液IL-1β、TNF-α、TSLP水平诊断干眼症给的ROC曲线
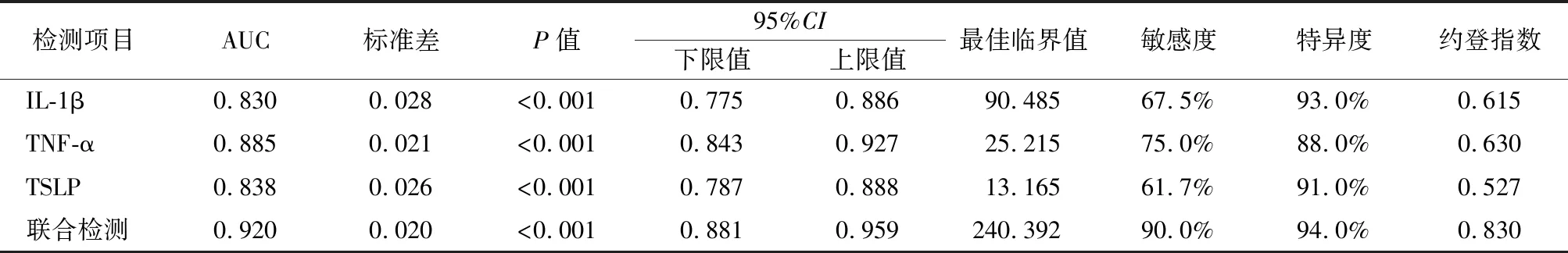
表4 泪液IL-1β、TNF-α、TSLP水平对干眼症的诊断价值Table 4 The diagnostic value of IL-1β, TNF-α and TSLP levels in tear fluid for dry eye
3 讨 论
近年来,干眼症发病率呈明显升高趋势[6]。研究表明,结膜上皮增生及炎症反应与泪膜稳定性有关,而此类细胞因子受体介导炎症反应可能是各类干眼症的共同发病基础[7-8]。
IL-1β是具有活性的巨噬细胞分泌的具备免疫调节功能的细胞因子,是IL-1的主要表达形式,同时也是IL-6、IL-8、TNF-α等其他细胞因子的诱导物[9]。 赵亚东等[10]研究显示,干眼症患者结膜、角膜上皮、泪液中的IL-1β水平高于正常对照组。IL-1β水平升高会抑制神经递质分泌,从而对神经调控泪液分泌过程造成影响,减少泪液分泌,最终导致干眼症的发生。肿瘤坏死因子主要由活化的巨噬细胞、自然杀伤细胞及T淋巴细胞产生,根据分泌来源不同分为TNF-α、TNF-β[11]。TNF-α在多种机体自身免疫病发生、进展中起到关键作用,且其广泛参与了肝细胞急性期蛋白合成诱导、髓样白血病细胞分化成巨噬细胞、细胞增殖分化、中性粒细胞吞噬、抗感染、杀伤抑制肿瘤细胞等过程[12]。TLSP是一类上皮细胞分泌细胞因子,主要和树突状细胞表面其特异性受体结合,并通过信号通路将树突状细胞激活,诱导辅助T细胞产生炎症反应及过敏反应[13]。
本研究结果显示,研究组泪液IL-1β、TNF-α、TLSP水平均显著高于对照组,提示泪液IL-1β、TNF-α、TLSP等炎性介质可能参与了干眼症的发生、进展过程。研究组BUT值明显低于对照组,FL评分显著高于对照组。BUT值常用作角膜前泪膜稳定性的评估指标,FL评分为角膜结膜上皮细胞缺损程度的评估指标,以上结果表明,干眼症患者的泪膜稳定性更低,角膜结膜上皮细胞缺损[14-15]。Pearson相关分析显示,泪液IL-1β、TNF-α、TSLP水平均与BUT值呈显著负相关,与FL评分呈显著正相关,提示泪液IL-1β、TNF-α、TLSP水平升高导致了干眼症患者泪膜稳定性降低及眼表损伤。ROC曲线分析显示,泪液IL-1β、TNF-α、TLSP水平均对干眼症具有良好的诊断价值(AUC=0.830、0.885、0.838),且三项联合(AUC=0.920)诊断价值较高。
综上所述,干眼症患者泪液IL-1β、TNF-α、TLSP水平与BUT值、FL评分均显著相关,IL-1β、TNF-α、TLSP水平升高导致泪膜稳定性降低及眼表损伤,联合检测泪液IL-1β、TNF-α、TLSP水平可用于干眼症的辅助诊断。
