脓毒症并发ARDS患者血清VE-Cad水平、Ang-2水平变化及其与预后的关系
2021-04-29张永军谭勇平
文 军,张永军,陈 群,谭勇平
(湖南省郴州市第一人民医院急诊科,湖南 郴州 423000)
脓毒症是指因感染而导致的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),具有较高的发病率,其致死率高达30%~70%[1]。急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是指患者因重症胰腺炎、有害气体吸入、脓毒症等非心源性致病因素而导致的呼吸窘迫,受累最严重的器官为肺脏,具有较高的发病率,脓毒症并发ARDS的致死率高达40%左右[2]。内皮细胞是反映肺损伤最快的细胞,在ARDS的发病过程中肺血管和肺泡表面的内皮细胞起到重要作用。血管生成素2(angiopoietin-2,Ang-2)是由内皮细胞合成,是血管形成因子,与ARDS的肺血管神经性水肿密切相关[3]。细胞黏附连接可维持内皮屏障的完整,而维持内皮细胞重要结构的是血管内皮钙黏蛋白(vascular endothelial cadherine,VE-Cad)与连环蛋白组成的复合体[4]。本文以脓毒症并发ARDS患者为研究,比较VE-Cad、Ang-2水平变化,并分析二者对预后的诊断价值。现将研究结果报告如下。
1 资 料 与 方 法
1.1一般资料 选取2016年1月—2019年12月在我院诊治的脓毒症并发ARDS患者79例作为研究对象,男性51例,女性28例。纳入标准:①经诊断均为脓毒症,符合2016年国际脓毒症定义中的诊断标准和病情判断标准[5],且200 mmHg(1 mmHg=0.133 kPa)<氧合指数[动脉血氧分压(partial pressure of oxygen,PaO2)/吸入氧浓度(fraction of inspiration,FiO2)]≤300 mmHg为轻度;100 mmHg
本研究经医院伦理委员会批准通过,所有患者知情同意并签署知情同意书。
1.2方法 于入院第2天清晨空腹抽取静脉血5 mL,采用3 000 r/min离心机进行10 min离心处理,选取上清血液保存待测(-70 ℃)。采用酶联免疫吸附法检测VE-Cad、Ang-2水平,试剂盒源自上海宇淳生物科技有限公司。
1.3观察指标 比较轻度组、中度组、重度组血清VE-Cad、Ang-2水平,比较存活组和死亡组血清VE-Cad、Ang-2水平,分析血清VE-Cad、Ang-2的相关性,分析血清VE-Cad、Ang-2对脓毒症并发ARDS预后的诊断价值。
1.4统计学方法 应用SPSS 22.0统计软件分析数据。计数资料比较采用χ2检验;计量资料比较采用t检验、单因素方差分析和LSD-t检验;相关性分析采用Pearson分析;多因素分析采用二元Logistic回归;诊断价值通过受试者工作特征(receiver operator characteristic curve,ROC)曲线评估,曲线下面积(area under curve,AUC)0.5~0.7时诊断准确性低,0.7~0.9时有一定准确性,>0.9准确性较高。P<0.05为差异有统计学意义。
2 结 果
2.1血清VE-Cad、Ang-2水平比较 中度组、重度组的VE-Cad、Ang-2水平显著较轻度组高(P<0.05),重度组显著较中度组高(P<0.05),说明随着病情的加重,VE-Cad、Ang-2水平呈上升趋势,见表1。存活组VE-Cad、Ang-2水平显著较死亡组低(P<0.05),见表2。
2.2血清VE-Cad、Ang-2的相关性 经Pearson分析,VE-Cad与Ang-2呈正相关(r=0.632,P<0.001)。
2.3脓毒症并发ARDS预后的多因素分析 死亡组赋值为1,存活组赋值为0,经二元Logistic回归分析,VE-Cad是影响脓毒症并发ARDS预后的独立影响因素(P<0.05)。见表3。

表1 不同程度脓毒症并发ARDS血清VE-Cad、Ang-2水平比较Table 1 Comparison of serum VE-Cad and Ang-2 levels in patients with ARDS complicated by sepsis of different degrees

表2 存活组和死亡组血清VE-Cad、Ang-2水平比较Table 2 Comparison of serum VE-Cad and Ang-2 levels between survival group and death group

表3 影响脓毒症并发ARDS预后的多因素二元Logistic回归分析Table 3 Multivariate Logistic regression analysis of multiple factors influencing the prognosis of sepsis complicated with ARDS
2.4血清VE-Cad、Ang-2对脓毒症并发ARDS预后的诊断价值 ROC曲线分析显示,VE-Cad、Ang-2预测脓毒症并发ARDS预后的AUC分别为0.906、0.690,见表4、图1。将VE-Cad、Ang-2纳入Logistic回归分析,根据回归结果中的回归系数值拟合二者联合诊断的数值计算公式:二者联合=VE-Cad+(-0.018/3.585)×Ang-2,经SPSS22.0统计得出联合数据。进一步分析显示,二者联合预测脓毒症并发ARDS预后的AUC为0.912,预测患者预后准确性较高。
依据AUC及标准误,采用Z检验AUC差异。如Ang-2与VE-Cad的AUC比较(Z=3.071,P=0.002)。检验显示:二者联合与Ang-2的AUC比较:Z=3.266,P=0.001;二者联合与VE-Cad的AUC比较:Z=0.130,P=0.897。
根据最佳临界值,当VE-Cad为3.805 μg/L时,其敏感度87.9%,特异度84.8%;当Ang-2为317.275 ng/L时,其敏感度45.5%,特异度89.1%;当二者联合为2.365时,其敏感度84.8%,特异度80.4%。见表4。
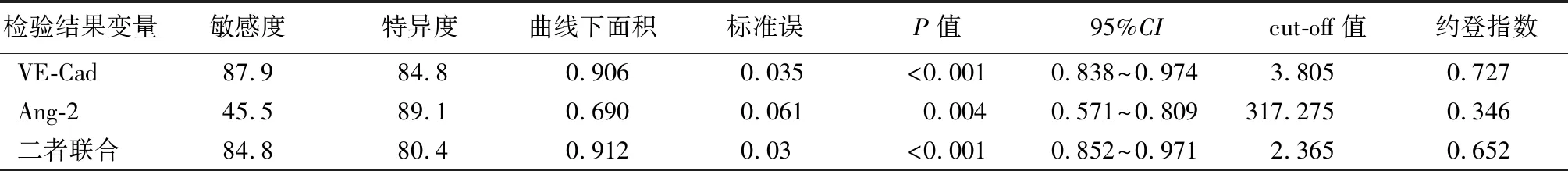
表4 血清VE-Cad、Ang-2诊断脓毒症并发ARDS预后的AUC、敏感度、特异度比较Table 4 Comparison of AUC, sensitivity and specificity of VE-Cad and Ang-2 in the diagnosis of sepsis complicated with ARDS
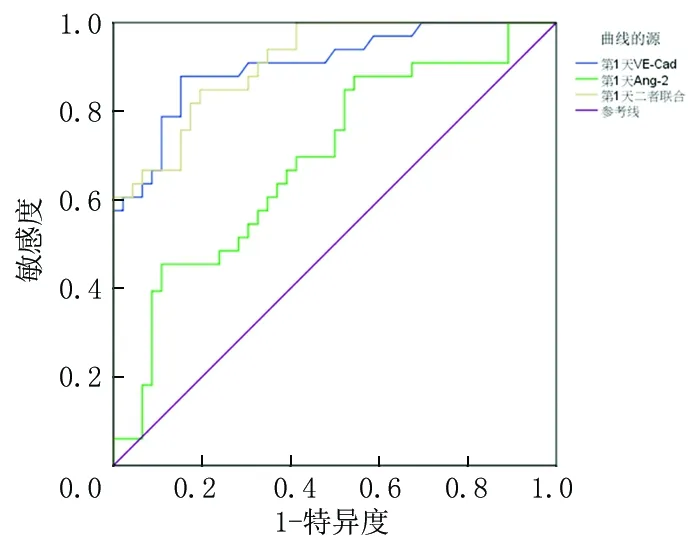
图1 血清VE-Cad、Ang-2诊断脓毒症并发ARDS预后的ROC曲线分析
3 讨 论
当发生脓毒症时,大量的中性粒细胞被过度激活,破坏肺泡的毛细血管屏障,增加微血管的通透性,使液体渗漏到肺泡腔而造成肺水肿。呼吸道是脓毒症最常见的感染源,而脓毒症患者炎症因子最先攻击的靶器官是肺脏,因而更易伴发急性肺损伤(acute lung injury,ALI),并发展为ARDS[6-7]。脓毒症并发ARDS患者均存在血管内皮损伤,患者肺部氧交换能力不足,血管通透性增强,导致氧气需求量和供应量失衡,使局部组织氧负载增加,严重损伤肺部毛细血管,造成肺不张、肺水肿等,甚至可能导致其他脏器功能发生障碍,导致不良预后发生[8-10]。
VE-Cad由多个含疏氨基酸组成,在局部纤维蛋白酶末端磷酸化过程中起到重要作用。洪秀芳等[11]研究表明,可通过调节脓毒症心脏微血管内皮细胞Src/VE-cadherin通路VE-Cad蛋白的表达,调节细胞通透性。本研究采用氧合指数将患者分为轻度、中度和重度三组,与其他诊断标准相比诊断过程简单、可行性较强、客观性较好,且更为操作方便[12]。本研究结果显示,血清VE-Cad水平比较:轻度组<中度组<重度组,可见VE-Cad水平随着脓毒症并发ARDS病情的严重程度的加重而升高。对患者的预后进行研究,发现79例患者死亡30例,病死率约为41.77%,与过往的40%左右的致死率相差不大。本研究结果还显示,存活组VE-Cad水平明显低于死亡组,可见脓毒症并发ARDS预后越差,VE-Cad水平越高。经二元Logistic回归分析,VE-Cad是影响脓毒症并发ARDS预后的独立影响因素;ROC曲线显示,VE-Cad诊断脓毒症并发ARDS预后的AUC分别为0.906,诊断价值均较高,敏感度、特异度分别为87.9%、84.8%。提示VE-Cad对脓毒症并发ARDS预后具有较高的诊断价值。
Ang-2由内皮细胞分泌合成,有氨基酸496个,在染色体8p21上,作用于内皮细胞特异性受体Tie-2,从而使其与Ang-1的结合受阻,导致增加血管通透性,使血管发生渗漏[13]。Ang-1通过与受体Tie-2结合,激活Tie-2,维持内皮细胞稳定性。静息状态下Ang-2较少,当受到刺激时会激活内皮细胞,导致Ang-2的合成与分泌增加,提示Ang-2可能成为内皮功能失调和激活的指标[14]。有研究表明,Ang-2与白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症细胞呈正相关,说明高表达的Ang-2可反映炎症状态[15]。经Pearson分析,VE-Cad与Ang-2呈正相关,提示VE-Cad水平升高时,Ang-2也会随之升高。本研究结果显示,血清Ang-2水平比较:轻度组<中度组<重度组;存活组的Ang-2水平显著低于死亡组;ROC曲线显示,Ang-2诊断脓毒症并发ARDS预后的AUC分别为0.690,明显低于Ang-2,敏感度、特异度分别为45.5%、89.1%。提示
脓毒症并发ARDS病情越严重、预后越差Ang-2水平越高,但Ang-2对脓毒症并发ARDS预后的诊断价值较低。
此外,本研究联合诊断数据显示,VE-Cad、Ang-2二者联合诊断脓毒症并发ARDS预后的AUC为0.912,明显高于Ang-2,诊断价值均较高,敏感度、特异度分别为84.8%、80.4%,可对Ang-2单项检测中敏感度或特异度低的问题进行弥补。因此,临床上可加强血清VE-Cad、Ang-2的监测,提高综合诊断效能,从而改脓毒症并发ARDS患者的预后。
综上所述,脓毒症并发ARDS病情越严重VE-Cad、Ang-2水平越高,且死亡患者VE-Cad、Ang-2水平较高,VE-Cad、二者联合对脓毒症并发ARDS预后具有较高的诊断价值,其中二者联合的诊断价值最高。
