发酵乳中生物活性肽的研究进展
2021-04-28刘振民
洪 青,刘振民
(乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院,上海 200436)
发酵乳是由保加利亚乳杆菌和嗜热链球菌及其他乳酸菌共同发酵制备的乳制品。乳酸菌具有丰富的胞内蛋白酶及运输系统组成的蛋白水解酶系,能够将完整乳蛋白水解成小分子的多肽和氨基酸。其中,生物活性肽是一类具有益生生理功能的多肽类化合物,对宿主生理代谢与免疫调节具有重要作用。生物活性肽大小不一,一般是由2~20 个氨基酸组成的短肽段。乳源生物活性肽因活性强、天然来源、易制备等优势,成为乳品领域的研究热点之一[1]。目前主要通过不同酶解或乳酸菌水解获得,不同的发酵菌株可以产生各种形式的生物活性肽,包括抗氧化肽、降血压肽、免疫调节肽、抗菌肽及阿片活性肽等,具有调控抗氧化应激、调节心血管系统、免疫系统、神经系统及胃肠道系统功能等生理功能[2-4]。
1 乳酸菌的蛋白水解系统
乳酸菌的蛋白水解系统主要包括:1)一种或多种细胞壁蛋白酶,也称为细胞包膜蛋白酶(cell envelope proteinase,CEP),能够将乳蛋白水解成含有4~30 个残基的肽;2)肽的转运系统,包括寡肽结合蛋白、2 个形成孔的通透酶和2 个供能的ATPases;3)多肽降解为氨基酸所必需的细胞内肽酶。CEP是乳酸菌蛋白水解的主要参与者,由6~8 个功能结构域组成。其中,PP结构域包括信号肽和前肽;PR结构域包含由天冬氨酸、丝氨酸和组氨酸残基组成的特定催化三元结构域;最终插入I结构域,负责调节CEP的底物特异性;A结构域保守性差,参与调节蛋白水解活性,影响PR结构域的特异性;在乳球菌和乳杆菌中发现B结构域,与酶活性和酶空间结构特异性的稳定有关;H螺旋结构域参与胞外A和B结构域的正确定位;W结构域作为细胞壁间隔物,可以作为蛋白酶的结合结构域;AN结构域是锚定结构域,但并不是所有细胞壁蛋白酶中都存在[5]。目前共发现5 种CEP,分别为PrtP、PrtS、PrtH、PrtB和PrtR,这些CEP包含不同数量的结构域,如PrtS中没有B域,PrtR中没有I域,PrtH和PrtB中没有AN域[6]。影响CEP表达及乳蛋白释放生物活性肽能力的因素包括酶底比、培养基组成、温度、酸碱度和碳氮比等[7]。研究10 株嗜热链球菌活性CEP对αs1-、αs2-、β-酪蛋白的降解结果发现,具有高度蛋白水解能力的菌株降解酪蛋白产生最多的肽,β-酪蛋白>αs2-酪蛋白>αs1-酪蛋白,其中有20 个肽具有生物活性,15 个肽为血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制剂,其他肽为免疫调节肽和抗菌肽[8]。
2 抗氧化肽
宿主细胞代谢时,部分氧被还原成活性氧(reactive oxygen species,ROS),包括过氧化物、氧离子和含氧自由基等,由于ROS中存在未成对的自由电子,极其不稳定,具有较高的氧化活性。当机体受到刺激时,ROS的生态平衡遭到破坏,导致体内ROS过载,出现氧化应激现象,进而导致脂质氧化、DNA氧化损伤和蛋白表达异常等,诱发高血脂、动脉粥样硬化和心脑血管疾病等。
抗氧化肽的作用机理是清除自由基,在所选的抗氧化体系中,自由基清除能力可以通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氮双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基和羟自由基清除能力、铁离子还原能力以及抑制脂类物质氧化能力等体现。抗氧化肽的活性与其氨基酸组成、序列、结构及金属盐络合相关。抗氧化肽一般由20 个以下氨基酸残基组成,同时末端含有苯丙氨酸、丙氨酸、亮氨酸和缬氨酸等疏水性氨基酸时,抗氧化性增强[4]。此外,酸性氨基酸可以通过侧链羧基螯合金属离子,钝化金属离子的氧化作用,也能起到抗氧化作用[9]。
陈姗[10]利用复配菌种(保加利亚乳杆菌LB-12、嗜热链球菌ST-Body-2、植物乳杆菌Vege-Start 2.0 CN、副干酪乳杆菌431和鼠李糖乳杆菌Fresh Q2)制备的发酵乳中多肽的抗氧化活性均高于单一菌株发酵乳,复配菌种发酵乳中,DPPH自由基和ABTS阳离子自由基清除率分别达到51.3%和90.7%,金属离子还原能力和螯合能力分别为496.5 nmol/L TE和94.22%,抗氧化能力综合评价最强,鉴定得到42 条抗氧化肽序列。Tonolo等[11]从发酵乳中富集纯化出23 条多肽,通过固相合成后测定体外和Caco-2模型中的抗氧化能力和作用机理,其中NTVPAKSCQAQPTTM、QGPIVLNPWDQVKR和APSFSDIPNPIGSENSE通过氧化还原敏感信号系统Kelch样ECH相关蛋白1/核因子E2相关因子2(Kelch-like ECHassociated protein 1/nuclear factor erythroid 2-related factor 2,Keap1/Nrf2)刺激Nrf2从胞质转移至细胞核中,提高了抗氧化酶的过表达和活性。骆雨雨等[12]用瑞士乳杆菌S3、副干酪乳杆菌D21、乳酸乳球菌Y6和酿酒酵母菌K23混合制备发酵乳,结果表明,添加酵母的乳杆菌蛋白水解能力优于乳球菌,且制备的发酵乳抗氧化活性最高。Aloğlu等[13]发现,传统手工制备的发酵乳中水溶性多肽比商业发酵乳具有更高的DPPH和ABTS阳离子自由基清除活性。Elfahri等[14]评估瑞士乳杆菌ASCC953、ASCC474、ASCC1188和ASCC1315菌株蛋白酶活性及其发酵乳抗氧化和体外抗肿瘤特性,结果表明,ASCC474发酵牛乳12 h后,发酵乳呈现出最高的DPPH自由基清除活性,发酵24 h时活性显著降低,表明乳酸菌发酵牛乳产肽特性和活性表现出高度的菌株依赖性和时间依赖性。
3 降血压肽
以ACE抑制肽为代表的降血压肽是目前研究最多的活性肽之一。ACE主要通过肾素-血管紧张素系统和激肽释放酶-激肽系统调节血压。在肾素-血管紧张素系统中,ACE能将无升压活性的十肽血管紧张素Ⅰ的C端二肽His-Leu切除,转变为血管收缩剂血管紧张素Ⅱ,导致血压升高;在激肽释放酶-激肽系统中,ACE能够切除舒缓激肽C端的二肽Phe-Arg,使其失活,最终导致血压升高;因此,抑制ACE活性对于降低血压极其重要[15]。
当肽中含有疏水性氨基酸和芳香族氨基酸时,会表现出较强ACE抑制活性。同时,当C末端为疏水性氨基酸残基,则肽段的ACE抑制活性较高。如目前最典型的具有降血压功能的活性肽缬氨酸-脯氨酸-脯氨酸(Val-Pro-Pro)和异亮氨酸-脯氨酸-脯氨酸(Ile-Pro-Pro),由于肽段很短以及肽的C末端为疏水性氨基酸脯氨酸,因此很容易和ACE结合,抑制其活性。Gonzalez-Gonzalez等[16]利用两歧双歧杆菌MF20/5和瑞士乳杆菌DSM13137分别发酵牛乳后发现,两歧双歧杆菌MF20/5组产生一种新的ACE抑制肽LVYPFP和抗氧化肽VLPVPQK,瑞士乳杆菌DSM13137组总肽含量较少,但检测出三肽缬氨酸-脯氨酸-脯氨酸(VPP)和异亮氨酸-脯氨酸-脯氨酸(IPP);pH 4.6时,瑞士乳杆菌DSM13137组总肽含量与ACE抑制活性较高,两歧双歧杆菌能够以较慢的产酸速率产生高含量的多肽,生产时无需控制pH值。乳酸明串珠菌PTCC发酵产生的多肽MVPYPQR具有抗氧化性和ACE抑制活性,该肽的作用机制是其C末端的Gln162和Arg之间存在氢键,同时该肽可以扭曲酶的Zn2+四面体几何形状[17]。采用粪肠球菌CECT5727制备的发酵乳中鉴定出2 种多肽:LHLPP和LVYFPGPIPNSLPQNIPP,半数抑制浓度(50% inhibition concentration,IC50)为5 μmol/L,以2 mg/kg剂量灌胃自发性高血压大鼠时,2 种肽均表现出降血压活性[18]。
其他乳源发酵乳中同样也发现ACE抑制肽活性。Sathya等[19]接种4%植物乳杆菌NCDC379发酵山羊乳获得最高的ACE抑制活性(97.55%),活性肽分子质量为1.4 kDa。Ayyash等[20]发现3 株益生菌株(罗伊氏乳杆菌KX881777、植物乳杆菌KX881772和植物乳杆菌KX881779)发酵骆驼乳比发酵牛乳有更高的蛋白水解和抗氧化活性,罗伊氏乳杆菌KX881777呈现出最高的ACE抑制活性,能够抑制Caco-2、MCF-7和Hela细胞的增殖,表现出抗肿瘤活性。Maruyama等[21]发现,C端为Val-Ala-Pro的ACE抑制肽(IC50=2.0 μmol/L)的ACE抑制活性远高于N端为Val-Ala-Pro的ACE抑制肽(IC50=550 μmol/L),但是C端为Phe-Val-Ala-Pro与N端为Phe-Val-Ala-Pro ACE抑制肽的ACE抑制活性接近,猜测ACE抑制肽C端倒数第3个氨基酸残基具有较强的立体特异性,但是倒数第4个氨基酸残基不具有立体特异性。
发酵乳的工艺参数对ACE抑制肽的生成具有显著影响。研究单一菌株发酵特性证实,凝乳后ACE抑制活性快速增强,肽含量与ACE抑制活性呈正相关;乳清蛋白含量与发酵乳ACE抑制活性呈负相关,酪蛋白含量与发酵乳ACE抑制活性呈正相关;与常规发酵乳42 ℃发酵温度相比,37 ℃发酵条件下发酵乳ACE抑制肽含量显著增加[22]。贮藏期间,发酵乳中抗高血压活性肽含量也在缓慢增加,原因是4 ℃条件下乳酸菌及其蛋白酶仍在缓慢发生蛋白降解反应[23]。
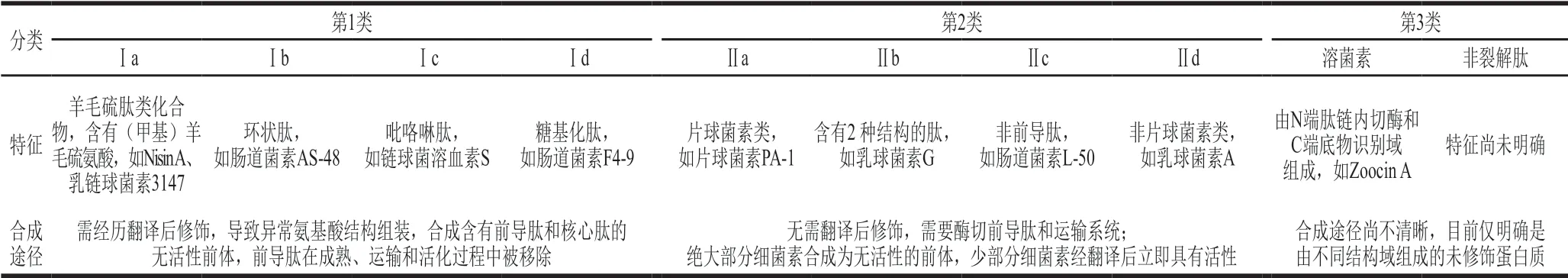
表 1 乳酸菌源细菌素的分类[27]Table 1 Classification of bacteriocins produced by lactic acid bacteria[27]
4 抗菌肽
抗菌肽具有广谱抗细菌活性,能杀死革兰氏阴性菌和革兰氏阳性菌,如大肠杆菌、金黄色葡萄球菌、单增李斯特菌和沙门氏菌等。按照来源划分,抗菌肽包括动物源抗菌肽、植物源抗菌肽和细菌抗菌肽(又称细菌素)。尽管有大量研究报道了细菌素及其特征与作用模式,但商业化的细菌素很少,乳酸乳球菌来源的Nisin是使用最广泛的细菌素,在食品中控制革兰氏阳性菌生长;乳酸片球菌来源的片球菌素PA-1用于抑制肉制品中单增李斯特菌的增殖;麦芽芳香诺杆菌来源的Carnocyclin A在即食肉制品中能防止单增李斯特菌污染。
细菌素的产生机理与常规生物活性肽不同。细菌素在乳酸菌生长过程中被分泌至胞外,由核糖体产生,而大部分生物活性肽可以通过膜内蛋白酶作用由底物蛋白产生,是胞外水解产物[24]。细菌素种类繁多,革兰氏阳性菌或革兰氏阴性菌都可以产生细菌素,这些细菌素能够抑制与产生菌株相关或无关的微生物,可以是小分子质量(<10 kDa)或大分子质量(>30 kDa),包含不耐热肽和耐热肽,小部分还会经历转录后修饰[25]。因此细菌素的分类方案很难统一。2016年,Alvarez-Sieiro等[26]提出了一种新的分类方法,该方法只包括由乳酸菌和双歧杆菌产生的细菌素。Venegas-Ortega等[27]在其基础上进行修正,乳酸菌源细菌素共分为三大类,如表1所示。
de Lima等[28]从开菲尔发酵绵羊乳中鉴定出13 条抗菌肽,贮藏28 d后,活性肽仍表现出抗氧化活性。细菌素与操纵子的合成调节相关。如乳酸乳球菌合成的Nisin与Nisin控制表达(nisin controlled expression,NICE)系统相关,该系统由2 个组成型启动子和2 个诱导型启动子组成,Nisin作为诱导剂控制该表达系统[29]。华鹤良[30]筛选得到嗜热链球菌ST和保加利亚乳杆菌IV-3,二者产生的抗菌肽具有广谱抑菌效果,对革兰氏阳性菌和革兰氏阴性菌均具有抑菌效果;发酵22~24 h后产生的抗菌肽活性最强,且保加利亚乳杆菌IV-3产生的抗菌肽抑菌效果强于嗜热链球菌ST产生的抗菌肽,这些小分子抗菌肽具有较好的热稳定性,100 ℃处理20 min仍具有抑菌活性,酸性条件下稳定,易被蛋白酶水解。利用瑞士乳杆菌TUST-005制备的发酵乳不与发酵剂产生拮抗作用,对大肠杆菌、沙门氏菌和金黄色葡萄球菌有抑制效果,该抗菌效果不受胃蛋白酶和胰蛋白酶影响,但高pH值条件下抗菌效果减弱,原因可能是抗菌肽通过其两亲性的α-螺旋插入导质膜中,在膜上形成阳离子通道,改变细胞透性,引起细胞质溢流,从而杀死病原体[31]。Muhialdin等[32]对发酵骆驼乳的抗菌活性进行研究,编号14的组分显示出最高的抗微生物活性,对粪肠球菌、痢疾志贺氏菌、金黄色葡萄球菌和大肠杆菌具有抑制作用,该组分含有32 个肽,其中6 种多肽属于Lactophorin,分子质量0.992~1.713 kDa。
由于传统抗生素的不规范使用,自然界中的微生物通过改变细胞膜动力学结构或增强蛋白水解酶活性,对抗生素产生抗性,还会发生耐药基因转移现象。因此,未来需要严格制定不同抗菌肽的使用量与使用规则,以避免该种情况的发生。
5 其他功能活性肽
5.1 降血糖肽
乳制品对胰岛素分泌和血糖控制的益处归因于刺激胰岛素分泌的大量必需氨基酸和生物活性肽、大量营养素和微量营养素的特定组合,以及干酪和发酵乳中发现的独特益生菌菌株和生物活性肽;目前发现多肽VAGTWY和LPQNIPP可以用于帮助控制糖尿病患者的血糖水平和胰岛素分泌[33]。
5.2 阿片样肽
阿片类化合物是能够结合阿片类受体并发挥激动剂或拮抗剂作用的化合物。阿片肽的序列中包括芳香族氨基酸,如其N端序列中的酪氨酸和脯氨酸。酪氨酸被证明是绝对必要的,因为这种替代会导致阿片肽活性的丧失[34]。
5.3 免疫调节肽
乳源性肽的免疫调节活性通常表现在两方面:一是刺激淋巴活力并促进增殖,其中肽主要来源于β-酪蛋白和κ-酪蛋白;另一种是抑制淋巴细胞活性和减少增殖,其中大多数来源于α-酪蛋白的肽起到这种作用。免疫系统的正调节因子可以促进免疫细胞分泌多种免疫因子,如免疫球蛋白A、白细胞介素-6(interleukin 6,IL-6)等,以增强人体免疫力。当负调节因子抑制淋巴细胞增殖时,会上调IL-10的表达,下调IL-2的表达,从而降低人体过敏反应[35]。Qian Bingjun等[36]对德氏乳杆菌LB340发酵的发酵乳离心后进行超滤,得到4 个肽级组分,分子质量分别为5~10、3~5、1~3 kDa和<1 kDa;分子质量3~5 kDa的肽显示出良好的抗氧化活性,将分子质量<1 kDa的肽用Superdex-30 G柱分离,产生6 个组分,其中组分F2表现出最高的ACE抑制活性,IC50为67.71 mg/mL,组分F6对小鼠脾淋巴细胞增殖有积极作用,刺激指数为0.729,具有良好免疫调节活性。
5.4 多功能肽
具有单一生物活性(如抗氧化、抗高血压和抗菌)的发酵乳活性肽被大量研究报道,但很少有研究描述多功能生物活性肽。多功能活性肽因同时触发、调节或抑制多种生理途径,其活性可能优于单活性肽。Aguilar-Toala等[37]评估特定植物乳杆菌制备的发酵乳的抗炎、抗溶血、抗氧化、抗突变和抗菌活性,结果表明,总的来说,发酵乳粗提取物活性最高,其次为分子质量小于3 kDa的肽组分,最后为分子质量3~10 kDa的肽组分;其中,植物乳杆菌55显示出较高的抗炎活性(723.68~1 759.43 mg/mL双氯芬酸钠当量)、抗溶血活性(抑制率36.65%~74.45%)和抗氧化活性(282.8~362.3 μmol/mL Trolox)。
6 生物活性肽的序列鉴定与功能预测
生物活性肽鉴定的常规方法是以某种生物活性为目的,利用多种纯化分离方法得到活性强的部分并鉴定,但该流程可能会导致含量低的活性肽未被检测出。徐海红等[38]通过前处理富集发酵乳中的多肽,建立计算机联合超高效液相色谱的分子质量匹配序列技术,共鉴定出118 条多肽。
鉴定发酵乳中乳酸菌产生的生物活性肽功能潜力可以通过2 种方式预测。第1种是分析乳酸菌蛋白水解系统的基因组,确定不同的酶活性或底物特异性;第2种是使用计算机方法定量多肽结构与活性的关系,评估产生生物活性肽的蛋白质基质组成特性。随着生物活性肽数据库的建立和文献积累,将生物信息学与实验结果相结合为肽的潜在功能预测提供了极好的基础,并可用于大型实验室菌株收集与筛选。其中,定量构效关系和分子对接常用于预测新型活性肽的结构与活性。Deng Baichuan等[39]从数据库中筛选收集了141 种ACE抑制肽,使用定量构效关系预测了5 种新型ACE抑制肽的IC50,并通过体外实验进行验证,发现影响ACE抑制活性最相关的特性为疏水性、空间效应与电子特性,C端氨基酸作用大于N端氨基酸。Tu Maolin等[40]利用分子对接法筛选出酪蛋白酶解产物中一种新的多肽EKVNELSK,该肽来自αs1-酪蛋白(f35-42),与ACE的亲和力最强,人工合成该肽,发现其ACE抑制活性IC50为5.998 mmol/L。
7 结 论
发酵乳中生物活性肽主要来源于乳酸菌的蛋白水解,蛋白酶的差异化导致了生物活性肽的多样性。目前乳蛋白中新的生物活性肽及其在发酵乳制品中的生理功能仍在不断扩增,包括预防和控制某些疾病,如高血压、Ⅱ型糖尿病或肥胖症以及更广泛的代谢综合征,这为开发新型功能性乳制品提供了良好的技术支撑。随着组学技术的飞速发展,转录组学和蛋白质组学正逐步应用于解释这一复杂过程。乳酸菌发酵获取生物活性肽被认为是一种经济并能规模化的技术,包括抗氧化肽、降血压肽和抗菌肽等。未来需要进一步研究活性肽的确切作用机制,阐明肽活性与肽的构效关系,使用动物模型或临床实验来验证其在体内的生物活性。
