动态增强MRI诊断无钙化乳腺导管原位癌
2021-04-27崔晓琳刘学静杨正汉
崔晓琳,刘学静,张 洁,杨正汉
(首都医科大学附属北京友谊医院放射科,北京 100050)
乳腺导管原位癌(ducal carcinoma in situ, DCIS)又称导管内癌,是导管内皮细胞异常增生但未侵犯基底膜的非浸润性癌,30%~50% 可发展为浸润癌[1-2]。超声对于DCIS诊断价值有限[3]。乳腺X线摄影通过发现特征性可疑钙化灶,即以节段性分布的细小多形性或细小分枝状钙化而诊断DCIS,大约23%~44% DCIS无钙化灶[4-5]。MRI对DCIS、尤其无钙化DCIS的敏感性明显高于X线摄影[6-7],已成为检测DCIS的首选影像学方法。本研究探讨动态增强MRI诊断无钙化DCIS的价值。
1 资料与方法
1.1 一般资料 回顾性分析2014年7月—2019年12月129例于首都医科大学附属北京友谊医院经手术病理证实的乳腺DCIS患者,均为女性,年龄32~72岁,平均(51.1±9.3)岁;26例无明显临床表现但超声提示乳腺低回声病灶,11例乳腺肿块,36例乳头溢液,15例局部腺体增厚,21例乳腺胀痛;另20例为无症状乳腺癌高危人群,包括经基因检测有明显乳腺癌遗传倾向者、既往有乳腺导管或小叶不典型增生或小叶原位癌病史及接受胸部放射治疗史。纳入标准:先后接受乳腺X线摄影及MR检查,时间间隔<1个月;无乳腺癌病史;患侧乳腺无手术史;临床及病理学资料完整。排除标准:存在最大径>1 mm浸润灶。
1.2 仪器与方法
1.2.1 乳腺动态增强MRI 采用GE Discovery 750W超导型3.0T MR仪,8通道乳腺表面专用线圈。嘱患者俯卧位,使双侧乳腺自然悬垂于线圈内。依次采集平扫脂肪抑制T2WI、T1WI、扩散加权成像(diffusion-weighted imaging, DWI)、轴位动态增强T1WI及矢状位延迟期脂肪抑制T1WI。脂肪抑制T2WI:TR 4 585 ms,TE 85 ms,层厚5 mm,翻转角90°,矩阵320×256,FOV 32 cm×32 cm。DWI:TR 2 450 ms,TE 68 ms,层厚5 mm,矩阵128×160,FOV 32 cm×32 cm,b=0、1 000 s/mm2。轴位动态增强T1WI:采用乳腺评估容积成像序列,先采集1期蒙片,之后应用双筒高压注射器以流率3.0 ml/s注射对比剂Gd-DTPA 0.2 mmol/kg体质量,跟注10 ml生理盐水,即刻行无间隔动态增强扫描,TR 4.9 ms,TE 1.9 ms,翻转角10°,矩阵288×192,FOV 32 cm×32 cm,层厚2 mm,共8期,每期扫描时间55 s。扫描结束后于病灶早期强化最明显区域放置ROI,尽量避开出血、坏死及囊变,获得时间-信号强度曲线(time-signal intensity curve, TIC),Ⅰ型TIC为流入型;Ⅱ型为平台型;Ⅲ型为流出型;另于同侧乳腺无病变腺体放置相同大小ROI为对照。
1.2.2 乳腺X线摄影 采用GE Senographe DS数字化乳腺成像系统,常规投照体位为头足位和内外斜位,必要时加行局部加压放大像。
1.3 影像学分析 由2名具有5年以上乳腺疾病影像学诊断经验的主治医师采用盲法共同阅片,参照美国放射学会2013年乳腺影像报告和数据系统(breast imaging report and data system,BI-BADS)[8]标准分析病灶影像学表现及血流动力学改变,意见不一致时经协商达成共识。
1.4 病理学评估 参照世界卫生组织2012年乳腺肿瘤分类[8],将DCIS分为低核级(G1)、中核级(G2)、高核级(G3);G1及G2为非高核级。判断免疫组织化学染色雌激素受体(estrogen receptor, ER)和孕激素受体(progesterone receptor, PR)标准:阳性肿瘤细胞≥1%为ER/PR表达阳性,<1%为ER/PR表达阴性;人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)(+)和(-)为HER-2表达阴性,(+++)为HER-2表达阳性;遇(++)时以FISH基因扩增为HER-2表达阳性。
1.5 统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示,以t检验进行比较。根据乳腺X线摄影结果判定病灶有无钙化,以χ2检验或Fisher确切概率法比较有、无钙化DCIS临床、影像学及病理特征的差异及其中不同形态病灶血流动力学参数的差异。P<0.05为差异有统计学意义。
2 结果
共133个病灶纳入研究。术后病理结果显示82个单纯DCSI,51个DCSI存在最大径≤1 mm的微浸润灶(micro invasion, MI),即DCIS-MI,均无淋巴结转移。
2.1 有、无钙化DCIS临床、病理学及MRI特征比较 乳腺X线摄影显示48个(36.09%)病灶无钙化,85个(63.91%)病灶存在钙化。MRI对钙化DCIS的敏感度(84/85,98.82%)与乳腺X线摄影(85/85,100%)差异无统计学意义(P=0.50),而对无钙化DCIS的敏感度(48/48,100%)高于乳腺X线摄影(26/48,54.17%,χ2=28.54,P<0.01)。有、无钙化DCIS之间,动态增强MRI早期强化方式及病理学核分级差异均有统计学意义(P均<0.05),患者年龄、病灶形态、延迟强化方式、ER、PR及HER-2表达差异均无统计学意义(P均>0.05),见表1。
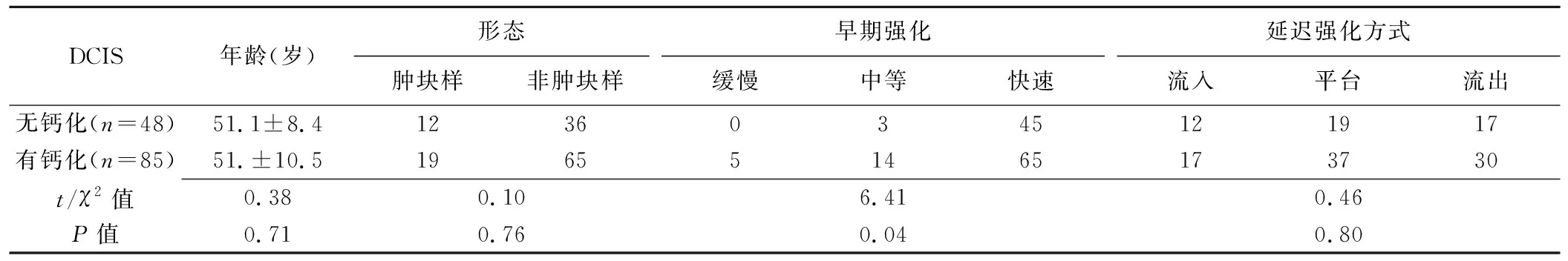
表1 有、无钙化DCIS临床、MRI及病理学表现比较(个)
2.2 无钙化DCIS的MRI及病理学表现 48个无钙化DCIS中,增强MRI显示12肿块样强化,包括圆形1个、椭圆形4个、不规则形7个,边缘光滑5个、不规则3个、毛刺4个,病灶内部强化均匀4个、不均匀7个、环形强化1个;36个为非肿块样强化,包括局灶性9个、线条状4个、节段性13个、区域性9个、多区域性1个,病灶内部强化均匀9个、不均匀13个、集簇状8个、簇状环形6个。无钙化DCIS中,肿块与非肿块样强化病灶的核分级、早期强化及延迟强化方式差异均无统计学意义(P均>0.05),见表2及图1、2。
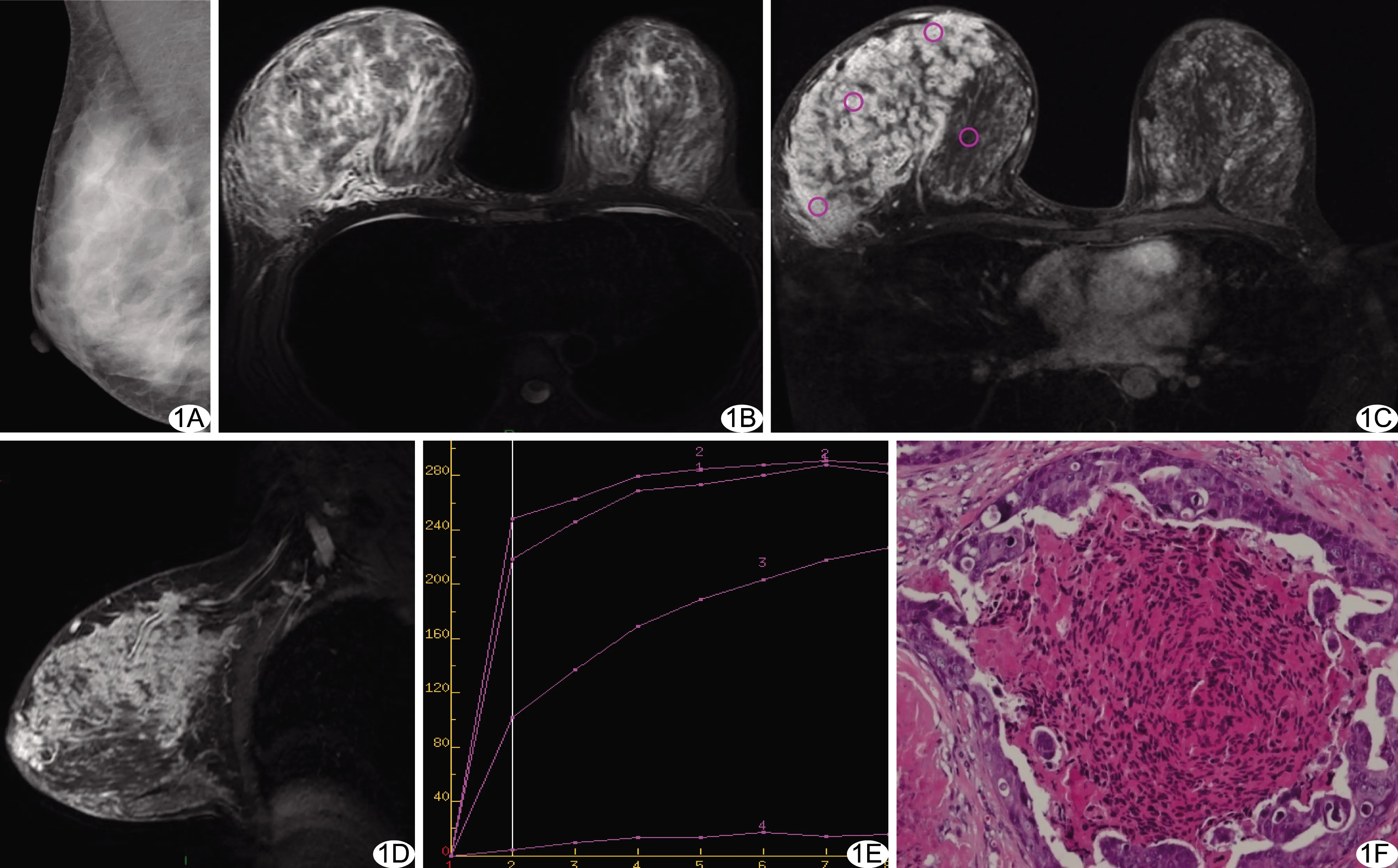
图1 患者女,38岁,右乳DCIS A.内外斜位乳腺X线摄影未见钙化灶; B.轴位脂肪抑制T2WI示右侧乳腺体积增大、信号增高; C~D.轴位动态MR增强T1WI第2期图像(C)及矢状位脂肪抑制延迟增强图像(D)示右侧乳腺外上象限节段性分布的非肿块样强化病灶,内部呈簇状环形强化(图C中圆圈为ROI); E.TIC为Ⅱ型; F.病理图(HE,×200)示病灶为G3级DCIS-MI
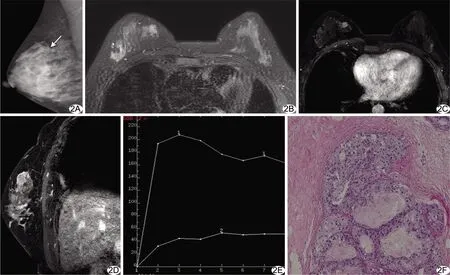
图2 患者女,44岁,右乳DCIS A.内外斜位乳腺X线摄影示局部腺体扭曲,未见明确钙化(箭); B.轴位脂肪抑制T2WI示右侧乳腺内上象限浅分叶、稍高信号肿物; C~D.轴位动态MR增强T1WI第2期图像(C)及矢状位脂肪抑制延迟增强图像(D)示肿块明显均匀强化,边界清晰; E.TIC为Ⅲ型; F.病理图(HE,×100)示病灶为G1级DCIS
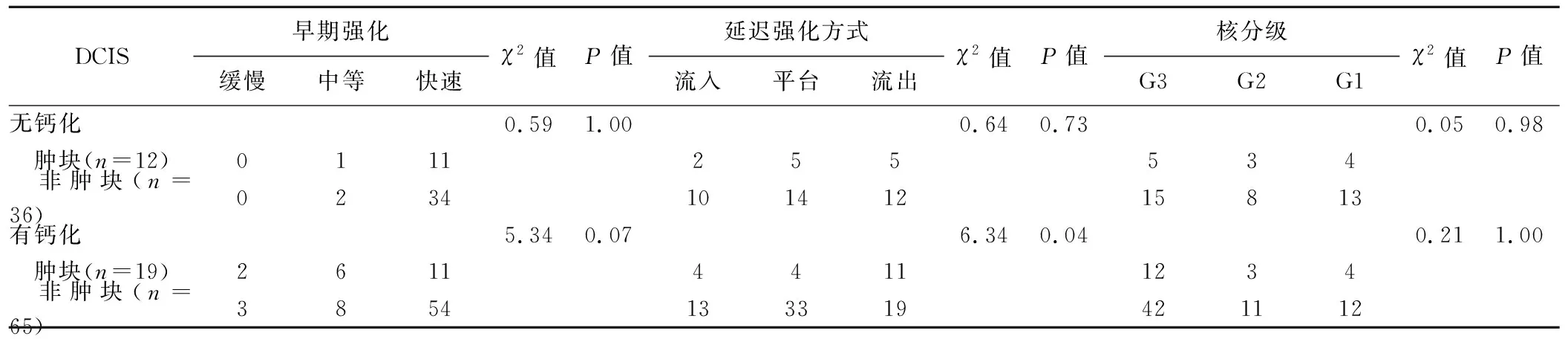
表2 有、无钙化不同形态DCIS的MRI及病理学表现比较(个)
2.3 有钙化DCIS的MRI及病理学表现 84个有钙化DCIS中,19个为肿块样强化,包括圆形2个、椭圆形5个、不规则形12个,边缘光滑5个、不规则11个、毛刺3个,病灶内部强化均匀5个、不均匀12个、环形强化2个;65个非肿块样强化,其中局灶性11个、线条状12个、节段性27个、区域性10个、多区域性5个,内部强化均匀11个、不均匀23个、集簇状16个、簇状环形15个。有钙化DCIS中,肿块样与非肿块样钙化DCIS间仅延迟强化方式差异具有统计学意义(P=0.04),见表2。
3 讨论
世界卫生组织2012年乳腺肿瘤分类将DCIS归为前驱病变[8]。随着乳腺X线摄影广泛用于乳腺癌筛查,DCIS检出率逐渐增高[9],但易漏、误诊无钙化DCIS。 DCIS-MI临床表现接近单纯DCIS,且病理学分型及治疗方法大致相同[10],2012年WHO乳腺肿瘤分类[11]亦未将其列为独立疾病类型,故本研究将其纳入分析。
MRI可从形态学及血流动力学角度对乳腺DCIS病灶进行分析,敏感性较乳腺X线摄影更高。本研究结果显示MRI对48个无钙化DCIS的敏感度为100%(48/48),明显高于X线摄影26/48,54.17%,χ2=28.54,P<0.01)。本组1个DCIS病灶X线摄影显示存在簇状分布、细小多形性钙化DCIS,而MRI未能发现,可能与病灶较小且乳腺背景强化明显有关。
既往研究[12]发现81%单纯DCIS的MRI表现为非肿块强化,18%为肿块强化,1%为点状强化。SCOTT-MONCREFF等[4]分析65个无钙化DCIS,肿块样强化20个(30.77%)、非肿块样强化39个(60.00%),其中6个(9.23%)呈点状强化。本研究中75%(36/48)无钙化DCIS、77.38%(65/84)有钙化DCIS表现为非肿块样强化,且有、无钙化DCIS间病灶形态差异无统计学意义,与文献[4]报道相符,但未见点状强化病灶。在血流动力学方面,DCIS增强MRI表现常为早期强化速升、延迟期平台型(Ⅱ型),肿块样强化多呈速升-流出型(Ⅲ型)[13];有、无钙化DCIS间血流动力学参数差异无统计学意义,均以Ⅰ型TIC多见[4]。本研究无钙化DCIS(93.75%,45/48)较有钙化DCIS(77.38%,65/84)多见早期快速强化,而延迟强化方式差异无统计学意义,57.89%(11/19)有钙化肿块样强化DCIS延迟强化方式为流出型,50.77%(33/65)非肿块强化DCIS为平台型;无钙化DCIS中,肿块样与非肿块样强化病灶早期强化及延迟强化方式差异均无统计学意义,与既往研究有所不同,推测与本组病灶较大、血流动力学特征以恶性可疑(Ⅱ型及Ⅲ型)更多见有关。
DCIS核分级与预后具有相关性,高核级DCIS术后复发率较高,术前诊断高核级无钙化DCIS对个体化治疗非常重要。本研究中有、无钙化DCIS之间核分级差异具有统计学意义,有钙化DCIS中高核级占比最大(64.71%,55/85),提示无钙化DCIS可能与非高核级及坏死出现较少有关,与MUN等[5]研究结果一致,有待进一步观察。ER、PR、HER-2表达是反映乳腺癌预后的重要指标,ER、PR是乳腺癌的保护因素,HER-2与肿瘤增殖、侵袭及肿瘤复发相关。有学者[14-16]认为钙化DCIS的HER-2阳性表达率高,但本研究有、无DCIS间差异均无统计学意义。
综上所述,MRI对无钙化DCIS的敏感性高于X线摄影;无钙化DCIS以非高核级、MRI增强早期迅速强化多见。本研究存在的局限性:①单中心研究,样本量较少;②仅根据术前X线摄影判断病灶有无钙化,未对手术标本进行验证。
