植物异戊烯基转移酶研究进展
2021-04-26陈妤朱沛煌李荣朱灵芝季孔庶
陈妤 朱沛煌 李荣 朱灵芝 季孔庶
(南京林业大学林木遗传与生物技术省部共建教育部重点实验室 南方现代林业协同创新中心,南京 210037)
类异戊二烯(Isoprenoids)在自然界中无处不在,包括古细菌、细菌、真核生物等,是种类最多的一类次生代谢产物,它们是细胞一级和二级代谢的组成部分,在信号转导、适应气候、繁殖及防御机制等方面发挥作用[1-2]。类异戊二烯化合物不仅参与植物生长发育和环境应答等重要的生理过程,而且在制药、天然乳胶、香料和有机合成领域也有应用[3]。负责形成和修饰超过六万种类异戊二烯化合物的是异戊烯基转移酶(Prenyltransferase,PT),又称类异戊二烯基焦磷酸合酶(Isoprenyl diphosphate synthases,IPPS 或IDS),广泛存在于生物界[4]。异戊烯基转移酶可分为顺式异戊烯基转移酶(Cis-prenyltransferase)和反式异戊烯基转移酶(Trans-prenyltransferase)两个类型。顺式异戊烯基转移酶通常催化合成碳骨架长度大于C50的聚异戊二烯,而反式异戊烯基转移酶催化合成碳骨架长度小于C50的类异戊二烯化合物[5],前者所得产物表现出混合的双反式-多顺式或三反式-多顺式立体异构,后者所得产物则表现出反式立体异构[6]。聚异戊二烯(Polyisoprenoid)及其衍生物具有多种生物学功能[7],如叶绿体中含量丰富的聚戊烯醇(Polyprenols)会影响光合效率,多萜醇(Dolichols)是蛋白质糖基化过程中必需的糖载体,有的聚异戊二烯具有调节膜性质的能力,可作为蛋白质异戊酮的供体[8]。目前对植物细胞内聚异戊二烯合成途径及其功能的认识还相当有限,并且对聚异戊二烯生物合成的调控机制还不清楚。异戊烯转移酶不仅能催化产生一个C-C 键(N-C 键),还能在终产物中引入一个与类异戊二烯化合物生物活性有关的双键[4]。根据生成的碳链长度,反式异戊烯基转移酶又可分为短链异戊烯基转移酶(C10-25)、中链异戊烯基转移酶(C30-35)和长链异戊烯基转移酶(C40-50)[9]。短链异戊烯基转移酶有香叶基焦磷酸合酶(Geranyl diphosphate synthase,GPPS,C10)、法尼基焦磷酸合酶(Farnesyl diphosphate synthase,FPPS,C15)、香叶基香叶基焦磷酸合酶(Geranylgeranyl diphosphate synthase,GGPPS,C20)和香叶基法尼基焦磷酸合酶(Geranylfarnesyl diphosphate synthase,GFPPS,C25),它们各自的产物GPP、FPP、GGPP和GFPP 可作为几种下游酶,如萜类合成酶(Terpene synthase,TPS)、角鲨烯合成酶(Squalene synthase,SQS)及八氢番茄红素合成酶(Phytoene synthase,PSY)等的底物,生成萜烯化合物(Terpenoids)、角鲨烯(Squalene)及八氢番茄红素(Phytoene)等,这些异戊烯基转移酶是类异戊二烯生物合成的重要分支点[10]。中链异戊烯基转移酶包括细菌所具有的六异戊烯基二磷酸合酶(HexPPS)、七异戊烯基二磷酸合酶(HepPPS)等。长链异戊烯基转移酶催化合成长度超过40 个C 的反式化合物,此类酶需要异戊烯载体蛋白(Prenyl carrier protein)才能把疏水反应产物转移出反应位点[11]。因植物异戊烯基转移酶大多为多次跨膜的膜结合蛋白,且植物遗传背景不清楚,克隆相关基因并进行外源表达有一定的难度,因此在分子水平上的研究报道甚少,但在微生物中异戊烯基转移酶的研究进展较快,大多进行了克隆及功能鉴定,个别酶类还完成了X 衍射三维晶体结构分析[12]。由于植物体中类异戊二烯化合物的形成主要依赖异戊烯基转移酶及其基因,因此对异戊烯基转移酶及其基因家族的研究不仅有助于解析类异戊二烯化合物生物合成与调控的机制,还可以为研究合成有生物活性的类异戊二烯化合物提供新的路径[13]。
1 植物类异戊二烯生物合成途径
异戊烯基二磷酸(Isopentenyl diphosphate,IPP)和二甲丙烯焦磷酸(Dimethylallyl diphosphate,DMAPP)是所有萜烯化合物生物合成的C5分子前体。它们来源于两种不同的代谢途径,即甲羟戊酸(Mevalonate-independent,MVA)途径和磷酸甲基赤藓糖(Methyl-erythritol 4-phosphate,MEP)途径[14-16]。其中,MVA 途径是以乙酰辅酶A 为底物,在植物细胞质中主要参与倍半萜烯、油菜素内酯、甾醇、三萜等的合成[17-18];而MEP 途径是以丙酮酸或磷酸甘油醛为底物,在植物质体中主要参与合成赤霉素、脱落酸、叶绿素、类胡萝卜素、单萜、二萜等物质[19-20]。IPP 在IPP 异构酶(Isopentenyl diphosphate isomerase,IPPI)的作用下可以转化成为DMAPP,在多种异戊烯基转移酶的作用下发生缩合反应。IPP和DMAPP 在异戊烯基转移酶的作用下可形成二聚体、三聚体、四聚体或五聚体等多聚体,分别为香叶基焦磷酸(Geranyl diphosphate,GPP,C10)、法尼基焦磷酸(Farnesyl diphosphate,FPP,C15)、香叶基香叶基焦磷酸(Geranylgeranyl diphosphate,GGPP,C20)和香叶基法呢基焦磷酸(Geranylfarnesyl diphosphate,GFPP,C25)[14-15]。这些异戊烯基 聚合物作为中间体在萜烯合成酶(Terpene synthases,TPS)的作用下最终转化为萜烯化合物,根据其产物碳链长度可分为:单萜(Monoterpenes,C10)、倍半萜(Sesquiterpenes,C15)、二萜(Diterpenes,C20)、二倍半萜(Sesterterpenes,C25)和三萜(Triterpenes,C30)等(图1)[14-15,21]。
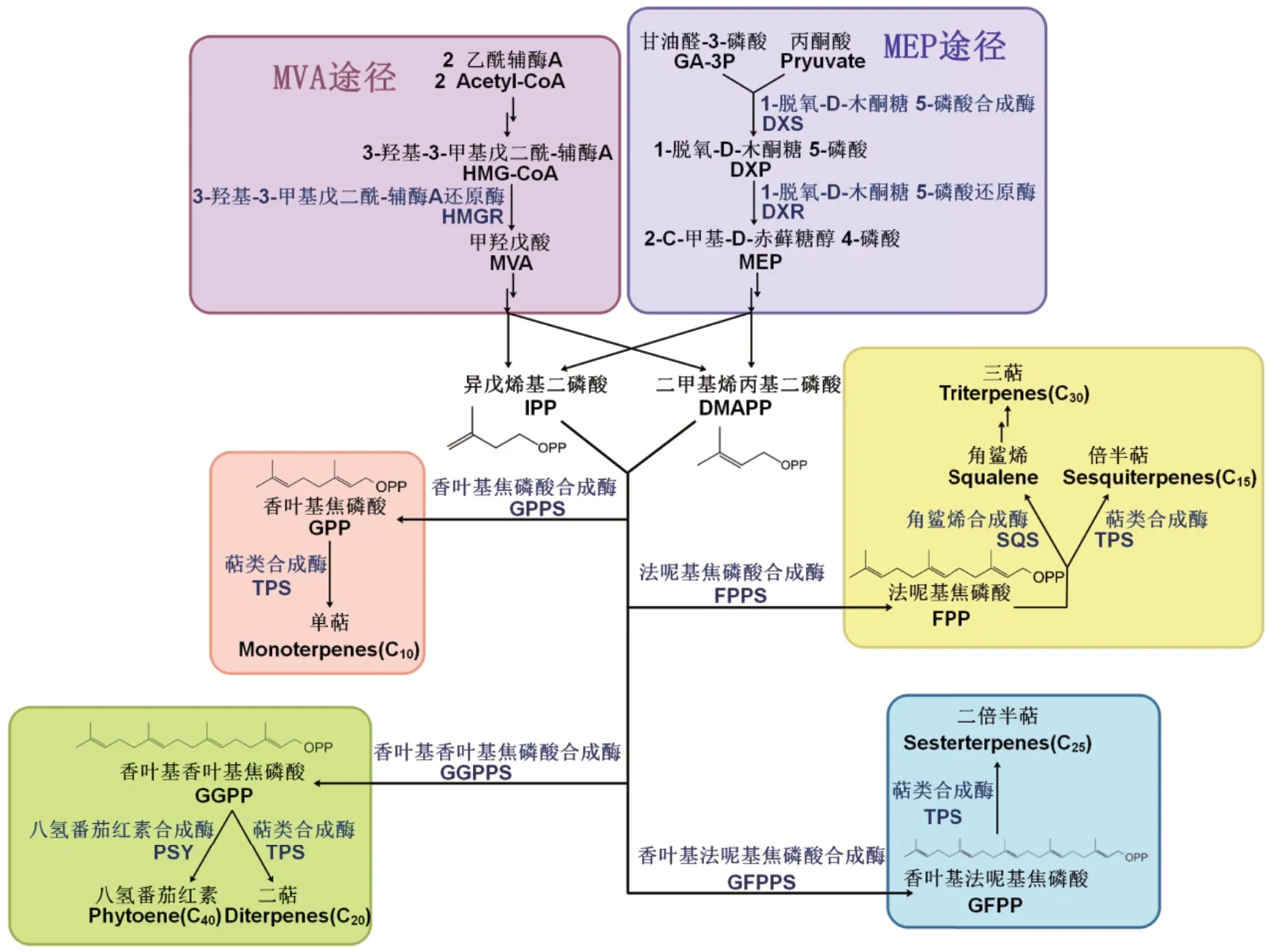
图1 植物类异戊二烯生物合成途径[14-15,21]
2 植物异戊烯基转移酶及其基因的研究现状
类异戊二烯化合物是自然界中化学成分最丰富的一类代谢产物,它是植物质膜结构的重要组成部分,在生物体内介导氧化还原反应,还具有调节繁殖周期、吸引配偶、传递转化信号等重要生理生化功能。在植物细胞内,类异戊二烯化合物是由不同数目的IPP 与DMAPP 作为初始物缩合而成,催化这一类过程的酶是异戊烯基转移酶,主要包括GPPS、FPPS、GGPPS 和GFPPS[22]。
GPPS 在植物中广泛存在,是萜烯化合物骨架代谢途径中的关键酶,主要参与薄荷醇、单萜吲哚生物碱和黄酮等物质的合成与调控,它的表达水平受到很多因素的影响,如亚细胞水平的特异分布、基因表达水平、蛋白翻译水平和蛋白聚合形式等[23-26]。Burke 等[23]首 先 从 荷 兰 薄 荷(Mentha spicata)、胡椒薄荷(Mentha×piperita)中克隆获得了两个GPPS基因的全长cDNA 序列,之后又从多种植物中分离出GPPS基因,如挪威云杉(Piceaabies)[27]、 长 春 花(Catharanthus roseus)[24]、 薄荷(Mentha haplocalyx)[28]、 金 鱼 草(Antirrhinum majus)[29]、拟 南 芥(Arabidopsisthaliana)[25]、啤酒花(Humulus lupulus)[26]、雷公藤(Tripterygium wilfordii)[30]和 滇 龙 胆(Gentiana rigescens)[31]等。 近 年 来,Adal 等[32]在 薰 衣 草(Lavandula angustifolia)中克隆出了GPPS基因并对其重组蛋白进行了功能鉴定,当小亚基LiGPPS.SSU1与大亚基LiGPPS.LSU在大肠杆菌中共表达时,得到的重组异源蛋白有GPPS 的活性,可产生GPP;Ueoka 等[33]利用EST 和同源克隆的方法克隆了紫草(Lithospermum erythrorhizon)中43 个胞质定位的GPPS基因LeGPPS,其重组蛋白主要产生GPP 及少量的FPP;通过对12 个蝴蝶兰属(Phalaenopsis)植物的GPPS基因上游启动子片段检测,发现双重复序列与单萜合成具有较强的相关性[34];Zhao 等[35]研究了山鸡椒(Litsea cubeba)单萜生物合成途径中的GPPS小亚基1(LcGPPS.SSU1)的功能,发现在野生山鸡椒中瞬时表达和在烟草中过表达均能提高单萜的产量,甚至在烟草中引入LcGPPS.SSU1会影响GGPP 的表达,从而提高二萜的产量;Kumar 等[36]通过在长春花(Catharanthus roseus)中超表达GPPS基因与香叶醇合酶基因(Geraniol synthase,GES),提高了吲哚生物碱的水平。
FPPS 参与一些植物激素与植物色素,如细胞分裂素、类胡萝卜素、叶绿素、脱落酸和赤霉素等类异戊二烯化合物的生物合成,这类有机化合物对维持植物生长发育具有重要作用[37],一些FPPS 也有细胞增殖或信号转导等作用[38]。目前,植物FPPS基因已经分别从水稻(Oryza sativa)[39]、高粱(Sorghum bicolor)[40]、白木香(Aquilaria sinensis)[41]、洋常春藤(Hedera helix)[42]及香樟(Cinnamomum camphora)[43]等数十种植物中得到分离。研究表明,在拟南芥中同时敲除FPPS1和FPPS2两个法呢基焦磷酸合酶基因,会导致拟南芥死亡[44];Fei 等[45]发现在灵芝(Ganoderma Lucidum)中过表达FPPS基因能导致角鲨烯合酶基因(Squalene synthase,SQS)和羊甾醇合酶(Lanosterol synthase)基因LS的转录水平上调,从而提高灵芝的灵芝酸产量。
GGPPS 能够催化IPP 和DMAPP 合 成GGPP 作为类维生素A、类胡萝卜素、二萜类化合物和天然橡胶等生物合成前体物质[46-49]。目前,已有多种植物的GGPPS基因得到研究,如南方红豆杉(Taxus wallichianavar. Mairei)[50]、 银杏(Ginkgo biloba)[51]、拟南芥[20]等。在一部分植物中,GGPPS以基因家族的形式存在,例如在拟南芥中发现了12 个GGPPS同源基因[20];Zhu 等[52]在丹参(Salvia miltiorrhiza)中分离出3 个GGPPS基因;李锋等[53]在烟草中也分离出4 个GGPPS基因。近两年对于GGPPS基因的研究较多,Su 等[54]在雷公藤中鉴定了8 个可被调控的GGPPS基因,其蛋白功能鉴定的研究表明GGPPS1 在合成与二萜、叶绿素及类胡萝卜素等相关的GGPP 上发挥主要作用,而GGPPS8 对雷公藤的根系生长有着重要的作用;Huang 等[55]从雨生红球藻(Haematococcus pluvialis)中分离出8 个预测的HpGGPPS候选基因,在大肠杆菌中异源表达鉴定其功能,结果表明其中两个蛋白具有GGPPS 的活性,参与色素的形成,为虾青素产量的提高提供了一条生产途径;陈建荣等[56]从栀子(Gardenia jasminoides)中克隆出GGPPS基因小亚基并进行生物信息分析,但未对其蛋白进行功能鉴定。
GFPPS基因与二倍半萜类化合物合成密切相关,最初是从嗜盐碱杆菌(Natronobacterium pharaonis)中被分离[57],只有在古细菌(Aeropyrum pernix)和甲烷八叠球菌(Methanosarcina mazei)等原核生物中被克隆出来[58-59]。然而,对植物GFPPS基因和二倍半萜类化合物的生物合成研究甚少,Nagel 等[60]在拟南芥和大肠杆菌中过表达GFPPS发现,产物大部分为GFPP;Wang 等[61]纯化了拟南芥中的10 个GGPPS,分析产物后发现其中4 个为GFPP,随后利用模型在芸苔属(Brassica)植物中验证其正确性;Liu 等[62]克隆了米团花(Leucosceptrum canum)基因LcGFPPS,在拟南芥中过表达GFPPS,验证其具有GFPP 的活性,是二倍半萜类化合物合成的前体物质,为其他物种研究二倍半萜类化合物的生物合成提供了一个途径。
3 异戊烯基转移酶基因保守结构域分析
异戊烯类化合物的生物合成均是由IPP 和DMAPP 经异戊烯基转移酶催化缩合而成,有着不同的碳氢链长度且有特异性,是许多类异戊二烯化合物的前体,因为它们的氨基酸序列有高度的相似性,因此这些酶被认为具有相似的结构和相同的催化机制[63-64]。利用Clustral X 软件我们对不同植物异戊烯基转移酶基因氨基酸序列的比对(图2),这些基因存在两个高度保守的富含天冬氨酸(Asp)的区域,第一个基序FARM(First aspartate-rich motif,DDX(2-4)D)和第二个基序SARM(Second aspartaterich motif,DDXXD)对促进催化功能和底物结合至关重要(其中D 表示Asp,X 表示任意氨基酸)[65],这两个基序是典型的异戊烯基转移酶活性结构域,是缩合反应的结合位点。Burke 等[23]分析了荷兰薄荷、胡椒薄荷与其他植物的GPPS 氨基酸序列,发现其中存在FARM 与SARM 基序;Szkopiñska 等[66]比对各个植物的FPPS 氨基酸序列发现了两个天冬氨酸FARM 和SARM 基序;Huang 等[55]比对了12个GGPPS 氨基酸序列,发现两个保守区域FARM 与SARM;Nagel 等[60]认为GFPPS 活性与特定的氨基酸残基有关,分析了拟南芥IDS 部分氨基酸序列,发现存在天冬氨酸保守区域FARM;Liu 等[62]比对了其他植物与5 个米团花GFPPS 氨基酸序列发现,这些序列中存在5 个保守区,包括两个保守的天冬氨酸基序(DDLPCMD 和DDILD)。
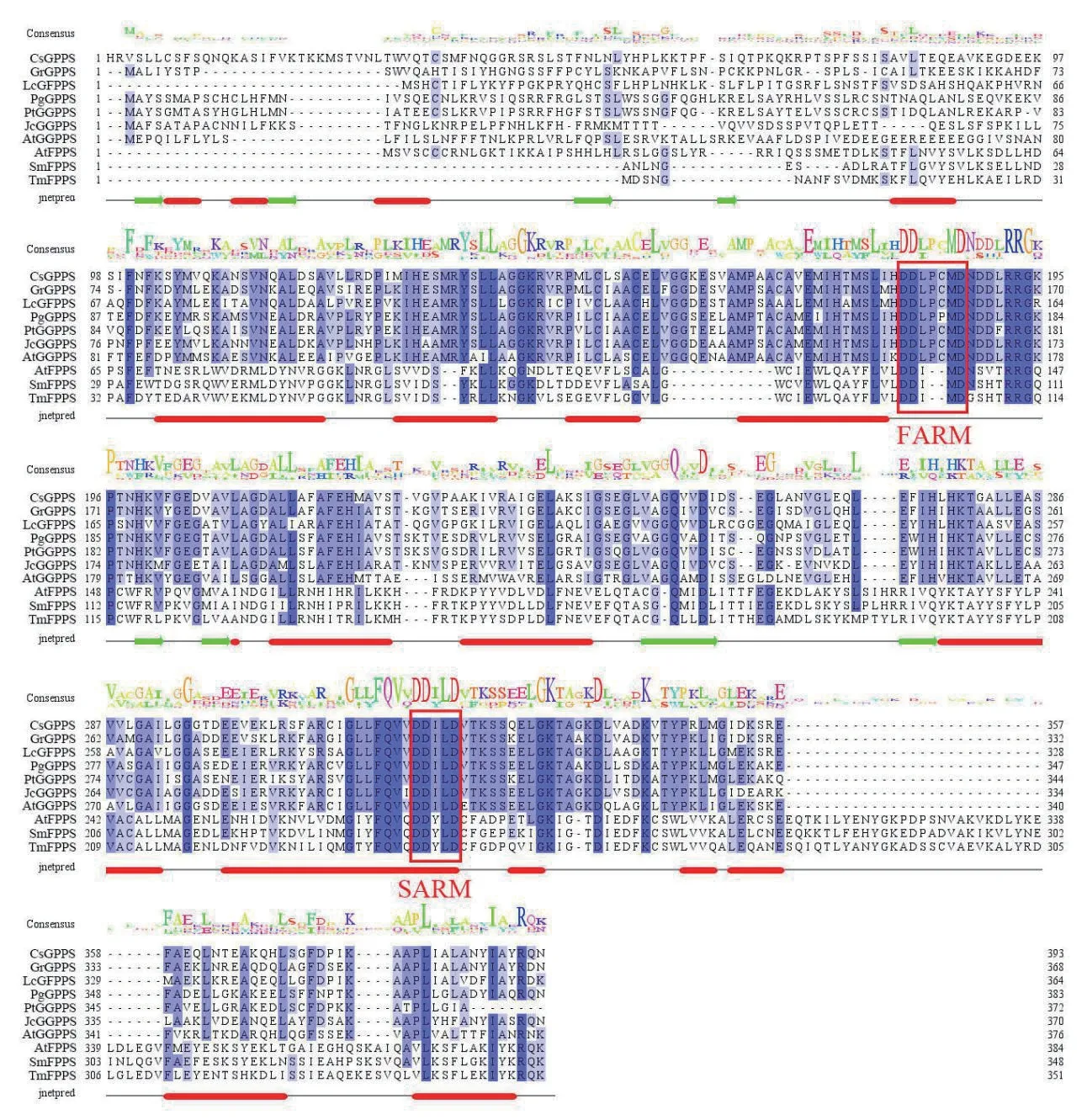
图2 异戊烯基转移酶基因氨基酸序列比对
4 异戊烯基转移酶基因家族分子系统进化分析
近年来,为探讨植物异戊烯基转移酶基因家族的进化关系,Liu 等[62]对植物的IDS基因用极大似然法构建了系统进化树,其结果主要分为A、B 两簇,A 簇包含两个亚簇 I 和 II,FPPS基因主要在B簇,而A 簇中大部分是GPPS、GGPPS与GFPPS基因,表明其分类是依据生化功能的相近程度,而不是分类起源;Huang 等[55]构建了GGPPS基因的进化树,8 个雨生红球藻HPGGPPS基因被分到了3 个不同的平行组,表明它们分别与各自组中GGPPS基因的功能相近;Su 等[54]将雷公藤的8 个GGPPS基因与其他植物异戊烯基转移酶基因家族成员一起构建进化树,结果表明这8 个GGPPS基因依据功能相近程度被分散在各个分支上。
我们从NCBI 上下载各个植物异戊烯基转移酶基因,利用分子进化遗传分析软件MEGA7 构建了系统进化树(图3),结果表明,FPPS基因单独聚集成一大类,属于一个独立的分支,而其余3 个基因GPPS、GGPPS和GFPPS聚集成另一大类,其中裸子植物的GPPS、GGPPS基因在同一分支上,表明其功能相近,这与上述研究结果一致。
5 针叶树异戊烯基转移酶基因的研究
裸子植物包括松杉纲(Coniferopsida)、苏铁纲(Cycadopsida)、银杏纲(Ginkgopsida)和买麻藤纲(Gnetopsida)是一种古老而广泛的胚珠裸露不被子房包被的植物,具有重要的经济和生态价值[67],。除买麻藤纲外,现已在银杏纲、松杉纲和苏铁纲发现了多个IDS[68]。裸子植物的针叶树种占世界森林39%,对北半球和南半球依赖林业的经济体具有巨大价值[69]。针叶树会产生复杂的单萜、倍半萜和二萜等次生代谢物,最显著的形式是松脂,是由松树树脂道中的泌脂细胞生成的天然树脂[70],可以抵御昆虫和病原菌攻击的物理和化学防御[71-75]。通过加热蒸馏等简单步骤去除杂质后可制成松节油(单萜和倍半萜)、松香(二萜树脂酸)和其他重要的工业原料,广泛应用于造纸、油漆、合成橡胶、涂料、纺织、医药、食品、肥皂、印染等多个领域[76-77],加工后又可作为高品质的生物燃料[78]。在受到生物或非生物刺激后,针叶树会从树脂道中释放松脂,并诱导松脂合成,因此,松脂在针叶树的防御系统中也起重要的作用[79-83]。
相较于被子植物,裸子植物异戊烯基转移酶基因的研究较少,目前已从银杏中克隆到的有GbIDS1、GbIDS2-1、GbIDS2(登陆号分别为:DQ251631、DQ251632 和DQ251633)[68], 和GbFPPS(登陆号:AY389818)[84];表1 是从部分针叶树中克隆到的异戊烯基转移酶基因,对白云杉过表达IDS基因,研究发现单萜与二萜酸的含量无显著变化,而产生大量的香叶基香叶基脂肪酸酯(Geranylgeranyl fatty acid esters)用于抵御模毒蛾(Lymantria monacha)[85];从挪威云杉中克隆出3 个IDS基因,其纯化的重组蛋白分析表明,其中一个基因编码FPPS,另外两个编码GGPPS,而这3个基因中,只有一个参与松脂的生物合成[86];Liao等[87]在曼地亚红豆杉中分离出FPPS基因,并发现重组FPPS 蛋白能催化IPP 底物缩合生成FPP;Burke 等[88-89]在冷杉中分离出GPPS与GGPPS基因,发现重组GPPS 与GGPPS 蛋白可以催化IPP 和DMAPP 底物分别生成GPP 与GGPP;从加拿大红豆杉中克隆了GGPPS基因,并在茉莉酸甲酯(Methyl Jasmonate)处理后检测到GGPPS 与紫杉烯合酶(Taxadiene synthase)的活性有较大提高[90];陈博雯等[91]从马尾松中分离出GGPPS基因,仅对其进行生物信息学分析,未对酶功能作鉴定;钱丹等[92]从海南粗榧(Cephalotaxus mannii)克隆了GGPPS基因,用真菌和细菌的激发子以及茉莉酸甲酯处理海南粗榧,均发现GGPPS基因的表达量上升,但程度和持续时间有所不同。
6 展望

图3 不同植物异戊烯基转移酶基因系统进化树
类异戊二烯化合物及其衍生物萜烯类物质功能复杂,在药物、农林业等各个行业有着极大的应用前景,因此了解它们的生物合成方式并研究其合成途径中的关键酶及其基因,是推动这些化合物应用的基础。同时,由于很多针叶树种含有以类异戊二烯的衍生物萜类为主要成分的松脂,不仅能为产脂的林业化学工业带来可观的经济效益,而且是针叶树抵御许多有害生物的重要自源物质[93],如松树萎蔫病是由松材线虫引起的一种严重威胁森林安全的毁灭性松树病害,据国家林业和草原局2019 年第4号公告显示,松材线虫病在全国18 个省(直辖市、自治区)588 个县级行政区发生危害面积64.93 万hm2;自我国1982 年首次发现30 多年来累计造成数十亿株松树死亡,经济损失上千亿元,我国包括绝大部分马尾松林在内的广大面积松林正面临着松材线虫病爆发的严重威胁,当下对之仍束手无策。但有研究表明α-异松油烯和β-水芹烯对松材线虫繁殖有较强抑制,并且β-水芹烯与莰烯具有杀线虫活性[94]。而目前对于类异戊二烯生物合成的相关报道相对少,因此研究其合成的分子机制可为树木高产脂和抗性遗传育种提供理论依据。
近年来,研究者已在多种植物中分离出类异戊二烯化合物生物合成的关键酶基因GPPS、GGPPS、FPPS与GFPPS,并分析其功能,但大多数研究只针对单个基因的克隆及表达,缺乏对通路上相关基因的综合深入研究,而事实上相关多基因互作对于其整体的表达水平影响更为广泛。此外,对于类异戊二烯化合物生物合成酶的功能鉴定,大部分研究仍停留于对模式植物拟南芥和烟草的分析,很少在同源植物上进行过表达及功能鉴定,也未能将研究成果运用到实际生产中。可见今后极有必要通过前沿性的组学研究手段,进一步阐明重要造林树种(特别是主产松脂的松类树种)类异戊二烯化合物生物合成的相关机制。
目前,这些基因的研究主要集中于被子植物,裸子植物中的相关研究较少,且对于异戊烯基转移酶在裸子植物中进行功能方面的鉴定鲜见报道,可能是由于多数裸子植物的遗传转化体系还未成功建立,离体培养植株再生是其组织培养中难度较大的一个领域,还有待于进一步深入研究,并实现技术的熟化。此外,类异戊二烯化合物生物合成酶的相关研究(包括分离提纯、理化性质分析、催化机制研究等)也有待深入,以便能为人类在模拟生物合成领域拓展新思路,为进一步开发利用类异戊二烯化合物创造条件。
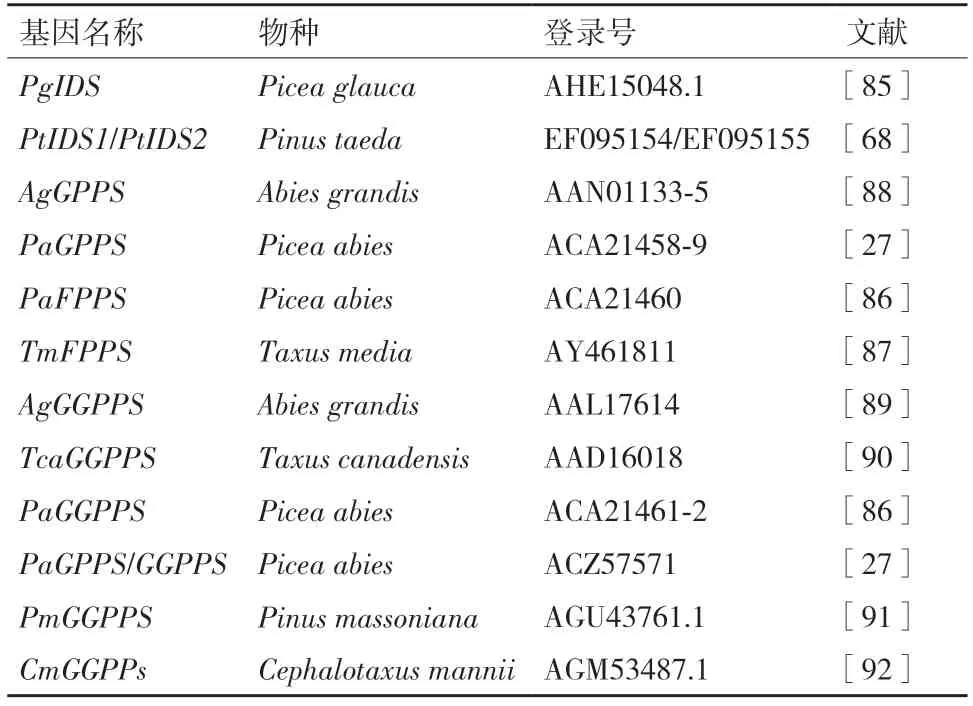
表1 针叶树中已克隆的部分异戊烯基转移酶基因
